MRI在多发性肌炎、皮肌炎诊疗中的应用
黄振国,闫 燃,张雪哲,王丽雯,王国春,卢 昕,章 璐,王 武*
多发性肌炎(PM)、皮肌炎 (DM) 是以近端骨骼肌损害为主要表现的自身免疫性疾病,其主要临床表现为对称性近端肌无力、疲乏和血清肌酶水平增高,同时DM伴有特征性皮疹。血清肌酶水平的测定、肌电图和肌活检是以往PM、DM的主要诊断方法[1],随着肌肉MRI检查在PM、DM中的应用,其在该病诊疗中的价值越来越受到关注[2-7]。笔者通过对36例PM、DM患者腿部肌肉MRI检查的回顾性分析,旨在探讨PM、DM患者肌肉MRI表现,评价MRI在该病诊断和疗效评估中的价值。
1 材料与方法
1.1 临床资料
搜集我院2010年6月至2012年3月期间行双侧大腿肌肉MRI检查且符合Bohan和Peter1975年提出的PM、DM诊断标准(B/P标准)[1]的病例36例,其中包括皮肌炎21例、多发性肌炎15例;患者中男14例、女22例;年龄11~75岁,平均(46.5±17.4)岁。病程1个月至20年,平均(3.1±4.8)年。36例全部进行了治疗前血清肌酶测定,其中26例血清肌酶水平升高,余10例在正常范围。36例中28例进行了肌电图检查,其中16例显示肌源性损害,1例肌源性损害合并神经源性损害,3例显示单纯神经源性损害,8例未见明确异常。32例进行了肌肉活检,其中29例诊断为PM、DM,其余3例未显示明确炎性改变。
1.2 MRI检查方法
应用荷兰Philips Intera 1.5 T MR机进行双侧大腿肌肉MRI检查,选用体线圈,获取快速自旋回波横轴面T1WI、T2WI、短时反转恢复(STIR)图像和冠状面STIR图像。扫描参数:层厚6 mm、间距1 mm,T1WI TR 450 ms,TE 13 ms;T2WI TR 3000 ms,TE 125 ms,STIR TR 4000 ms,TE 160 ms,TI 160 ms。全部36例进行了治疗前双侧大腿肌肉MRI检查,8例进行了治疗后MRI复查,复查时间为治疗后1~6个月。
1.3 MRI结果判定
由2名副高以上称职的放射科医师分别进行单独阅片,记录MRI表现,意见出现分歧时由另外1名副高以上职称的放射科医师参与共同阅片,以最终达成的一致意见为准。
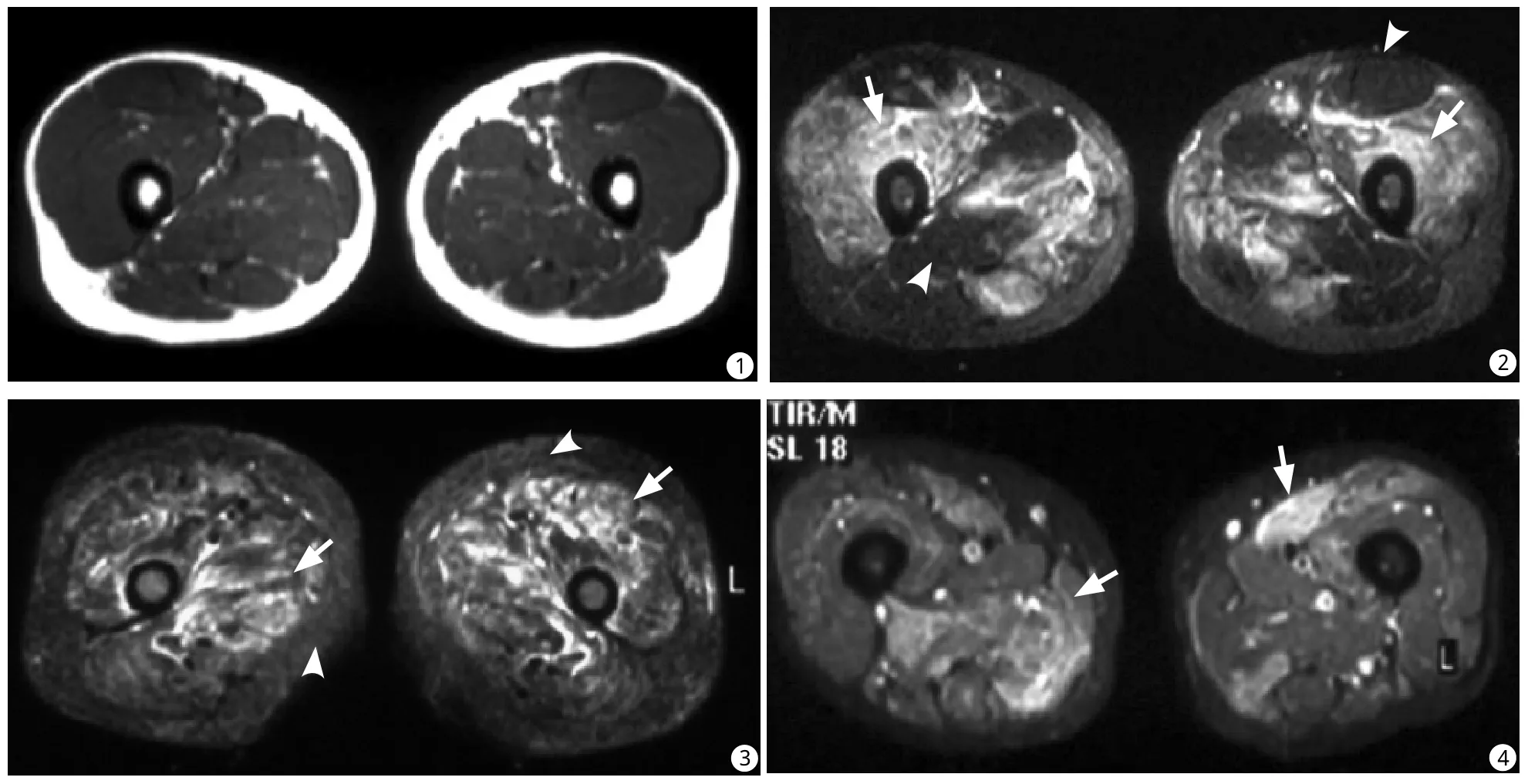
图1,2 皮肌炎患者肌肉水肿。同一层面MR T1WI (图1)和STIR (图2)图像。在STIR上水肿肌肉呈明显的高信号(白箭),未受累肌肉呈低信号(白箭头);T1WI上受累肌肉与正常肌肉信号相近 图3 皮肌炎患者肌肉水肿伴随皮下组织水肿。STIR显示高信号肌肉水肿区呈双侧弥漫性分布(白箭),同时双侧皮下脂肪信号增高(白箭头) 图4 多发性肌炎患者肌肉水肿。STIR显示高信号肌肉水肿区呈散在性分布(白箭),且两侧明显不对称Fig. 1, 2 Muscule edema in a patient with DM. Fig. 1: On T1WI, major muscle groups showed homogeneous signal intensity.Fig. 2: On STIR, affected muscles showed increased signal intensity (arrow) and non-affected muscles showed normal low signal intensity (arrowhead). Fig. 3 edema in muscles and subcutaneous tissue in a patient with DM. On STIR, diffuse increased signal intensity in muscles (arrow) and subcutaneous connective tissue (arrowhead) were seen, indicating in flammatory in filtration. Fig.4 Muscule edema in a patient with PM. On STIR, muscle in flammation manifested patchy and asymmetric distribution (arrow).
2 结果
2.1 PM、DM患者肌肉MRI表现
36例PM、DM中31例大腿肌肉MRI显示异常,异常表现包括:(1)肌肉炎性水肿30例,病变区于T1WI上呈等信号(图1),T2WI和STIR上呈高信号(图2),肌束的结构和形态保持完好,肌束间分界清晰。病变均累及于双侧,多组肌肉同时受累。病变呈弥漫性分布14例(图3),呈散在多发斑片状16例(图4);双侧对称或基本对称性分布18例(图5),不对称性分布12例(图4)。(2)肌筋膜炎7例,表现为肌筋膜增厚,T1WI上呈等信号,显示欠佳;T2WI和STIR上肌间隙呈线状异常高信号(图6),全部7例肌筋膜炎均伴有肌肉炎性水肿。(3)皮下软组织水肿14例,MRI上表现为T1WI上皮下脂肪内线状或网格状低信号,相应区域于T2WI上呈稍高信号,STIR上呈弥漫或网格状高信号,14例皮下水肿病例均伴有肌肉水肿(图7)。(4)肌肉萎缩伴脂肪浸润5例,表现为肌束变细、肌间隙增宽,病变肌肉及肌间隙内可见短T1、长T2脂肪信号(图8)。
MRI未见明确异常改变患者中包括2例PM和3例DM,考虑可能与炎性病变程度较轻及处于非活动期有关。
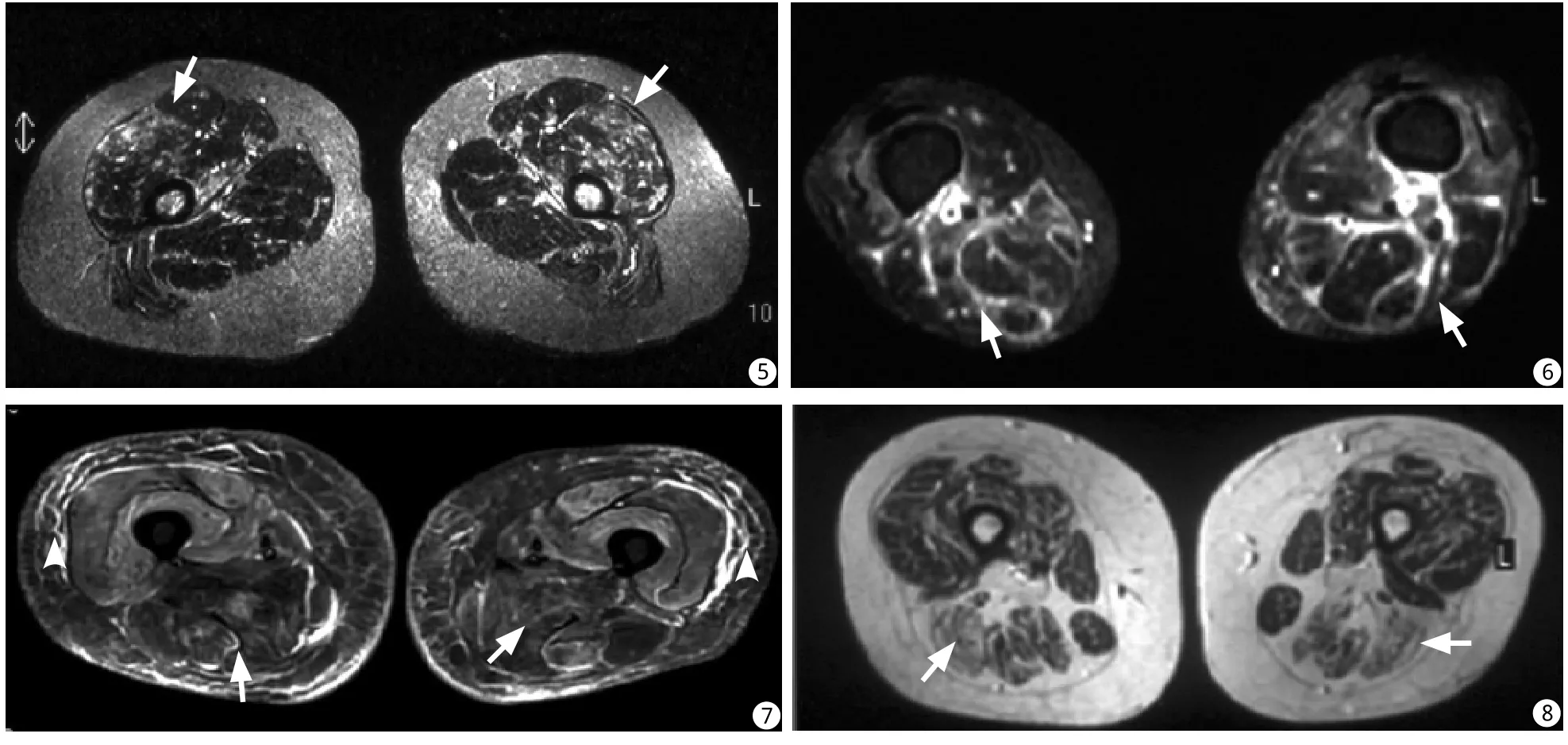
图5 皮肌炎患者肌肉水肿。STIR上病变区呈双侧散在、对称性分布(白箭),同时皮下脂肪信号增高提示合并皮下水肿图6 多发性肌炎患者肌筋膜炎合并肌肉水肿。STIR上见肌肉间隔增厚,呈线状高信号(白箭),伴有肌肉内散在的信号增高区 图7 皮肌炎患者皮下组织及肌肉水肿。STIR序列显示双侧腿部皮下组织内见弥漫的网格状异常高信号区(白箭头),同时腿部肌肉信号不均匀性增高(白箭) 图8 多发性肌炎患者肌肉萎缩伴脂肪浸润。T1WI显示双侧肌束变细,肌间隙增宽,同时肌肉内见脂肪性高信号区,以后部肌肉明显(白箭)Fig. 5 Axial STIR of a patient with DM. muscle inflammation was patchy and symmetric distribution. subcutaneous tissue showed higher signal, indicating inflammatory edema. Fig. 6 Fascial inflammation accompanying with muscle edema in a patient with PM. On STIR, In flammatory in filtrates were visible as high signal intensity lines along the fascia (arrow) and patchy increased signal in muscles. Fig. 7 edema in muscles and subcutaneous tissue in a patient with DM. On STIR, net and string like much higher signal was seen in bilateral subcutaneous tissue(arrowhead), accompanying inhomogeneous higher signal in muscles(arrow). Fig. 8 Atrophy and fatty in filtration in a patient with PM. On T1WI, muscles volume loss and fatty in filtration were present in all the groups with predominance in posterior muscles(arrow).
2.2 MRI各检查序列显示病变敏感性对比
对肌肉水肿、皮下软组织水肿、肌筋膜炎等急性炎性反应,T1WI上病变区呈等信号或稍低信号,诊断敏感度差;T2WI、STIR序列上急性炎症区呈高信号,其可显示病变的大小、形态、累及范围和严重程度。36例中STIR序列显示肌肉水肿、皮下软组织水肿、肌筋膜炎分别为30、14和7例,T2WI显示上述改变的例数分别25、10和6例,T2WI未能显示5例程度较轻的肌肉水肿、4例皮下水肿和1例肌筋膜炎。T1WI、T2WI、STIR均全部显示5例肌肉萎缩,同时T1WI、T2WI均显示了肌肉内伴随的脂肪浸润,由于肌肉脂肪浸润和水肿于T2WI上均呈高信号,有时容易混淆,因此T1WI序列更适宜观察肌肉萎缩和脂肪浸润。
2.3 治疗前、治疗后MRI对比
8例治疗后复查MRI中3例显示肌肉炎性水肿完全吸收(图9),5例STIR上显示炎性水肿较治疗前病变范围明显缩小、信号较前减低(图10)。
3 讨论
3.1 PM、DM的以往诊断方法及不足
目前临床上诊断PM、DM大多仍沿用Bohan和Peter在1975年提出的标准(B/P标准)[1]即:(1)对称性肌无力;(2)肌肉活检特征性病理改变;(3)血清肌酶升高;(4)肌电图肌源性损伤;(5)特征性皮损。具备前4项中的3项加皮损确诊为DM,具备前4项中的3项而无皮损确诊为PM。可见除临床症状外血清肌酶检查、肌电图和肌活检是以往诊断PM、DM的主要方法。上述检查方法有以下的局限性:(1)无论肌活检还是肌电图均只能显示局部肌肉的状况,由于炎症分布不均匀,在此块肌肉存在明显的炎症,而邻近肌肉却可基本正常,同一块肌肉的不同区域炎症的程度也往往不同。在炎症不明显的部位活检或行肌电图检查可能导致正常或模棱两可诊断。本组36例中28例进行了肌电图检查,其中仅17例显示肌源性损害(其中1例为肌源性损害合并神经源性损害);进行了肌肉活检的32例中有3例未显示明确炎性改变,也反映出此方面的问题。血清肌酶检测简单、方便,但约20%左右的PM、DM患者血清肌酶水平正常或轻度增高,因此血清肌酶正常并不能排除肌炎。有相当比例的临床上的PM、DM患者不能完全满足B/P诊断原则,给诊断和治疗带来困难。(2)不利于临床治疗过程中疾病活动度的判断和疗效评估。皮质激素和免疫抑制剂仍然是治疗PM、DM的首选药物,在治疗过程中皮质激素的撤减是治疗的关键问题。一方面,长期大剂量应用皮质激素,会出现较严重的不良反应;另一方面激素的减量过快会导致病情复发。因此在治疗过程中对每位患者必须反复多次评估疾病活动度和激素用量。肌肉活检和肌电图均为有创检查,不宜反复进行。血清酶学检查简单、方便、可重复进行,但部分PM、DM患者血清肌酶水平正常或只轻度增高,同时有部分患者血清肌酶的改变不能很好地反映治疗的疗效,给临床处理带来困难。因此临床上亟待一种客观、敏感、无创的检查方法来弥补血清肌酶水平、肌肉活检、肌电图检查的不足,进一步完善PM、DM诊断标准。
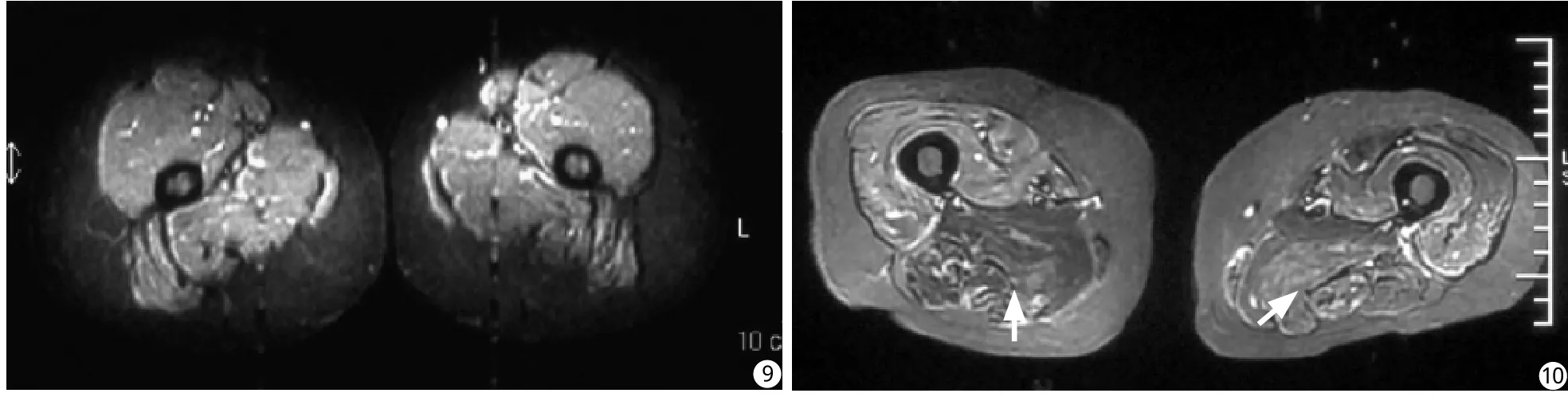
图9 为图5相对应层面治疗后复查STIR图像。显示原肌肉水肿区消失,同时皮下组织信号恢复正常 图10 为图7相对应层面治疗后复查STIR图像。显示原肌肉水肿所致高信号区缩小(白箭),治疗前皮下组织内网格状高信号消失Fig. 9 STIR image obtained after 3 months of treatment in patient of Fig 5. After treatment the higher signal of oedematous muscles disappeared and subcutaneous tissue showed normal signal. Fig. 10 STIR image after 1 month of treatment in patient of Fig 7. the area of muscle in flammation decreased and the net and string like much higher signal in subcutaneous was disappeared.
3.2 MRI检查在PM、DM诊疗中的应用价值
MRI是目前肌肉软组织影像学最佳检查方法,MRI在肌肉骨骼病变诊疗中有如下优势:(1)高的软组织分辨率和空间分辨率,可敏感地显示肌肉骨骼结构和信号的改变,本组36例PM、DM中有31例肌肉MRI存在异常改变。(2)大范围扫描,可同时观察双侧下肢甚至全身肌肉的状况[4-5]。大范围评估肌肉受累范围、分布和程度,可弥补肌电图和肌活检只能显示局部肌肉状况的不足。在MRI显示炎症明显的区域进行活检、肌电图检查可明显提高诊断敏感性,降低假阴性[6]。(3)MRI检查无创、对身体无害,因此可反复进行。同时,功能MRI检查可用于定量诊断。Maillard 等[8]研究显示肌肉T2弛豫时间与PM、DM病变的活动性高度相关。同时有研究表明MRI扩散加权成像亦可用于PM、DM患者病变活动度的判定[9]。因此,MRI检查除可用于PM、DM的定性诊断外,还可用于治疗过程中疾病活动度的判定和疗效评估。本组8例治疗后复查MRI均显示炎性水肿较治疗前明显好转、吸收。国际肌炎评估和临床研究组建议在沿用前述的B/P诊断标准的基础上,将MRI检查中肌肉炎性水肿作为诊断依据,MRI检查发现肌肉炎症可替代临床表现或实验室异常。
3.3 PM、DM患者肌肉MRI异常表现
PM、DM患者肌肉MRI改变包括急性炎症改变和晚期炎症后遗改变。急性炎症改变病理基础是肌间隙、肌束内和小血管周围炎性细胞浸润致病变区含水量增加,依据炎症累及部位表现为皮肤及皮下组织水肿、肌肉水肿和肌筋膜炎[10-11]。炎性水肿在T2WI上呈高信号,因为脂肪和水肿在T2WI上均呈高信号,因此脂肪的存在可能会影响T2WI上显示水肿的敏感性,尤其对于皮下脂肪内水肿的显示。应用脂肪抑制技术去除脂肪组织的干扰有利于水肿的显示,STIR和脂肪抑制T2WI为最常应用的抑脂序列,本组资料显示STIR序列可显示T2WI不能显示的程度较轻的水肿区,其结果与文献报道一致[11]。晚期炎症后遗改变主要是肌肉萎缩和伴随的脂肪浸润,其在T1WI上可清晰显示。
综上所述,肌肉MRI检查是一种敏感、无创、高效的影像学诊断方法,其可显示PM、DM患者骨骼肌炎性水肿、肌肉萎缩及脂肪浸润、替代等病理改变,在炎性肌病的诊断、疗效评估、指导临床合理治疗方面有高的应用价值。肌肉和皮下组织水肿是PM、DM患者最常见的MRI表现。
[References]
[1] Olsen NJ, Park JH. Inflammatory myopathies: issues in diagnosis and management. Arthritis Care Res, 1997,10(3): 200-207.
[2] Walker UA. Imaging tool for the clinical assessment of idiopathic inflammatory myositis. Curr Opin Rheumatol,2008, 20(6): 656-661.
[3] Park JH, Olsen NJ. Utility of magnetic resonance imaging in the evaluation of patients with in flammatory myopathies.Curr Rheumatol Rep, 2001, 3(4): 334-345.
[4] O'Connell MJ, Powell T, Brennan D, et al. Whole-body MR imaging in the diagnosis of polymyositis. AJR Am J Roentgenol, 2002, 179(4): 967-971.
[5] Cantwell C, Ryan M, O'Connell M, et al. A comparison of in flammatory myopathies at whole-body turbo STIR MRI.Clin Radiol, 2005, 60(2): 261-267.
[6] Connor A, Stebbings S, Anne Hung N, et al. STIR MRI to direct muscle biopsy in suspected idiopathic in flammatory myopathy. J Clin Rheumatol, 2007, 13(6): 341-345.
[7] Tomasova Studynkova J, Charvat Jarosova K, Vencovsky J. The role of MRI in the assessment of polymyositis and dermatomyositis. Rheumatology (Oxford), 2007, 46(7):1174-1179.
[8] Maillard SM, Jones R, Owens C, et al. Quantitative assessment of MRI T2 relaxation time of thigh muscles in juvenile dermatomyositis. Rheumatology (Oxford), 2004,43(5): 603-608.
[9] Qi J, Olsen NJ, Price RR, et al. Diffusion-weighted imaging of inflammatory myopathies: polymyositis and dermatomyositis. J magn reson imaging, 2008, 27(1):212-217.
[10] Kimball AB, Summers RM, Turner M, et al. Magnetic resonance imaging detection of occult skin and subcutaneous abnormalities in juvenile dermatomyositis.Arthritis Rheum, 2000, 43(8): 1886-1873.
[11] Zhang KB, Hua J, Zou AH, et al. Value of fat suppression techniques in the MR imaging diagnosis of polymyositis and dermatomyositis. Chin J Magn Reson Imaging, 2011,2(2):99-103.张科蓓, 华佳, 邹爱华, 等. 脂肪抑制技术在多肌炎、皮肌炎磁共振诊断中的应用价值. 磁共振成像, 2011, 2(2):99-103.

