表观扩散系数鉴别良恶性软组织肿瘤价值的Meta分析
李树金,吴晓冰,张绍伟,刘起旺,代丽萍
近年来,有许多研究用扩散加权成像(diffusionweighted imagine, DWI)的方法来鉴别肌骨类肿瘤的良恶性。然而由于人群间疾病的异质性、单个研究样本量小导致统计效力的局限性及选取标准不同等因素的影响,用DWI序列测定表观扩散系数(apparent diffusion coefficient, ADC)值定量评价肌骨肿瘤的良恶性的研究结果存在较大的争议。为了减小研究间的偏倚,提高关联分析统计的效力,笔者用Meta分析的方法对以往研究结果进行综合定量评价,观察ADC值与肌骨类肿瘤良恶性的相关性。
1 材料和方法
1.1 文献检索与筛查范围
检索数据库包括Pubmed、Medline、SpringerLink、Elesevier、OVID、万方、维普数据库、中国生物医学文献数据库(CBMdisc)及中国学术期刊网全文数据库(CNKI)。检索语种为汉语和英语。检索在2002年1月至2012年2月公开发表的文献。中文检索词包括:软组织肿瘤、骨骼肿瘤、骨肌肿瘤、磁共振、扩散加权成像。英文检索词包括:soft-tissue neoplasm,soft-tissue tumor、softtissue masses、musculoskeletal system、magnetic resonance (MR)、diffusion-weighted imagine (DWI)。另外还采取了手工检索和参考文献回溯法寻找更多的文献。
1.2 文献纳入标准
(1)文献提供有良性及恶性病变的平均表观扩散系数(apparent diffusion coefficient, ADC)及标准差(standard deviation, SD)。(2)病变经金标准(病理)证实。(3)设计良好的前瞻性或回顾性研究。(4)文献提供MR扫描仪场强为1.5 T及以上。由2名中级以上影像学医师独立检索和评价每篇文献。
文献排除标准:综述、讲座、病例报告、述评及重复发表的文献或学位论文。
1.3 异质性检验
利用q检验进行效应指标的异质性检验,检验各项研究之间的异质性水平分界线定为0.05。当异质性检验P>0.05时,可认为所有的研究来源于同一个效应总体,选用固定效应模型(fixed effects model)进行评价。当异质性检验P<0.05时,可认为各研究之间存在异质性,选用随机效应模型(random effects model)进行评价。效应指标使用平均ADC值的均数标准差(standardized mean difference, SMD)来表示。在分析每一个测量结果时,要同时考虑不同研究中混杂偏倚的影响。我们根据纳入文献的DWI扫描的b值范围将数据分为Ⅰ (0~400 s/mm2)、Ⅱ (500~700 s/mm2)、Ⅲ (800~1000s/mm2)三组,分别计算各组的平均ADC值的SMD。用MedCalc软件进行Meta分析,如果SMD (95%CI) (con fidence interval)不包括“0”,则P<0.05,可认为差异有统计学意义[1]。根据Cohen’s经验法则:如果SMD值是0.2,则影响因素具有较小的影响效应;如果是SMD值是0.5,则影响因素具有中等影响效应;如果SMD值是0.8或更大,则影响因素具有大的影响效应[1]。
2 结果
2.1文献检索结果
检索到相关文献37篇,其中27篇被剔除,纳入文献10篇[2-11],详见表1。根据纳入文献的DWI扫描的b值范围将数据分为三组,详见表2,3,4。

表1 纳入文献中的一般信息Tab. 1 The studies use as source of the general information in the literature
2.2 Meta分析
Meta分析结果详见表5。结果显示,三组异质性检验结果P值均<0.05,故三组都选用随机效应模型进行评价。当b值≤400 s/mm2时,SMD (95%CI)(95% confidence interval)包括“0”,良恶性软组织肿瘤的平均ADC值差异无统计学意义;当500 s/mm2≤b值≤700 s/mm2及800 s/mm2≤b值≤1000 s/mm2时,其SMD (95%CI)都不包括“0”,说明两组中良恶性病变的平均ADC值差异均有统计学意义;但当500 s/mm2≤b值≤700 s/mm2时其SMD值为1.50,大于800 s/mm2≤b值≤1000 s/mm2时的SMD值0.93。

表2 b值范围为(0~400 s/mm2)的平均ADC值及SDTab. 2 Summary statistics used as data from each study included in the meta-analysis of ADC and SD of the b-value range (0—400 s/mm2)

表3 b值范围为(500~700 s/mm2)的平均ADC值及SDTab. 3 Summary statistics used as data from each study included in the meta-analysis of ADC and SD of the b-value range (500—700 s/mm2)

表4 b值范围为(800~1000 s/mm2)的平均ADC值及SDTab. 4 Summary statistics used as data from each study included in the meta-analysis of ADC and SD of the b-value range (800—1000 s/mm2)
3 讨论
MR成像序列中的DWI序列反映机体的是在正常生理及病理状态下各组织及细胞间水分子的交换及功能状态,而ADC是定量参数,可以从微观水平反映组织的变化,因此在对许多疾病的诊断及鉴别中起到非常重要的作用,目前被广泛应用于肿瘤及淋巴结良恶性的鉴别[12-14]。在应用DWI来鉴别肌骨类肿瘤的良恶性研究中,由于b值选取不一,导致ADC值在鉴别软组织良恶性肿瘤的敏感性各有不同,有些研究认为b值≤400 s/mm2时,ADC值有助于鉴别肌骨类肿瘤良恶性[3],而有些研究则认为b值≤400 s/mm2时,ADC值不易鉴别肿瘤的良恶性[4],b值同样选取为1000 s/mm2亦出现相互矛盾的研究结果[4,8-10]。而Meta分析可以通过综合以往研究中所有可以利用的b值、ADC值与鉴别软组织良恶性肿瘤敏感性的数据,探索b值为何值时,ADC值在鉴别软组织良恶性肿瘤方面更有价值。
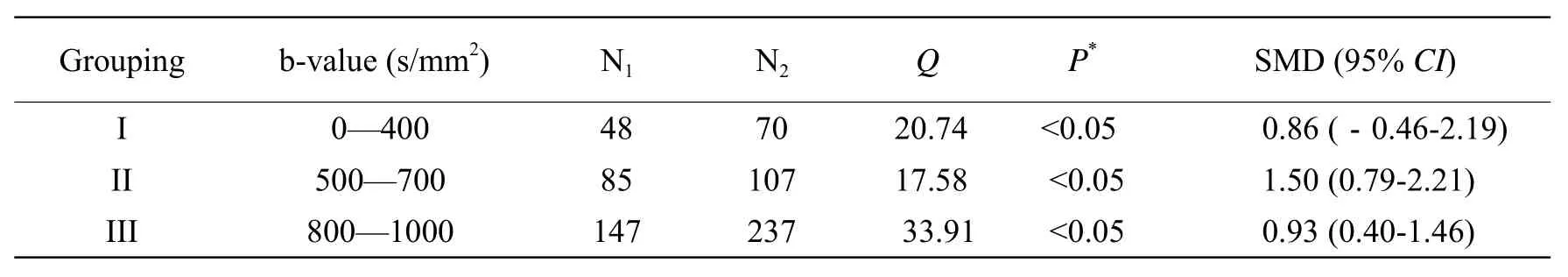
表5 纳入文献各组的Meta分析结果Tab. 5 The sample size for the benign (N1) and Malignant (N2)groups, the SMD and SMD (95% CI) calculated for each study
Meta分析结果显示,当b值≤400 s/mm2时,良恶性软组织肿瘤的平均ADC值无统计学意义,可能是当b值≤400 s/mm2时,对ADC值影响最大的是血流灌注[9,15],由于恶性肿瘤血供丰富,肿瘤组织此时处于高代谢状态,细胞内外乃至肿瘤内外的物质交换较正常组织快速而频繁[16-18];另外,由于肿瘤组织细胞外水分子比率增加,细胞内外水分子运动也增加,瘤组织水分子自由扩散较正常组织增加血流灌注越高,水分子运动越快,ADC值越大,使ADC值受T2透过效应和灌注效应影响很大,因此b值≤400 s/mm2时,良性和恶性肿瘤的ADC值有很大范围的重叠,不利于肿瘤良恶性的鉴别。
Meta分析结果显示,当500 s/mm2≤b值≤700 s/mm2及800 s/mm2≤b值≤1000 s/mm2时,良恶性病变间平均ADC值差异均有统计学意义,良性病变的ADC值明显高于恶性病变的ADC值,可能是当b≥500 s/mm2时,细胞外空间对ADC值影响最大,研究表明细胞外空间越大,水分子运动的障碍越小,则ADC值越大[19];且当b值≥500 s/mm2时,T2穿透效应的影响减小,ADC值主要是反映水分子扩散的快慢,所测得的ADC值受血流灌注影响较小,能很好反映组织水分子的扩散运动[20]。而恶性肿瘤生长活跃,肿瘤细胞异常增殖,细胞密度高,排列紧密,细胞外间隙减小,细胞外水分子扩散运动受限,导致其ADC值减低[21],因此良性与恶性肿瘤的ADC值有较明显的差异。
需要注意的是当500 s/mm2≤b值≤700 s/mm2时的SMD值明显大于800 s/mm2≤b值≤1000 s/mm2时的SMD值,依据Cohen’s经验法说明同b值为(800~1000)s/mm2相比,b值位于(500~700) s/mm2时,其ADC值更有利于良恶性软组织肿瘤的鉴别,这与随着b值的增高DWI图像信噪比较低,图像伪影增多有关。提示应用DWI鉴别良恶性软组织肿瘤时,应注意b值的选取,而500 s/mm2≤b值≤700 s/mm2时,ADC值在鉴别软组织良恶性肿瘤方面可能更有价值。
本研究对纳入的文献进行了严格的质量控制,包括纳入和排除文献的标准、质量评价。这些都说明本研究结果稳健性好,结论可信。但本研究也存在一定的局限性,由于受语种限制,只纳入了英文和中文文献,所以存在一定的语言偏倚,可能会影响研究结果的统计效力,因此需要更多的研究来论证。
[References]
[1] Michael K, James SB, Mark ES. Can diffusion-weighted imaging be used to differentiate benign from pathologic fractures? A meta-analysis. Skeletal Radiol, 2008(37):791-795.
[2] Wang SW, Zhang LN, Sun MY, et al. The comparative study of MR diffusion weighted imaging and MR perfusion-weighted imaging in diagnosing soft tissue tur flors. Chin J Radiol, 2009, 43(2): 136-140.王绍武, 张丽娜, 孙美玉,等. 软组织肿瘤MR扩散成像与灌注成像的比较研究. 中华放射学杂志, 2009, 43(2):136-140.
[3] Li YG. Functional MRI study of soft tissue tumors.Doctoral Dissertation of Tongji Hospital, Huazhong University of Science and Technology, 2006.李勇刚. 软组织肿瘤的功能磁共振成像研究. 华中科技大学同济医院博士学位论文, 2006.
[4] Qi HZ. Application study of 3T MR functional imaging in patient with musculoskeletal tumors. Shandong University doctoral Dissertation, 2006.齐滋华. 3 T磁共振功能成像对肌骨肿瘤的应用研究. 山东大学博士学位论文, 2006.
[5] Wang Q, Bao RX, Ye ZX. Evaluation of diffusionweighted imaging for the differential diagnosis of soft-tissue tumors. Chin J Clin Oncol, 2008, 35(23):1331-1334.王琦, 鲍润贤, 叶兆祥. 磁共振扩散加权成像鉴别良恶性软组织肿瘤的价值. 中国肿瘤临床, 2008, 35(23):1331-1334.
[6] Lin M, Luo DH, Ou YH, et al. Diffusion-weighted imaging at 3.0T MR in diagnosis of peripheral neurogenic tumor.Chin J Oncoradiol, 2009, 2(4): 138-142.林蒙, 罗德红, 欧阳汉, 等. 3.0T磁共振弥散加权成像周围神经源性肿瘤的诊断价值. 中国肿瘤影像学, 2009,2(4): 138-142.
[7] Shuji N, Hiroshi N, Masafumi U, et al. Diffusion-weighted imaging of soft tissue tumors: usefulness of the apparent diffusion coef ficient for differential diagnosis. Radiat Med,2008, 26(5): 287-295.
[8] Maeda M, Matsumine A, Kato H, et al.Soft-tissue tumors evaluated by line-scan diffusion-weighted imaging: influence of myxoid matrix on the apparent diffusion coef ficient. J Magn Reson Imaging, 2007, 25(6):1199-1204.
[9] Van RC, Kunz P, Hogendoorn PC, et al. Diffusionweighted MRI in the characterization of soft-tissue tumors.J Magn Reson Imaging. 2002, 15(3): 302-307.
[10] Kiyoshi O, Toshitake Y, Hiro S, et al. Usefulness of diffusion-weighted imaging for differentiating between desmoid tumors and malignant soft tissue tumors, J Magn Reson Imaging, 2011, 33(1): 189-193.
[11] Razek A, Nada N, Ghaniem M, et al. Assessment of soft tissue tumours of the extremities with diffusion echoplanar MR imaging. Radiol med, 2012, 117(1): 96-101.
[12] Yu XD, Lin M, Hu MC, et al. Diffusion-weighted MR imaging in assessment of primary adrenal tumors at 3.0 T.Chin J Magn Reson Imaging, 2010, 1(5): 366-370.余小多, 林蒙, 胡满仓, 等. 3.0 T磁共振扩散加权成像对肾上腺原发肿瘤的诊断价值. 磁共振成像, 2010, 1(5):366-370.
[13] Li Z, Xue HD, He YL, et al. Study of differentiation of benign and malignant lymph nodesbased on ADC value of MRI diffusion weighted imaging. Chin J Magn Reson Imaging, 2011, 2(5) : 349-352.李琢, 薛华丹, 何泳蓝, 等. 基于磁共振表观弥散系数分布的淋巴结良恶性鉴别方法研究. 磁共振成像, 2011,2(5): 349-352.
[14] Zhang Y, Wang XX, Huang YB, et al. Clinical value of whole-body magnetic resonance diffusion weighted imaging in the screening of malignant tumor. Chin J Magn Reson Imaging, 2011, 2(3): 205-209.张妍, 王晞星, 黄永波, 等. 磁共振全身弥散加权成像在恶性肿瘤筛查中的应用价值初探. 磁共振成像, 2011,2(3): 205-209.
[15] Le Bihan D. Molecular diffusion nuclear magnetic resonance imaging. J Magn Reson Imaging, 1991, 7(1):1-30.
[16] Jain RK. Barriers to drug delivery in solid tumors. Sci Am,1994, 271(1): 42-49.
[17] Jain RK. Transport of molecules in the tumour interstitium:a review. Cancer Research, 1987, 47(12): 3039-3051.
[18] Jain RK. Determinants of tumour blood flow: a review.Cancer Research, 1988, 48(10): 2641-2658.
[19] Jia FG, Zhang LN, Wang SW, et al. Preliminary quantitative research of MR diffusion weighted imaging in soft tissue tumors. J Chin Clin Med Imaging, 2006, 17(5):272-274.贾飞鸽, 张丽娜, 王绍武. 软组织肿瘤MR弥散加权成像量化研究初探(前瞻性). 中国临床医学影像杂, 2006,17(5): 272-274.
[20] Chne S, kIawa F, Kurisu K, et al. Quantitative MR evaluation of intracranial epidermoid tumors by fast fluidattenuated inversion recovery imaging and eho-Planar diffusion-weighted imaging. AJNR Am J Neuroradiol,2001, 22(6): 1089-1096.
[21] Baur A, Dietrich O, Reiser M, et al. Diffusion - weighted imaging of bone marrow: current status. Eur Radiol, 2003,13(7): 1699-1708.

