胰腺癌相关糖尿病的血清蛋白质组学分析
吴健婷 田字彬 丁雪丽 荆雪 江月萍 魏良洲 孔心涓 张翠萍 赵清喜
·论著·
胰腺癌相关糖尿病的血清蛋白质组学分析
吴健婷 田字彬 丁雪丽 荆雪 江月萍 魏良洲 孔心涓 张翠萍 赵清喜
目的检测胰腺癌相关糖尿病的血清蛋白标志物,并建立诊断模型。方法应用表面增强激光解析电离飞行时间质谱(SELDI-TOF-MS)技术检测17例胰腺癌相关糖尿病与17例新发2型糖尿病、17例健康对照者血清的差异表达蛋白,用Biomarker Patterns Software 5.0软件建立胰腺癌相关糖尿病诊断模型并验证。结果在胰腺癌相关糖尿病、新发2型糖尿病、健康者各10例的蛋白指纹图谱中筛选出12个差异表达蛋白峰,其中质荷比为6116、6695、8936 Da的蛋白峰被选为建立胰腺癌相关糖尿病诊断模型的蛋白峰。该诊断模型的诊断正确率为90%。盲法验证各组另7例样本,正确诊断胰腺癌相关糖尿病患者达100%,新发2型糖尿病患者为71%,健康人群为86%。经检索蛋白质数据库,与以上3种差异表达蛋白分子质量最为接近的蛋白分别为金属硫蛋白、胰腺干细胞增殖分化因子和成纤维细胞生长因子1。结论通过SELDI方法筛选出3种胰腺癌相关糖尿病的血清蛋白标志物,建立了可靠的胰腺癌相关糖尿病的诊断模型。
糖尿病; 胰腺肿瘤; 蛋白质组学; 表面增强激光解析电离飞行时间质谱技术
有学者[1-3]认为,新发糖尿病(病程≤2年)是胰腺癌的早期临床表现,可将新发糖尿病患者作为筛查胰腺癌的高危人群。但新发糖尿病中,多数为新发的2型糖尿病,只有较少部分由胰腺癌引起,称为胰腺癌相关糖尿病。若在新发糖尿病患者中筛查出胰腺癌相关糖尿病,则有可能实现胰腺癌的早期诊断。本研究比较胰腺癌相关糖尿病患者与相应对照患者的血清蛋白质谱差异,筛选胰腺癌相关糖尿病的血清蛋白标志物,以期为胰腺癌相关糖尿病的鉴别诊断和发病机制的探讨提供依据。
材料与方法
一、临床资料
2011年5月至2011年12月间采集青岛大学医学院附属医院收治的17例胰腺癌相关糖尿病、17例不合并糖尿病的胰腺癌、5例胰腺癌合并长期糖尿病、17例新发2型糖尿病患者及17例在体检中心体检的健康者全血标本5 ml,立即放入4℃冰箱静置3 h,4℃离心取血清,按每管50 μl分装后置-80℃冰箱保存。胰腺癌相关糖尿病组与其他各组患者的年龄、性别相匹配。胰腺癌诊断均经病理检查证实。糖尿病诊断标准参见1997年美国糖尿病协会推荐的标准[4]。胰腺癌相关糖尿病:胰腺癌合并病程≤2年的糖尿病。新发2型糖尿病:病程≤2年的2型糖尿病,且除外胰腺癌可能。长期糖尿病:病程>5年的2型糖尿病,且除外胰腺癌可能。
二、血清蛋白指纹图谱检测
采用表面增强激光解析电离飞行时间质谱(SELDI-TOF-MS)技术检测。具体操作:将血清冰浴融化后置4℃ 10 000 r/min离心2 min,取血清10 μl,加入20 μl U9缓冲液(9 mol/L尿素、20 g/L CHAPS、10 g/L DTT、50 mmol/L Tris-HCL,pH9.0),充分混匀振荡30 min,加入50 mmol/L NaAc(pH4.0)370 μl,混匀。取50 g/L的弱阳离子WCX型纳米磁珠(北京赛尔迪生物技术有限公司)50 μl,加入PCR管中,加入100 μl NaAc混匀、活化5 min后于磁性分离板上放置2 min,弃上清液,重复上述操作1次。
每份弃上清液活化的磁珠中加入100 μl处理好的血清样本,充分振荡混匀,室温孵育30 min,磁性分离板上放置1 min,弃上清液。用100 μl NaAc洗脱2次,每次5 min,加入10 μl TFA洗脱结合在磁珠上的血清蛋白。5 min后取5 μl蛋白洗脱液,加入5 μl SPA,充分混匀后吸取2 μl混合液点样于金芯片(Au Chip),自然晾干。
应用PBSⅡ-C蛋白质芯片时间飞行质谱仪(美国Ciphergen公司)检测血清蛋白。设定最高检测分子质量为50 000,优化范围为1500~20 000,激光强度为260,检测敏感度为8。滤去分子质量10 000以下的峰,以免基质峰对结果造成干扰。检测前用All-in-one多肽标准芯片校正仪器,系统质量偏差≤0.1%。
三、胰腺癌相关糖尿病诊断模型建立
采用Biomarker Patterns Software5.0识别诊断胰腺癌相关性糖尿病的最佳标志物,建立胰腺癌相关糖尿病诊断模型。对建立诊断模型的差异蛋白峰进行蛋白质数据库检索(http://us.expasy.org/tools/tagident.html),以寻找与其分子质量最为接近的蛋白质。
四、统计学处理
采用Ciphergen proteinchip3.1分析软件自动采集数据,不同组之间蛋白峰峰值的差异采用Biomarker Wizard行t检验。P<0.05为差异具有统计学意义。
结 果
一、胰腺癌相关糖尿病组与其他各组的蛋白指纹图谱的比较
胰腺癌相关糖尿病组与胰腺癌合并长期糖尿病组、胰腺癌不合并糖尿病组、新发2型糖尿病组、健康对照组的血清蛋白质指纹图谱见图1。胰腺癌相关糖尿病组的质荷比为8455 Da的蛋白峰表达显著高于其他各组(P<0.05)。
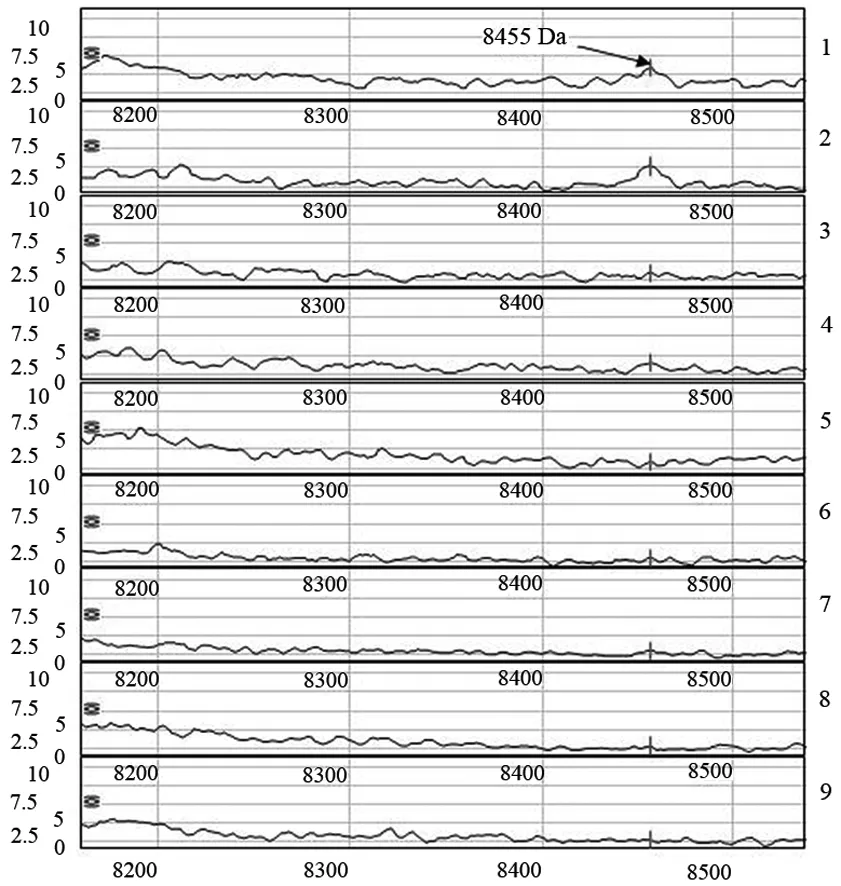
1、2:胰腺癌相关糖尿病;3、4:胰腺癌不合并糖尿病;5:胰腺癌合并长期糖尿病;6、7:新发糖尿病;8、9:健康对照
图1胰腺癌相关糖尿病组与其他各组的蛋白指纹图谱
二、胰腺癌相关糖尿病组与新发2型糖尿病组、健康对照组的比较
按数字表法在胰腺癌相关糖尿病组、新发2型糖尿病组、健康对照组中各选取10例组成建模组,发现12个蛋白峰峰值的差异具有统计学意义(P<0.05,表1),其中质荷比为6116、6695、8936 Da的蛋白峰被选为建立胰腺癌相关糖尿病诊断模型的蛋白峰。各组质荷比为6116 Da的蛋白峰见图2。
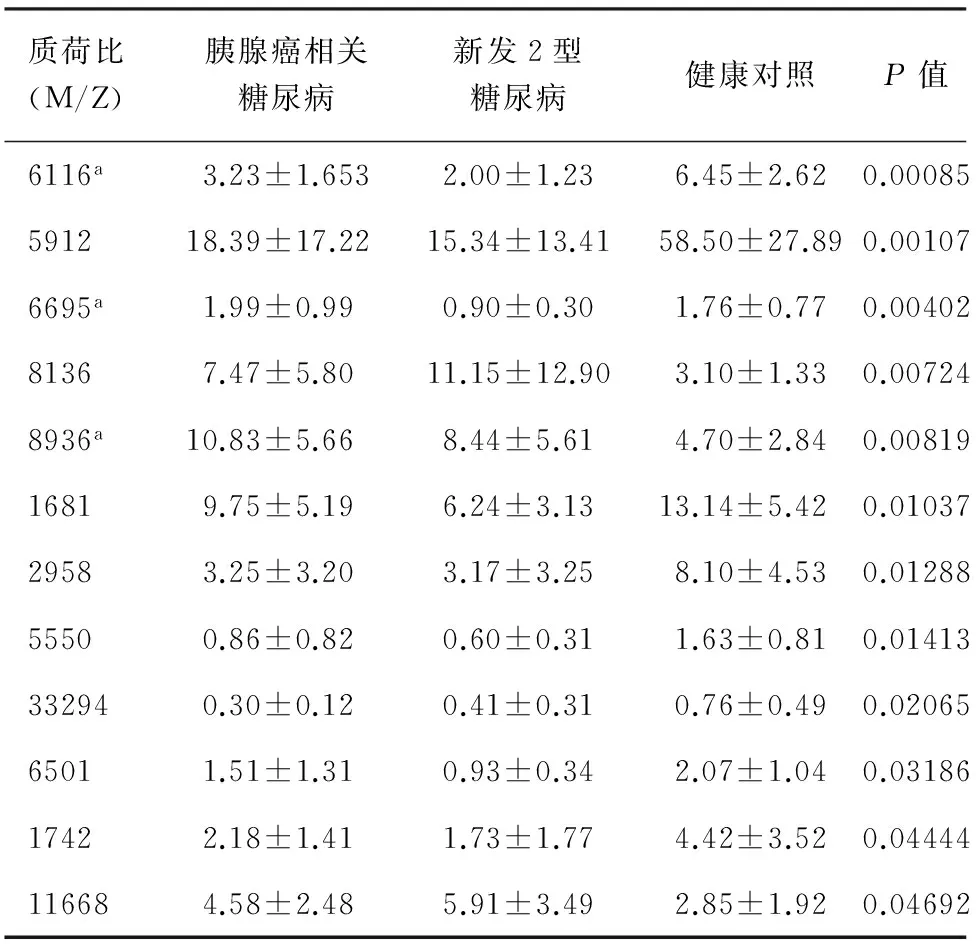
质荷比(M/Z)胰腺癌相关糖尿病新发2型糖尿病健康对照P值6116a3.23±1.6532.00±1.236.45±2.620.00085591218.39±17.2215.34±13.4158.50±27.890.001076695a1.99±0.990.90±0.301.76±0.770.0040281367.47±5.8011.15±12.903.10±1.330.007248936a10.83±5.668.44±5.614.70±2.840.0081916819.75±5.196.24±3.1313.14±5.420.0103729583.25±3.203.17±3.258.10±4.530.0128855500.86±0.820.60±0.311.63±0.810.01413332940.30±0.120.41±0.310.76±0.490.0206565011.51±1.310.93±0.342.07±1.040.0318617422.18±1.411.73±1.774.42±3.520.04444116684.58±2.485.91±3.492.85±1.920.04692
注:a被选为建立胰腺癌相关糖尿病诊断模型的蛋白峰
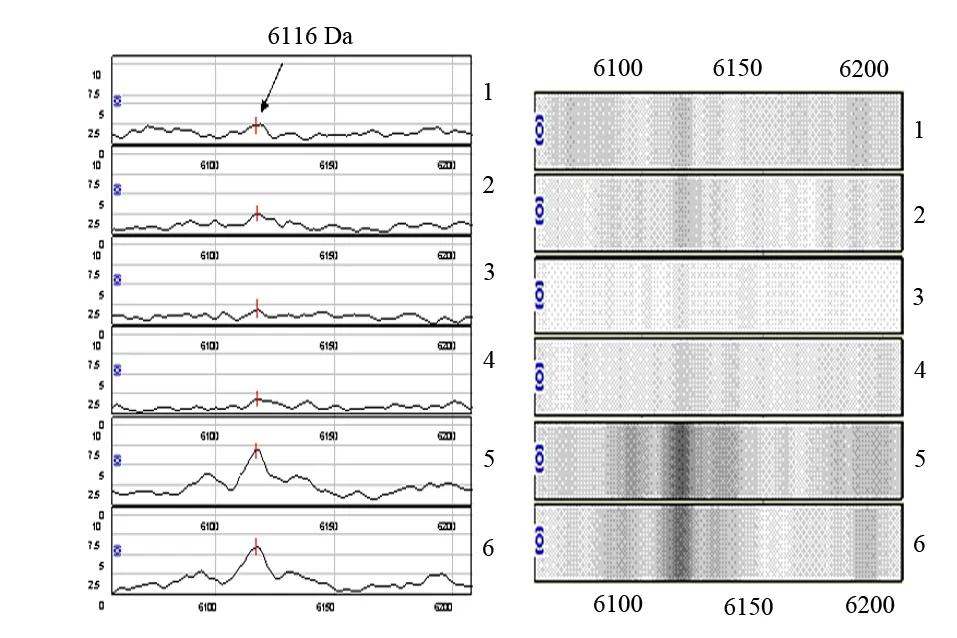
1、2:胰腺癌相关糖尿病;3、4:新发2型糖尿病;5、6:健康对照
三、胰腺癌相关糖尿病诊断模型流程
以6116 Da蛋白为节点 1,将30例中峰值>5.94的7例划分到终节点4中,为健康人群;峰值≤5.94的23例样本再以6695 Da蛋白为节点2继续划分,峰值≤1.24的11例划分到终节点1中,诊断为新发2型糖尿病;峰值>1.24的12例以8936 Da蛋白为节点3继续划分,峰值≤3.52的2例划分到终节点2中,为健康人群,峰值>3.52的10例划分到终节点3中,诊断为胰腺癌相关糖尿病(图3)。其诊断ROC曲线见图4。
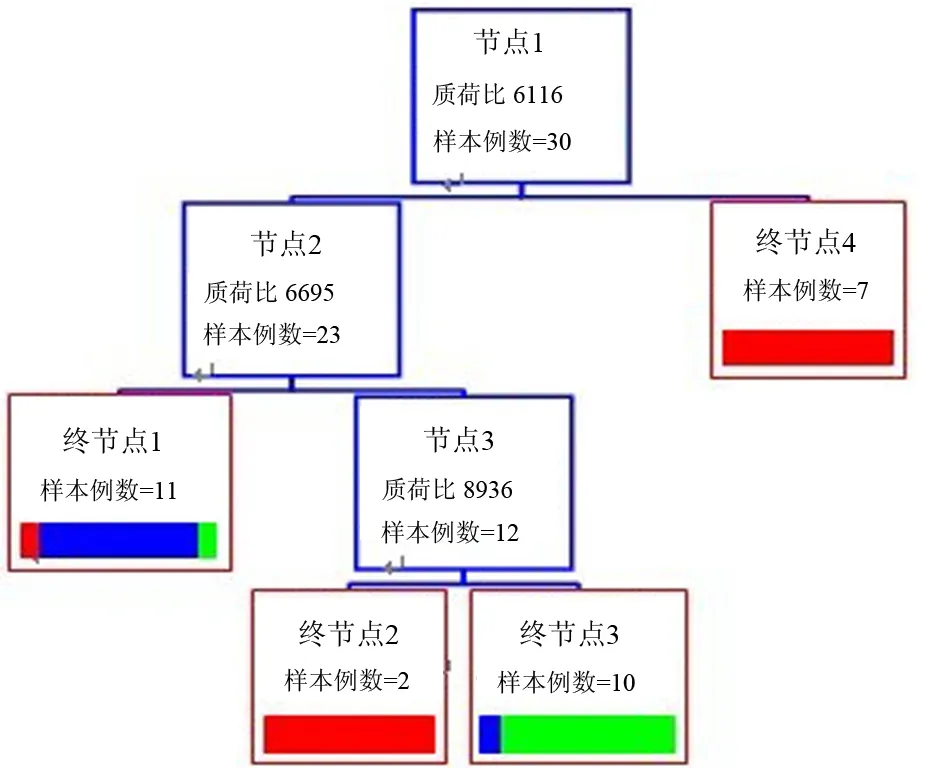
红色条为健康对照,蓝色条为新发糖尿病,绿色条为胰腺癌相关糖尿病
图3胰腺癌相关糖尿病诊断模型图

图4 胰腺癌相关糖尿病诊断模型ROC曲线
四、诊断模型的盲法验证
采用已建立的诊断模型对建模组30例及另21例蛋白指纹图谱进行盲法验证,结果显示建模组30例的诊断正确率均达90%,另21例中胰腺癌相关糖尿病诊断率为100%,新发糖尿病诊断准确率为71%,健康人群为86%(表2)。
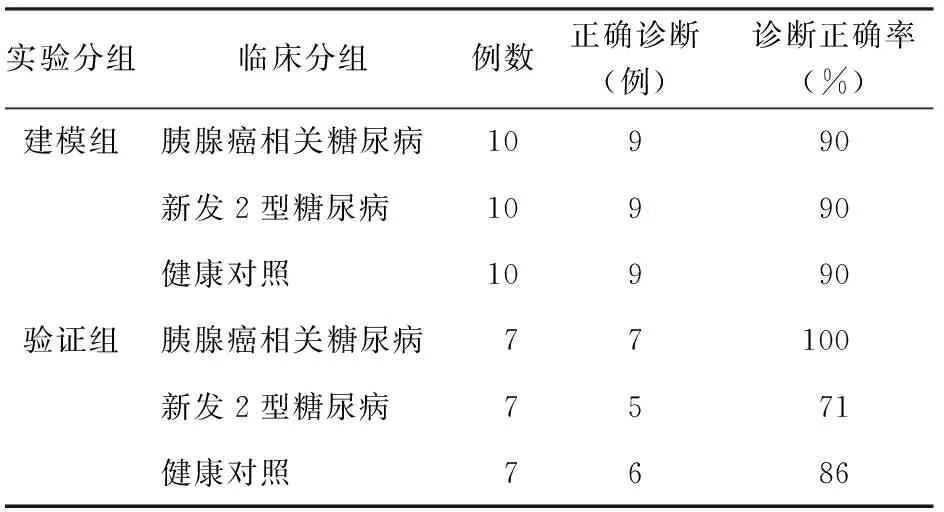
表2 诊断模型的盲法验证结果
五、蛋白质数据库查询
对建立胰腺癌相关糖尿病诊断模型的3个差异蛋白峰分别进行数据库检索,6116 Da蛋白与金属硫蛋白(6115 Da)的分子质量最为接近,8936 Da蛋白与胰腺干细胞增殖分化因子(8933 Da)的分子质量最为接近,6695 Da蛋白与成纤维细胞生长因子1(FGF1,6698 Da)的分子质量最为接近。
讨 论
胰腺癌的早期诊断一直是临床工作中亟待解决的问题,目前常用的胰腺癌血清学标志物因其灵敏性和特异性欠佳,不能满足早期诊断胰腺癌的需要。近年来,以新发糖尿病为胰腺癌高危人群,从中筛查胰腺癌相关糖尿病为胰腺癌的早期诊断提供了新的思路。目前关于胰腺癌相关糖尿病发病机制主要是胰腺癌释放的可溶性介质干预胰岛β细胞功能,影响肝脏、肌肉的糖代谢过程,引起胰岛素抵抗,最终导致胰腺癌相关糖尿病的发生[5]。对于可溶性介质的研究主要集中在体外细胞培养、组织标本检测、基因组学研究等方面。
近年来,蛋白质组学得到迅速发展。SELDI是蛋白质组学技术之一,在肿瘤标志物的探索方面得到广泛应用。本研究发现,在胰腺癌相关糖尿病组与新发2型糖尿病组、健康对照组间有12个蛋白峰峰值存在统计学差异,其中6116、8936和6695 Da的蛋白峰为诊断胰腺癌相关糖尿病的最佳标志物。以此为依据建立的诊断模型诊断正确率为90%。盲法验证显示,该模型可正确划分100%的胰腺癌相关糖尿病患者、71%的新发糖尿病患者和86%的健康人群。本研究还显示,质荷比为8455 Da的蛋白峰在胰腺癌相关糖尿病组与其他组的差异亦具有统计学意义,但在建模组间未发现显著差异,其原因有待进一步扩充样本量后验证。
6116 Da蛋白峰与金属硫蛋白分子质量最为接近。研究发现,金属硫蛋白具有清除自由基、减轻高血糖及脂肪酸的细胞毒性、改善胰岛素抵抗从而延缓糖尿病发生的作用[6]。8936 Da蛋白峰与胰腺干细胞增殖分化因子与的分子质量最为接近。6695 Da蛋白与FGF1蛋白的分子质量最为接近,FGF1可改善胰岛β细胞功能,促进胰岛素分泌,促进脂肪合成[7]。本实验显示,胰腺癌相关糖尿病患者血清6116 Da、6695 Da蛋白表达下调,8936 Da蛋白表达上调,它们参与胰腺癌相关糖尿病的发病机制尚待进一步研究。
由于本实验采用SELDI技术,它所得到的每一个波峰值对应的可能是多个分子质量相近的蛋白质或多肽,因此,并不能对目标蛋白做直接鉴定,依据其分子质量在蛋白质数据库检索所得结果只是一种可能性猜测,因此对所筛选到的差异表达蛋白尚需进一步明确。
[1] Pannala R, Basu A, Petersen GM, et al. New-onset diabetes:a potential clue to the early diagnosis of pancreatic cancer. Lancet Oncol,2009,10:88-95.
[2] Ben Q, Cai Q, Li Z, et al.The relationship between new-onset diabetes mellitus and pancreatic cancer risk:a case-control study. Eur J Cancer,2011,47:248-254.
[3] Chari ST, Leibon CL,Rabe KG,et al.Pancreatic cancer-associated diabetes mellitus: prevalence and temporal association with diagnosis of cancer. Gastroenterology,2008,134:95-101.
[4] Report of the Expert Committee on the Diagnosis and Classification of Diabetes Mellitus.Diabetes care,1997,20:1183-1197.
[5] Chari ST,Zapiach M,Yadav D,et al.Beta-cell function and insulin resistance evaluated by HOMA in pancreatic cancer subjects with varying degrees of glucose intolerance.Pancreatology,2005,5:229-233.
[6] Park L, Min D, Kim H,et al.Tat-enhanced delivery of metallothionein can partially prevent the development of diabetes.Free Radic Biol Med,2011,51:1666-1674.
[7] Hart AW, Baeza N, Apelqvist A,et al.Attenuation of FGF signaling in mouse β-cells leads to diabetes.Nature,2000,408:864-868.
Serumproteomicanalysisofpancreaticcancerassociateddiabetes
WUJian-ting,TIANZi-bin,DINGXue-li,JINGXue,JIANGYue-ping,WEILiang-zhou,KONGXin-juan,ZHANGCui-ping,ZHAOQing-xi.
DepartmentofGastroenterology,AffiliatedHospitalofQingdaoUniversityMedicalCollege,Qingdao266003,China
TIANZi-bin,Email:tianzb@qdumh.qd.sd.cn
ObjectiveTo detect serum biomarkers for pancreatic cancer associated diabetes and establish a model for diagnosis.MethodsSELDI-TOF-MS was used to detect the differentially expressed serum proteins from 17 pancreatic cancer associated diabetes patients, 17 new-onset type Ⅱ diabetes patients and 17 healthy controls, then a model of biomarkers was constructed and validated by Biomarker Patterns Software 5.0.ResultsTwelve discriminating m/z peaks were identified in the protein fingerprints in 10 pancreatic cancer associated diabetes patients, 10 new-onset type Ⅱ diabetes patients and 10 healthy controls. Among them, the three biomarkers of mass/charge ratio 6116, 6695 and 8936 were used to construct the model, which could diagnose 90% pancreatic cancer associated diabetes form control groups. Blind test of other 7 samples of three groups showed that 100% pancreatic cancer associated diabetes, 71% new-onset diabetes and 86% healthy controls were correctly classified. After searching protein database, there were metallothionein, pancreatic progenitor cell differentiation and proliferation factor-like protein, and fibroblastic growth factor 1, which were close to the weights of the above mentioned 3 differentially expressed proteins.ConclusionsSELDI can identify 3 biomarkers for pancreatic cancer associated diabetes and a reliable model for diagnosis of pancreatic cancer associated diabetes is established.
Diabetes mellitus; Pancreatic neoplasms; Proteomics; SELDI-TOF-MS
10.3760/cma.j.issn.1674-1935.2012.05.005
266003 青岛,青岛大学医学院附属医院消化内科
田字彬,Email:tianzb@qdumh.qd.sd.cn
2012-05-23)
(本文编辑:吕芳萍)

