大黄素在人肝肠微粒体的葡萄糖醛酸化反应
刘 薇, 王一飞△, 刘中秋
(1广州暨南生物医药研究开发基地有限公司,广州 广东 510632; 2南方医科大学药学院药剂系,广州 广东 510515)
1000-4718(2012)09-1681-05
2012-04-10
2012-07-11
△通讯作者 Tel: 020-85220908 ; E-mail: twangyf@jnu.edu.cn
大黄素在人肝肠微粒体的葡萄糖醛酸化反应
刘 薇1, 王一飞1△, 刘中秋2
(1广州暨南生物医药研究开发基地有限公司,广州 广东 510632;2南方医科大学药学院药剂系,广州 广东 510515)
目的研究体外人肝肠微粒体孵育体系中大黄素的葡萄糖醛酸化代谢情况,并找出参与大黄素葡萄糖醛酸化代谢的人尿苷二磷酸葡萄糖醛酸转移酶(UGT)亚型。方法用超高效液相色谱法(UPLC),检测大黄素的葡萄糖醛酸化代谢情况,将代谢产物进行纯化后,用质谱(MS)和核磁共振(NMR)法进一步鉴定其结构。用人的重组化表达的UGT单酶,鉴定可能参与大黄素葡萄糖醛酸化代谢反应的UGT亚型。结果大黄素葡萄糖醛酸代谢仅产生大黄素- 氧- 单葡萄糖醛酸这一个代谢产物。大黄素在人的肝、肠微粒体中的代谢属经典的米氏方程动力学行为,除 UGT1A4和UGT2B17外,其它10种UGT亚型均参与了大黄素的葡萄糖醛酸化反应。结论大黄素在人肝肠微粒体孵育体系中会被代谢成为一个单葡萄糖醛酸化产物。大黄素的主要代谢部位是肠道。
大黄素; 葡萄糖醛酸化反应; 微粒体
大黄为蓼科多年生草本植物掌叶大黄、唐古特大黄或药用大黄的干燥根及根茎,味苦性寒,具有泻热通肠、凉血解毒、逐瘀通经的功用[1]。蒽醌类衍生物是大黄中主要的活性成分,主要有大黄素(emodin)、大黄酸(rhein)等,其中以大黄素的含量最高[2]。大黄及其含有蒽醌类成分的其它中药如决明子、何首乌和芦荟等也因其泻下作用而被广泛应用于具有减肥功能和清毒解热的保健食品中[3-4]。我们研究发现,口服大黄素后血浆中的血药浓度极低,而被葡萄糖醛酸转移酶所代谢的大黄素葡萄糖醛酸苷的血药浓度很高,Cmax是大黄素的30倍;静注时大黄素亦可转化为葡萄糖醛酸化产物[5]。 尿苷二磷酸葡萄糖醛酸转移酶(UDP-glucuronosyltransferases, UGTs)是药物在机体中发生II相代谢反应时最重要的代谢酶[6],将体内的葡萄糖醛酸与许多具有药理活性的化合物发生结合反应。多酚类化合物或结构中有醇、硫醇、胺等基团的药物能较易被UGT酶所代谢[7]。蒽醌类化合物大黄素是典型的多酚类化合物。葡萄糖醛酸化反应在蒽醌类化合物的代谢过程中发挥着重要的作用[8]。且大黄素的葡萄糖醛酸化产物的活性有可能比原型化合物更强,也有可能截然不同。考察大黄素在体外人肝、肠微粒体孵育体系中葡萄糖醛酸化代谢反应以及大黄素在人不同的UGT亚型中的代谢情况,为进一步理解大黄素在人体中的代谢行为以及大黄素的药效学基础提供实验基础和理论支持。
材 料 和 方 法
1药品、试剂与仪器
大黄素对照品(纯度>98%)、尿苷二磷酸葡萄糖醛酸(uridine 5’-diphospho-glucuronic acid,UDPGA)、丙甲菌素, D-葡萄糖二酸-1,4-内酯等均购于Sigma; 人肝微粒体、人肠微粒体和12种人源重组UGTs(UGT1A1、UGT1A3、 UGT1A4、 UGT1A6、 UGT1A7、 UGT1A8、UGT1A9、UGT1A10、UGT2B4、UGT2B7、UGT2B15和UGT2B17)均购于BD Gentest。乙腈, 色谱纯; MgCl2、NaCl、磷酸二氢钠、磷酸氢二钠、二甲基亚砜、醋酸铵以及其它试剂, 均为AR 级, 广州化学试剂厂生产。超高效液相色谱-质谱联用仪,Waters产品; 恒温水浴箱, MS3 digital涡旋仪, IKA产品; 5424离心机, Eppendorf产品; NI-2RC 涡旋仪, 美国热电仪器公司产品; 纯水蒸馏器, Milipore产品。
2主要方法
2.1各种溶液的制备 (1)大黄素贮备液:精密称取大黄素1.35 mg,以50%甲醇和50%乙醇的混合溶液配成1.35 g/L,即5 mmol/L的贮备液。实验时, 用磷酸缓冲液稀释成各种浓度。(2)溶液A(solution A):二磷酸尿苷葡萄糖醛酸25 mmol/L即807.75 mg溶于50 mL双蒸水中,混匀至完全溶解。每管分装1 mL,标记好,放置4 ℃冰箱备用。(3)溶液B(solution B):MgCl219.042 mg溶于40mL 双蒸水中,至溶解;5 mg丙甲菌素溶于100 μL甲醇中,全部移至40 mL MgCl2中,超声10~20 min。210 mg D-葡萄糖二酸1,4-内酯溶于40.1 mL的混合溶液中,涡旋至溶解即可。每管分装1 mL,标记好,放置4 ℃冰箱备用。(4)KPI溶液(磷酸缓冲溶液):取磷酸氢二钠68.9 g和磷酸二氢钠78.9 g, 加蒸馏水至1 000 mL, 用NaOH 调pH为7.2。
2.2大黄素葡萄糖醛酸化反应(微粒体酶反应) 从-20 ℃冰箱取出溶液A、溶液B、微粒体(或UGT酶)和磷酸缓冲液放置37 ℃水浴上解冻,大黄素贮备液用磷酸缓冲液稀释至4 mmol/L、3 mmol/L、2 mmol/L、1.5 mmol/L、1 mmol/L、0.75 mmol/L、0.5 mmol/L、0.25 mmol/L、0.125 mmol/L等从高到低9个浓度。向EP管中分别依次加入磷酸缓冲液421.2 μL、溶液B、微粒体或UGT酶、不同浓度的药物和溶液A,关上盖子,用力涡旋30 s,再将每个管中的混合溶液分装成另外3个管,每管200 μL,迅速放入37 ℃水浴锅孵育10 min,取出,重新放置冰浴上,往每管加入100 μL含睾丸酮(50 μmol/L)的乙腈溶液,终止反应。13 000 r/ min 离心 15 min,取上清液10 μL进样UPLC。
2.3分析条件 色谱条件:色谱柱:BEH C18,1.7 μm, 2.1×50 mm。流动相:乙腈(B)与2.5 mmol/L醋酸铵水溶液,pH 7.4 (A);梯度洗脱:0 ~ 0.1 min, 85%A,0.1~1.8 min,85%~60%A,1.8 ~ 2.2 min,60%~40%A,2.2~2.8 min,40%~85%A,2.8~3.2 min,85%A;流速:0.4 mL/min。检测波长:254 nm;进样体积10 μL。色谱系统:Waters ACQUITY UPLC with Photodiode Array Detector and Empower software。质谱条件:离子源为电喷雾离子源(electrospray ionization, ESI),采用负离子检测方式,毛细管电压4.5 kV,离子源温度350 ℃,离子源喷射电压4.5 kV,去溶剂温度 108 ℃,雾化气流(气流1)为氮气,40 psi,离子源气流(气流2)为氩气,20 psi。采用一级全扫描质谱及选择离子全扫描二级质谱(full scan MS2)两种方式同时测定。核磁条件:Bruker 400 MHz。
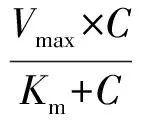
3统计学处理
结 果
1UPLC法鉴别大黄素及其二相代谢结合物
大黄素在人的肝、肠微粒体以及UGT酶的孵育体系下反应后,均产生了同一个新的化合物,在1.92 min时出现了一个新的峰,见图1A,大黄素和内标液的保留时间分别为2.77 min和2.42 min。利用紫外检测器对此峰进行PDA扫描,可见此物质有2个最大吸收波长,分别是225.2 nm和262.9 nm。与原形药物的紫外PDA图谱相对比,大黄素有3个吸收波长:230.5 nm、253.5 nm和291.3 nm。两者的吸收波长相似,可以初步判定,这个新的产物是大黄素的衍生物,见图1B。
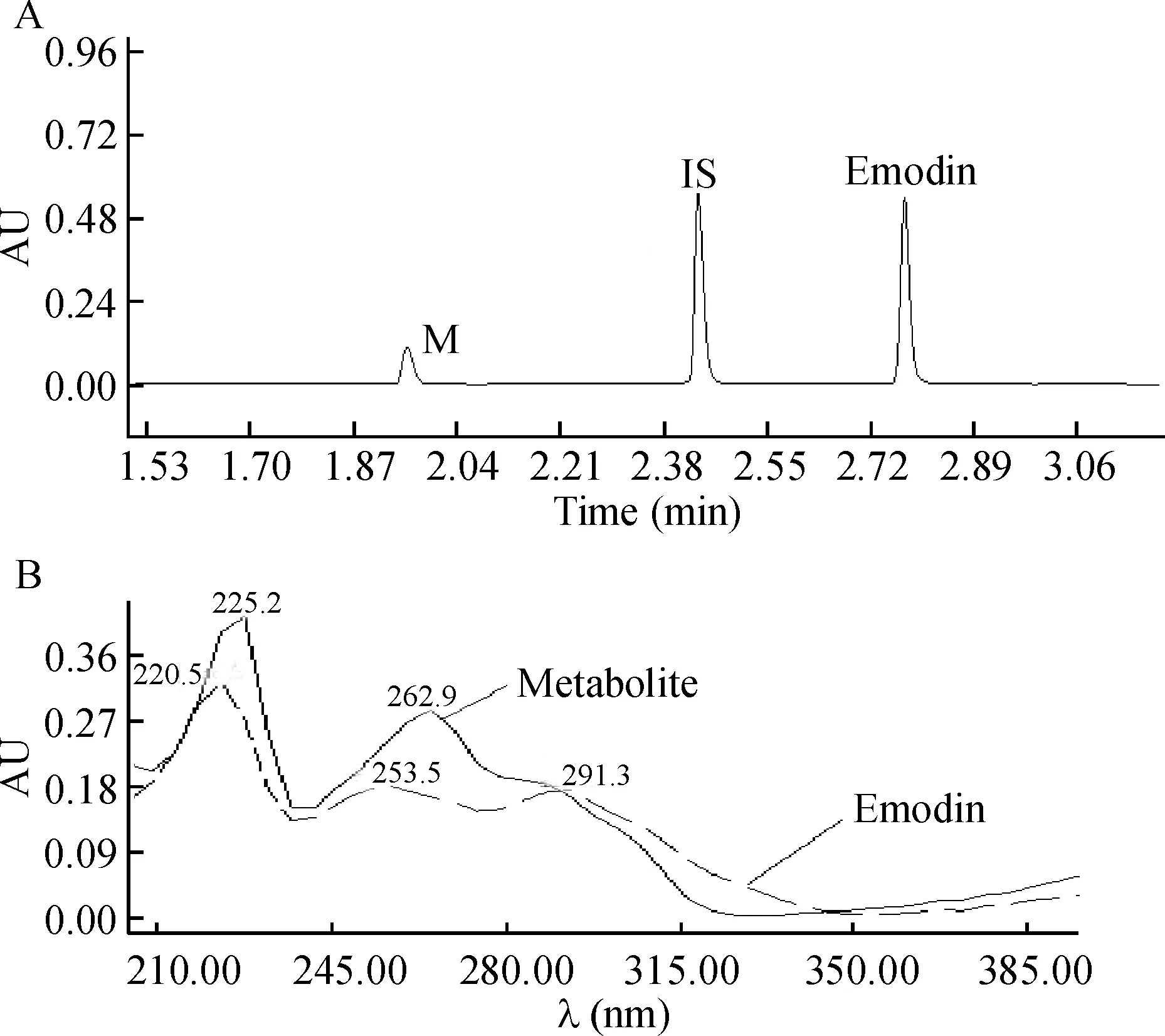
Figure 1. UPLC chromatogram (A) and UV spectrum (B) of emodin and its metabolite after incubated with various microsomes. M: metabolite; IS: internal standard.
图1经微粒体孵育后大黄素及其代谢产物的UPLC色谱图和紫外图谱
2LC/MS/MS鉴别大黄素的二相代谢结合物
大黄素经人肝、肠微粒体以及UGTs酶孵育后,其代谢产物的质谱分析见图2,此物质的质谱图显示样品产生的分子离子质荷比m/z为445.0780,计算推导所得的分子式为C21H17O11分子量445.0776),与大黄素的分子量与葡萄糖醛酸分子量之和相吻合,可推断为(大黄素-葡萄糖醛酸结合物-H)-,另一主要的分子离子峰在质荷比269.0462,可推断为(大黄素葡萄糖醛酸结合物-葡萄糖醛酸)-,与大黄素分子量-H相吻合。
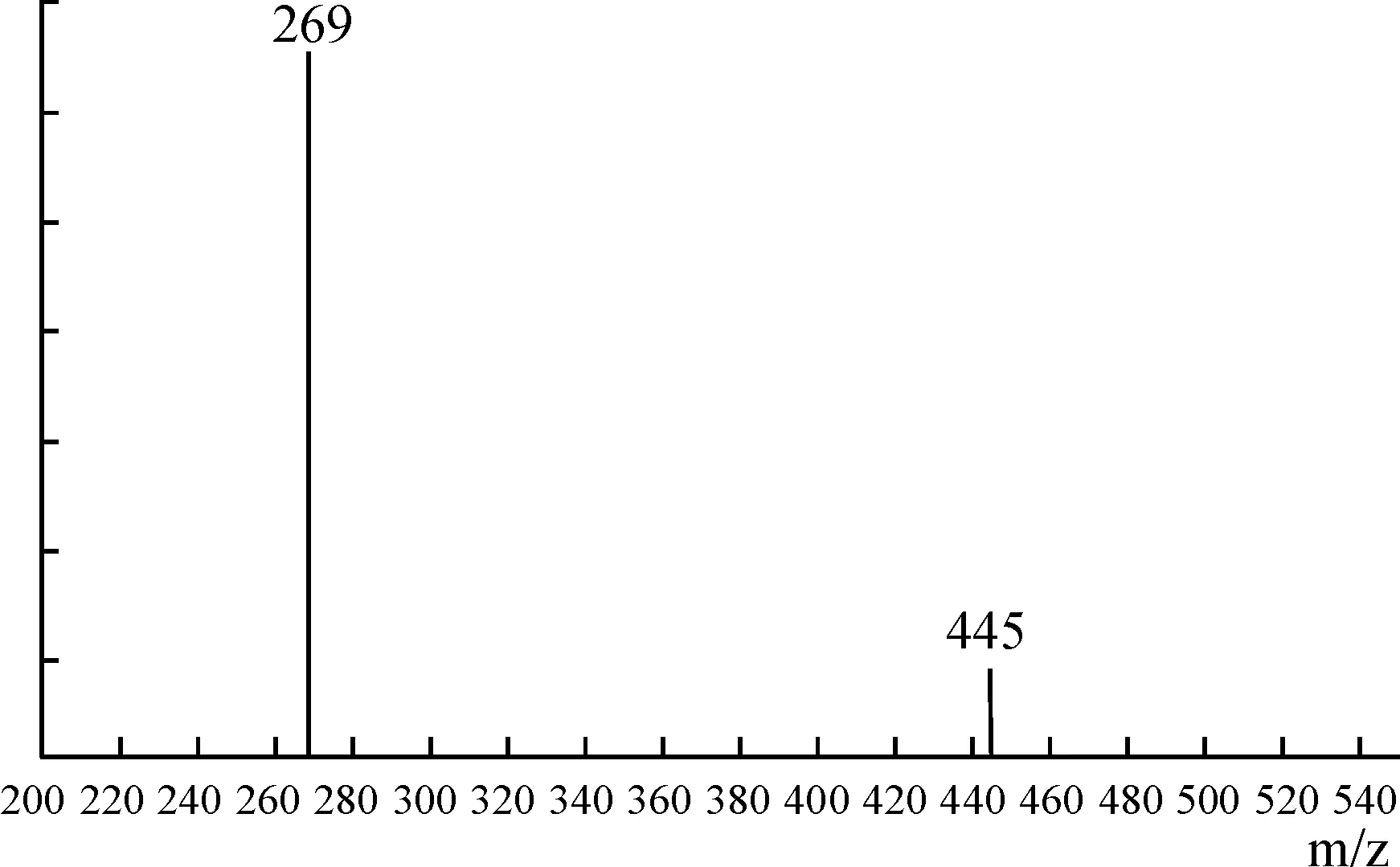
Figure 2. Mass spectrum of emodin glucuronide.
图2大黄素二相代谢产物(大黄素葡萄糖醛酸结合物)质谱图
31H-NMR法确定大黄素葡萄糖醛酸结合物结构式
大黄素与其葡萄糖醛酸结合物的一维核磁共振氢谱(1H-NMR)图表明,两者氢谱上的信号十分相似,但后者发现了糖基的化学位移值(δ)变化,如H-1’ 上δ5.14 (1H, d,J=8 Hz) 和 H-5’ 上的δ4.21 (1H, d,J=8 Hz),可以判定葡萄糖醛酸上的这两个H的位置与大黄素结合位置有关。从大黄素的葡萄糖醛酸结合物的二维ROSEY(见图3)氢谱中可以看出,在化学位移值H-4 (δ7.45) 和H-2 (δ6.96) 都与糖基上的H1’ (δ5.14) 有关,可以确定,葡萄糖醛酸结合在大黄素的3位羟基上(3-OH)。因此大黄素经UGTs代谢途径得到的II相代谢产物为大黄素-3-O-葡萄糖醛酸(emodin 3-O-β-D-glucuronide),见图3B。
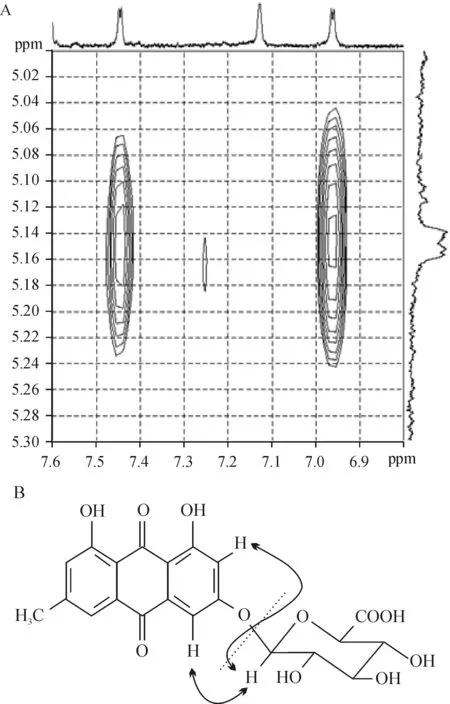
Figure 3. NOESY spectrum (A) and structure formula (B) of emodin glucuronide. The nuclear Overhauser effect (NOE) was related to anomeric proton, H-2 and H-4.
图3大黄素葡萄糖醛酸结合物的二维NOESY氢谱图和结构式
4大黄素在人的肝、肠微粒体中代谢的酶动力学考察
我们考察并计算了大黄素在人的肝、肠微粒体的酶动力学参数,并绘制出Eadie-Hofstee 图以确定药物代谢的种类。大黄素与葡萄糖醛酸结合的结合速率与大黄素浓度的酶促动力学曲线见图4,结果显示大黄素的代谢在其高浓度的时候呈现饱和现象,Eadie-Hofstee图见图4中的插图,从图上可以看出大黄素无论在人肝微粒体还是肠微粒体中的代谢符合典型的米氏方程。
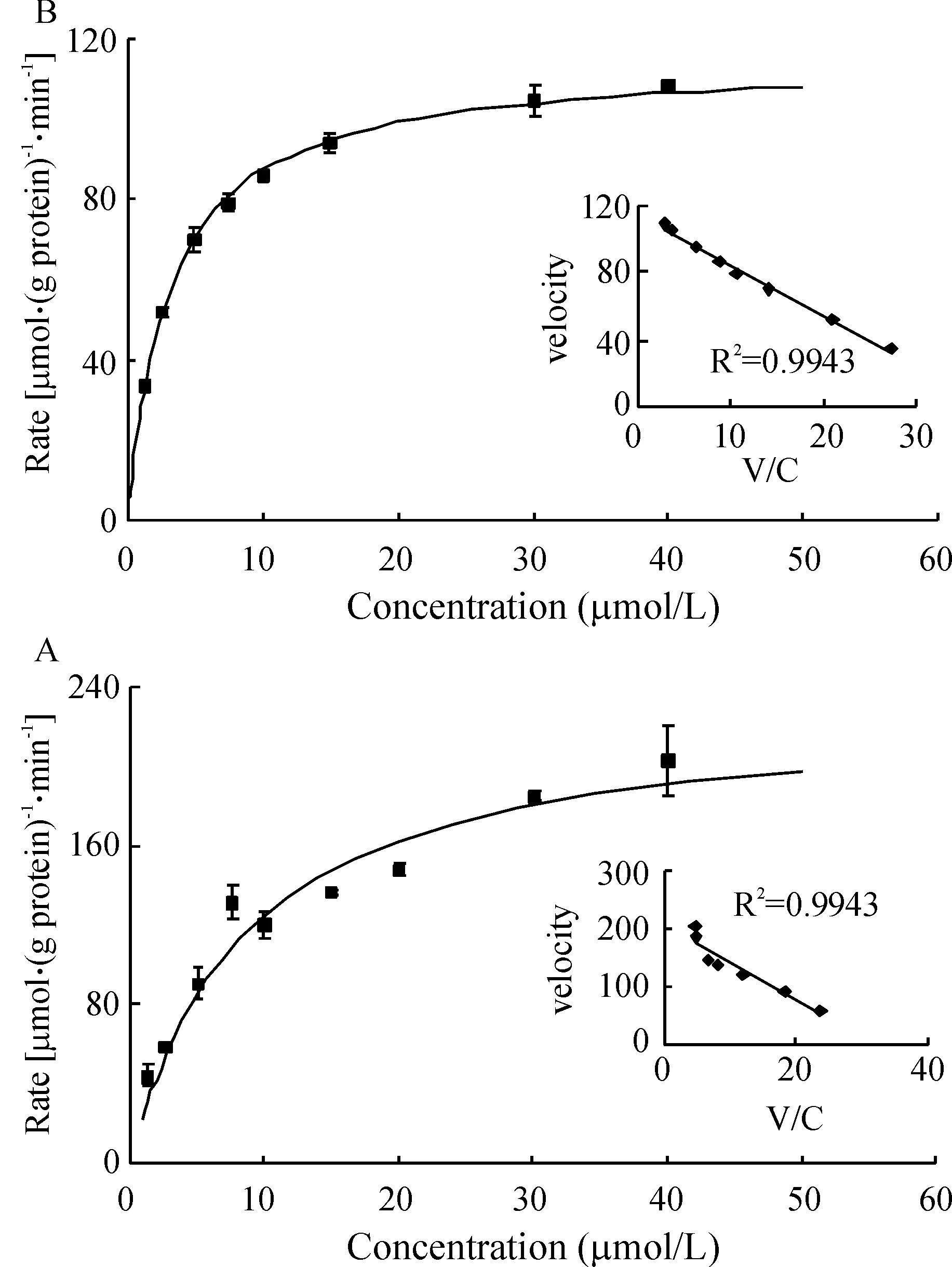

图4大黄素在人肝微粒体和肠微粒体中葡萄糖醛酸化反应的酶促动力学曲线
5人的12种UGT同工酶对大黄素的葡萄糖醛酸化的影响
我们选取了高、中、低3个浓度的大黄素(2.5、10、40 μmol/L),分别考察它们在不同人的UGT同工酶中的代谢速率的差异。大黄素浓度在2.5 μmol/L时不同的UGT同工酶对其催化反应速率,快慢的排列顺序依次为:UGT1A10[(4.30±0.98) μmol·(g protein)-1·min-1]>UGT1A9[(1.74±0.23) μmol·(g protein)-1·min-1]>UGT1A8[(1.47±0.08) μmol·(g protein)-1·min-1]≈UGT1A1[(1.28±0.03) μmol·(g protein)-1·min-1]≈UGT2B7[(1.19±0.04) μmol·(g protein)-1·min-1] >UGT1A7[(0.58±0.03) μmol·(g protein)-1·min-1];大黄素浓度在10 μmol/L时不同的UGT同工酶对其催化反应速率,快慢的排列顺序依次为:UGT1A10[(8.35±1.40) μmol·(g protein)-1·min-1] >UGT1A9[(4.00±0.29) μmol·(g protein)-1·min-1]≈UGT1A8[(3.98±0.70) μmol·(g protein)-1·min-1]>UGT2B7[(2.50±0.15) μmol·(g protein)-1·min-1]>UGT1A1[(2.15±0.79) μmol·(g protein)-1·min-1]>UGT1A7[(1.31±0.25) μmol·(g protein)-1·min-1];大黄素浓度在40 μmol/L时不同的UGT同工酶对其催化反应速率,快慢的排列顺序与10 μmol/L大黄素相同,依次为:UGT1A10[(10.96±0.80) μmol·(g protein)-1·min-1]>UGT1A9[(5.40±0.60) μmol·(g protein)-1·min-1]≈UGT1A8[(4.87±0.31) μmol·(g protein)-1·min-1]>UGT2B7[(3.17±0.13) μmol·(g protein)-1·min-1]≈UGT1A1[(2.81±0.49) μmol·(g protein)-1·min-1]>UGT1A7[(2.13±0.20) μmol·(g protein)-1·min-1](P<0.05)。因此无论大黄素的浓度如何, UGT1A10、1A9、1A8、2B7和1A1始终是最重要的代谢大黄素的几个同工酶。
讨 论
大黄素(1,3,8-三羟基-6-甲基蒽醌)是有着3个酚羟基的蒽醌类化合物,因此其羟基位置极易与葡萄糖醛酸结合,我们先后使用了人的肝微粒体、人的肠微粒体和人的重组化UGTs酶等对大黄素进行孵育实验,色谱和质谱结果证明大黄素极易被代谢成大黄素-葡萄糖醛酸化物,而且不同的肝肠微粒体酶代谢反应产生的新化合物均在同一时间出峰,证明生成的代谢产物为同一化合物,经核磁氢谱的结果判定此化合物为大黄素-3-O-葡萄糖醛酸。而大黄素的几种相似物如大黄酸等,我们前期实验也进行了肝微粒体孵育实验,但都未见有新的化合物产生,究其原因,它们的蒽醌母核在3位上均无酚羟基,这也可能是这几类药物无法产生葡萄糖醛酸化反应的原因。
近年来,人们对大黄蒽醌类化合物的代谢过程越来越重视,大黄的安全性亦日益倍受关注。美国NIH对大黄素和大黄蒽醌进行长达2年多的实验研究发现,在饲料中添加一定量大黄素,对F344/N雌性大鼠有诱发腺癌的可能[9]。因此,了解大黄蒽醌类化合物的代谢特点能够使我们更清楚地了解该类化合物发挥药效的物质基础,将极大地促进大黄素等化合物的药用开发。葡萄糖醛酸化结合反应是单羟基和多羟基蒽醌类药物的主要代谢通路[10]。在我们前期对大黄素的药代动力学研究表明其大黄素口服给药大鼠后,主要以葡萄糖醛酸化代谢产物的形式进入体循环[5, 11]。Teng等[12]研究了大黄素在人结肠癌细胞(Caco-2)中的代谢情况发现,主要代谢途径为葡萄糖醛酸化代谢,其次是磺酸化代谢。而我们在之前的研究也发现细胞色素P450 介导的氧化代谢很弱,说明葡萄糖醛酸化代谢是大黄素体内主要代谢途径。
目前鲜有报道大黄素在UGT1A或UGT2B亚家族中代谢研究。本实验填补了这一空白,我们将这两大家族联系在一起进行系统的研究,能进一步地促进我们对大黄素代谢过程的了解。从结果中可以看出UGT1A 家族对大黄素的葡萄糖醛酸结合反应起着主要作用,特别是UGT1A10、UGT1A9、UGT1A8和UGT1A1。而这些UGT的亚型与两个最重要的代谢场所有关,UGT1A1在肝肠中都有分布,UGT1A9只在肝中表达,而UGT1A10、UGT1A8只在肠中表达。而UGT1A10对大黄素的代谢最快,和我们之前推断的肠道是大黄素的主要代谢场所相吻合。
可以非常肯定的是,大黄素的极低生物利用度与其溶解度低、在体内易与葡萄糖醛酸结合而极性增强排出体外有直接的关系。
[1] 叶 青. 日本汉医应用大黄经验探析 [J]. 中国中医药现代远程教育, 2005, 3(7): 19-21.
[2] 冯 琳,孙炳文,田香兰. 大黄的临床应用 [J]. 四川中医, 2011, 29(2): 52-53.
[3] 周明学,徐 浩,陈可冀,等. 几种活血解毒中药有效部位对ApoE基因敲除小鼠主动脉粥样斑块稳定性的影响[J]. 中国病理生理杂志, 2008, 24(11): 2097-2102.
[4] 曲晓义,陈 愉,金惠铭,等. 复方大黄制剂预防大鼠肥胖的实验研究[J].中国病理生理杂志,2001,17(7):673-675.
[5] Liu W, Zheng Z, Liu X, et al. Sensitive and robust UPLC-MS/MS method to determine the gender-dependent pharmacokinetics in rats of emodin and its glucuronide [J]. J Pharm Biomed Anal, 2011, 54 (5): 1157-1162.
[6] Bosch TM. Pharmacogenomics of drug-metabolizing enzymes and drug transporters in chemotherapy [J]. Methods Mol Biol, 2008, 448: 63-76.
[7] Wu B, Basu S, Meng S, et al. Regioselective sulfation and glucuronidation of phenolics: insights into the structural basis [J]. Curr Drug Metab, 2011, 12 (9): 900-916.
[8] Liu W, Tang L, Ye L, et al. Species and gender differences affect the metabolism of emodin via glucuronidation [J]. AAPS J, 2010, 12 (3): 424-436.
[9] National Toxicology Program.NTP Toxicology and Carcinogenesis Studies of EMODIN (CAS NO. 518-82-1) Feed Studies in F344/N Rats and B6C3F1 Mice [J]. Natl Toxicol Program Tech Rep Ser, 2001, 493: 1-278.
[10]Shia CS, Juang SH, Tsai SY, et al. Metabolism and pharmacokinetics of anthraquinones inRheumpalmatumin rats andexvivoantioxidant activity [J]. Planta Med, 2009, 75 (13): 1386-1392.
[11]Shia CS, Hou YC, Tsai SY, et al. Differences in pharmacokinetics andexvivoantioxidant activity following intravenous and oral administrations of emodin to rats [J]. J Pharm Sci, 2010, 99(4): 2185-2195.
[12]Teng Z, Yuan C, Zhang F, et al. Intestinal absorption and first-pass metabolism of polyphenol compounds in rat and their transport dynamics in Caco-2 cells [J]. PLoS One, 2012, 7 (1): e29647.
Glucuronidationofemodininhumanliverandintestinalmicrosomes
LIU Wei1, WANG Yi-fei1, LIU Zhong-qiu2
(1GuangzhouJinanBiomedicineResearchandDevelopmentCenter,Guangzhou510632,China;2DepartmentofPharmaceutics,SchoolofPharmacy,SouthernMedicalUniversity,Guangzhou510515,China.E-mail:twangyf@jnu.edu.cn)
AIM: To investigate the glucuronidation of emodin in human liver and intestinal microsomes, and to elucidate the UDP-glucuronosyltransferase (UGT) isoforms involved in emodin glucuronidation.METHODSAfter incubation of emodin usinginvitrohuman liver or intestinal microsomal system,ultra-performance liquid chromatography (UPLC) was utilized to determine the glucuronides of emodin. Mass spectrum(MS) and nuclear magnetic resonance(NMR) were employed to elucidate the structures of metabolite. Screening assays with recombinant human UGTs were used to identify the UGT isoforms involved in the glucuronidation of emodin.RESULTSOnly one metabolite was identified and elucidated to be emodin-O-monoglucuronide. The metabolic behavior of emodin was followed typical monophasic Michaelis-Menten kinetics. Except UGT1A4 and UGT2B17, the other 10 UGTs were determined to participate in the glucuronidation of emodin.CONCLUSIONEmodin-O-monoglucuronide is the only metabolite of emodin in the incubation system of human liver and intestinal microsome. Different microsomes are responsible for the metabolism of emodin in different organs/regions of the digestive system. The glucuronidation of emodin in the intestine contributes significantly to that of emodin in the liver.
Emodin; Glucuronidation; Microsomes
R329.21
A
10.3969/j.issn.1000-4718.2012.09.025

