远志皂苷减轻Aβ1-40诱导的AD大鼠脑神经元tau蛋白Ser396位点的过度磷酸化*
徐柯乐, 陈 勤, 刘 伟, 姚媛媛, 夏醒醒, 张蓓蕾, 李燕斐
(安徽大学生命科学学院,安徽省中药研究与开发重点实验室,安徽 合肥 230039)
1000-4718(2012)09-1605-05
2012-04-02
2012-05-15
安徽省教育厅自然科学研究项目(No.KJ2009A116;No.KJ2011068);安徽省教育厅省级《细胞生物学》精品课程项目(No.2009024);教育部大学生创新性实验项目(No.2041044)
△通讯作者 Tel:0551-5108552;E-mail:chenqin169@163.com
远志皂苷减轻Aβ1-40诱导的AD大鼠脑神经元tau蛋白Ser396位点的过度磷酸化*
徐柯乐, 陈 勤△, 刘 伟, 姚媛媛, 夏醒醒, 张蓓蕾, 李燕斐
(安徽大学生命科学学院,安徽省中药研究与开发重点实验室,安徽 合肥 230039)
目的探讨远志皂苷对β-淀粉样肽1-40(Aβ1-40)诱导的阿尔茨海默病(AD)大鼠脑神经元tau蛋白过度磷酸化的影响。方法大鼠右侧海马CA1区注射Aβ1-40建立AD模型,并用远志皂苷(18.5 mg/kg、37.0 mg/kg和74.0 mg/kg)对大鼠进行灌胃治疗;免疫组织化学染色法观察大脑神经元中总tau蛋白、p-tau(Ser396)、蛋白激酶A(PKA)和蛋白磷酸酶2A(PP2A)蛋白的表达;蛋白免疫印迹技术检测大脑神经元中总tau蛋白含量、tau蛋白Ser396位点磷酸化以及PKA、PP2A蛋白的表达水平。结果与对照组相比,Aβ1-40组大脑神经元中总tau蛋白含量、tau蛋白Ser396位点磷酸化水平和PKA蛋白的表达水平显著升高,而PP2A蛋白的表达水平明显降低。与Aβ1-40组相比,远志皂苷各治疗组大鼠大脑神经元中总tau蛋白含量、tau蛋白Ser396位点磷酸化水平和PKA蛋白表达水平下降明显,而PP2A蛋白表达水平显著升高。结论远志皂苷可能是通过下调PKA蛋白表达量,上调PP2A蛋白表达量,减轻AD大鼠脑神经元中tau蛋白Ser396位点的过度磷酸化,使神经细胞免遭Aβ1-40的毒害。
远志皂苷; β-淀粉样肽; 阿尔茨海默病; 大鼠; Tau蛋白; 磷酸化
阿尔茨海默病(Alzheimer disease,AD)是一种常见于老年人群中的中枢神经系统退行疾病。尸解发现其主要病理特征为老年斑(senile plaque,SP)、神经原纤维缠结(neurofibrillary tangles,NFTs)及神经细胞凋亡等[1]。研究发现NFTs的主要成分是过度磷酸化的tau蛋白,正常水平磷酸化的tau 蛋白对于微管的组装和稳定有着重要作用,而过度磷酸化的tau蛋白则丧失其生理功能,导致微管解聚和细胞骨架损毁,最终导致神经细胞凋亡。Tau蛋白的磷酸化水平受到细胞内蛋白激酶A(protein kinase A,PKA) 和蛋白磷酸酶2A(Aprotein phosphatase 2A,PP2A)的共同调节。中药远志的主要药用成分是远志皂苷(tenuigenin,TEN),药理和临床研究表明,其具有改善记忆、抗氧化、抗衰老、强心、降压及抗痴呆的作用[2]。本室前期实验已证明[3-6],TEN对脑内注射β-淀粉样肽1-40(amyloid β-peptide 1-40,Aβ1-40)的AD大鼠和小鼠的学习记忆均有显著的改善效应,并证明其对Aβ1-40诱导的原代神经细胞的神经毒性有一定的治疗效果。但TEN对Aβ诱导的AD大鼠脑神经元中tau蛋白磷酸化是否有干预作用,目前尚未见报道。本研究采用大鼠右侧海马注射Aβ1-40建立AD大鼠模型,并用TEN进行干预治疗,观察TEN对AD大鼠脑神经元tau蛋白磷酸化水平的影响。
材 料 和 方 法
1材料
1.1药物 TEN由本室自制,含TEN甲素、TEN乙素等成分,经高效液相色谱法测定,其中TEN甲素含量为72%。
1.2动物 SD大鼠,体重(280±30) g,雌雄兼用,由安徽医科大学实验动物中心提供,合格证号为皖医动准字01号。
1.3试剂 Aβ1-40购自Sigma。临用前以无菌生理盐水将Aβ1-40稀释成1 g/L,37 ℃孵育l周,并小心搅拌,使其变为聚集状态的Aβ[4]。兔抗β-actin、兔抗PKA多克隆抗体、鼠抗PP2A多克隆抗体、兔抗tau蛋白多克隆抗体和辣根过氧化物酶标记的羊抗兔IgG均为北京博奥森生物技术有限公司产品;兔抗p-tau(Ser396)为南京金斯瑞生物科技有限公司产品;生物素标记羊抗鼠IgG为江苏碧云天生物公司产品;生物素标记羊抗兔IgG、正常山羊血清和SABC免疫组化试剂盒均为武汉博士德生物工程有限公司产品;HRP-DAB底物显色试剂盒和化学发光试剂均为天根生化科技(北京)有限公司产品。
1.4仪器 江湾I型C脑立体定位仪,第二军医大学产品;2315型石蜡切片机,Leica产品;Olympus BX41荧光显微镜(带DP70摄像系统),Olympus产品;5417型台式冷冻离心机,Eppendorf产品;DYCZ-24DN型,迷你双垂直电泳仪(槽) 、DYCZ-40D型半干式转移电泳槽,均为北京市六一仪器厂产品。
2方法
2.1动物模型制作与实验分组 取SD大鼠50只,随机分为:(1)对照组;(2)Aβ1-40组;(3)~(5)组为TEN低、中、高3个剂量组,每组10只。按前文报道的方法[3]行脑定位右侧海马CA1区注射(位置:前囟后3.0 mm,中线旁开2.0 mm,深度2.9 mm)。(2)~(5)组大鼠一次性注射Aβ1-40,每鼠1 μL,(1)组大鼠同部位注射等量无菌生理盐水。术后给予青霉素钠盐4×104U肌注,每天1次,连续3 d。术后第4 d起,(3)~(5)组大鼠分别灌胃 TEN 18.5 mg/kg、37.0 mg/kg及74.0 mg/kg,(1)和(2)组大鼠灌胃等体积生理盐水。连续用药30 d。
2.2取材及样本制备 大鼠腹腔注射10%水合氯醛麻醉,剪开胸腔暴露心脏,灌注针从左心室插入致主动脉根底,用手术剪剪开右心耳,先快速灌注生理盐水冲洗致流出液体无血水,再灌注4%多聚甲醛,待肝脏变成灰白色停止灌注,断头取脑,PBS清洗后,用10%中性甲醛固定,常规脱水、浸蜡、包埋、进行冠状切片,片厚4 μm。取0.2 g脑组织加1 mL蛋白裂解液,研磨裂解20 min(以上过程均在冰浴中完成),低温(0 ℃)高速(14 000 r·min-1)离心10 min,取上清置-20 ℃冰箱贮存备用。
2.3免疫组织化学检测 石蜡切片常规脱蜡复水,用1% H2O2阻断内源性过氧化物酶20 min,PBS洗3次每次5 min,用0.01 mol·L-1枸橼酸盐缓冲液沸水煮10 min,PBS洗3次每次5 min,5%新鲜山羊血清封闭37 ℃孵育30 min(勿洗,甩干即可),加Ⅰ抗[总tau、p-tau(Ser396)、PKA和PP2A,PBS按1∶100稀释],湿盒内孵化4 ℃过夜,滴加生物素标记的Ⅱ抗应用液(1∶100),37 ℃孵育2 h,滴加2滴SABC 37 ℃孵育45 min,0.02% PBST溶液浸洗防非特异性背景,DAB显色,苏木精复染,梯度乙醇脱水,透明,中性树胶封固。设立0.01 mol·L-1PBS代替Ⅰ抗作阴性对照。每个样本随机抽取1张脑片,在光镜下随机选取海马CA1区1个视野(×400),数200个细胞中的阳性细胞数,统计阳性细胞数。
2.4Western blotting检测 提取的蛋白样品用BCA试剂盒进行蛋白定量。取适量样品,加入等体积的2×上样缓冲液(1 mol·L-1pH 6.8 Tris-HCl,2.5 mL;β-巯基乙醇,1.0 mL;SDS,0.6 g;甘油,2.0 mL;0.1%溴酚蓝水溶液,1.0 mL;超纯水,3.5 mL)混匀,在100 ℃沸水中煮5 min,各组取15 μg样品进行SDS-聚丙烯酰胺凝胶(5%浓缩胶、12%分离胶)电泳分离,先用100 V电泳待溴酚蓝至浓缩胶底改用120 V电泳,当溴酚蓝距离分离胶底1 cm时停止电泳。分离的蛋白在250 mA、冰浴条件下转膜150 min,将目的蛋白转移到NC膜上,用TBST简单洗膜,室温下用新配的5%脱脂奶粉封闭作用3 h,TBST简单洗膜后加入TBST稀释的Ⅰ抗[β-actin(1∶1 000) 、总tau(1∶500)、p-tau(Ser396)(1∶700)、PKA(1∶500)和PP2A(1∶500)]4 ℃过夜;TBST洗涤3×20 min,加入TBST稀释的辣根过氧化物酶标记的Ⅱ抗(1∶2 000)室温孵育2 h,TBST洗涤2×20 min,TBS洗涤15 min,用化学发光剂避光反应2~3 min,将NC膜置于保鲜膜包裹好后置于片夹中,在暗室中感光在胶片上。以β-actin作为内参照,统计各组蛋白与β-actin灰度值的比值。
3统计学处理
结 果
1TEN对AD大鼠脑神经元总tau及p-tau(Ser396)表达的影响
采用免疫组化法分别检测神经元总tau及p-tau(Ser396),结果发现,对照组大鼠皮层和海马区神经元中有极少量的tau及p-tau(Ser396)棕黄色斑块出现,大多数神经元形态完整,轴突结构明显,而Aβ1-40组大鼠皮层和海马区神经元中tau及p-tau(Ser396)阳性细胞数显著增多,尤以海马CA1区最甚,与对照组相比,差异显著(P<0.01);当连续用药30 d后,TEN 3个剂量组大鼠皮层和海马区神经元中tau及p-tau(Ser396)阳性细胞数明显减少,以高剂量组效果最佳(均P<0.01)。蛋白免疫印记检测进一步证实,Aβ1-40组大鼠神经元中总tau和p-tau(Ser396)蛋白表达上调,与对照组比较,差异显著(P<0.01),而经TEN干预治疗后,3个剂量组总tau和p-tau(Ser396)蛋白表达下调明显(均P<0.01),提示TEN对总tau蛋白和tau磷酸化有一定的抑制作用,见图1~3。
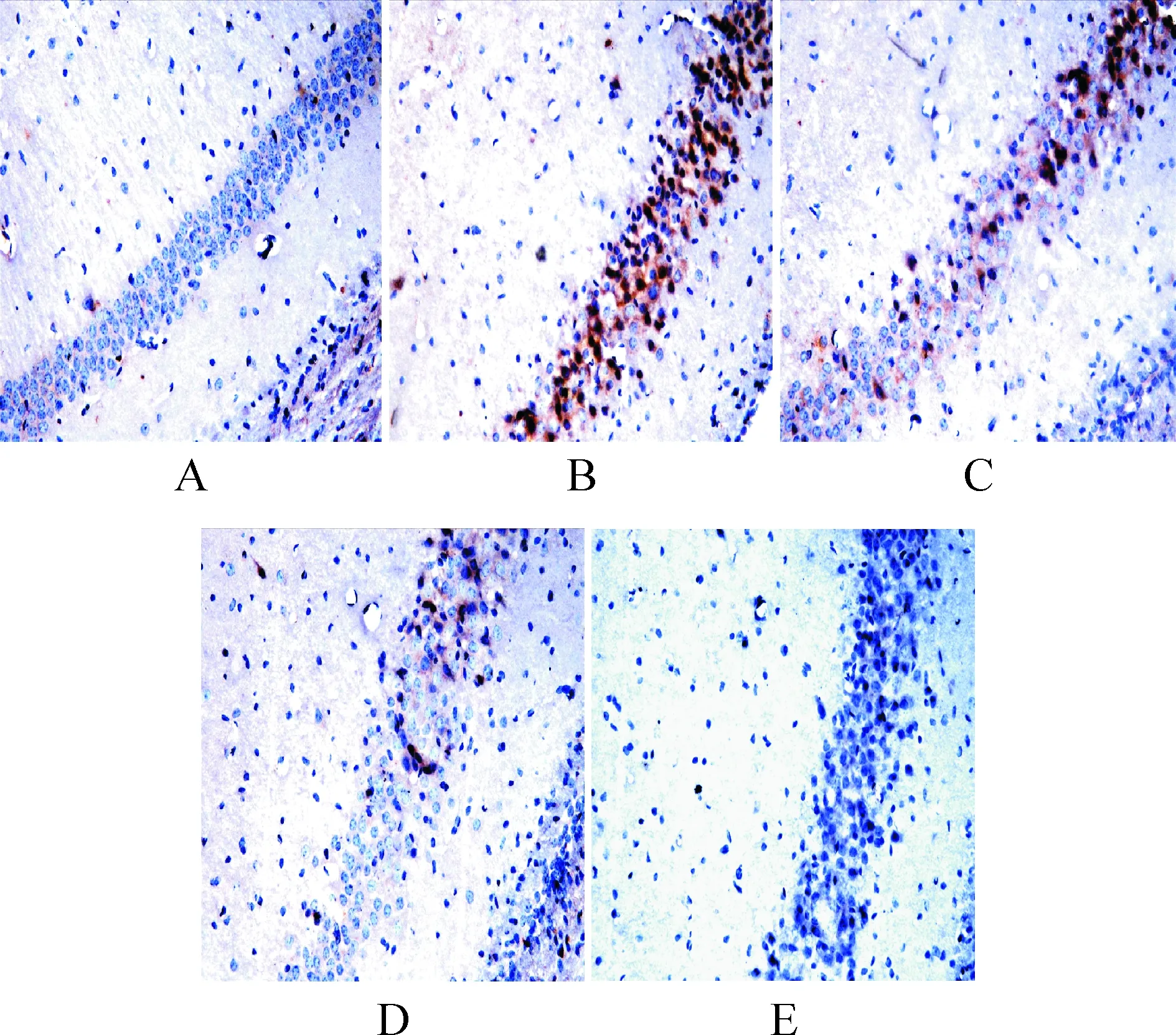
Figure 1. Effect of TEN on the expression of total tau protein in CA1 region neurons of the hippocampus of AD rats(×400).A: sham operation group;B: Aβ1-40group;C: Aβ1-40+TEN(18.5 mg·kg-1) group;D: Aβ1-40+TEN(37.0 mg·kg-1) group;E: Aβ1-40+TEN(74.0 mg·kg-1) group.
图1TEN对AD大鼠海马CA1区神经元总tau蛋白表达的影响
2TEN对AD大鼠脑神经元PKA和PP2A表达的影响
免疫组化显示,对照组大鼠皮层和海马中的PKA阳性细胞分布较少,而PP2A阳性细胞数明显增多,而Aβ1-40组大鼠皮层和海马区神经元中可见到大量的棕黄色斑块的PKA阳性细胞,而PP2A阳性细胞数却明显减少,说明脑内注射Aβ1-40可引起PKA活性增高和PP2A活性降低。当连续对AD大鼠灌胃给予TEN 30 d后,发现TEN 3个剂量治疗组均可以减低PKA的活性,增强PP2A的活性,与Aβ1-40组比较,差异显著(均P<0.01)。蛋白免疫印迹检测显示,Aβ1-40组大鼠神经元中PKA表达量上调(P<0.01);而PP2A表达量下调(P<0.01)。经TEN干预治疗后,TEN治疗组PKA表达量较模型组明显降低,而PP2A表达量较模型组显著升高,3个剂量组呈明显的量效关系(均P<0.01),图2、4。
讨 论
Tau蛋白是微管相关蛋白(microtubule-associated proteins,MAPs)中含量最高的组分。在正常人大脑中,tau蛋白处于一种低水平的磷酸化状态(含2~3个磷酸基),但在AD患者大脑中tau蛋白出现多位点的异常磷酸化,异常磷酸化的tau蛋白自身聚集成PHF/NFT结构,最终诱发神经元微管结构广泛破坏,正常轴突转运受损,引起突触丢失神经元功能损伤,发生脑神经退行性病变[7-8]。目前,在PHF-tau中已鉴定出45个磷酸化位点[9],尤其是Ser396、Ser404、Ser199/202、Thr231和Thr181位点的磷酸化,可以改变tau蛋白与微管结合部位的构象,导致微管解体,细胞骨架破坏[10-11]。研究表明,Aβ的产生和在大脑皮层的沉积是AD形成和发展的重要因素[12],大鼠脑内注射凝集态Aβ可导致tau蛋白特定位点磷酸化水平升高和神经元凋亡。本实验采用大鼠右侧海马CA1区注射Aβ1-40建立AD模型,并应用免疫组化和蛋白免疫印迹术观察总tau及tau蛋白磷酸化变化水平,发现Aβ1-40可导致大鼠脑神经元总tau蛋白及p-tau(Ser396)的表达上升,而连续口服TEN 30 d后,各治疗组总tau蛋白及tauSer396位点磷酸化水平呈现不同程度的降低,其中以高剂量组效果最为明显,揭示TEN能降低AD大鼠脑细胞中总tau蛋白含量和tau蛋白磷酸化水平,恢复tau蛋白的正常生理功能,有助于微管的组装与稳定性,防止NFT的形成。
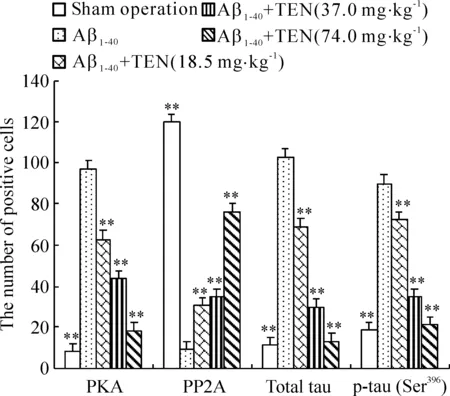

图2TEN对AD大鼠神经元PKA、PP2A、总tau蛋白和p-tau(Ser396)表达的影响


图3TEN对AD大鼠神经元总tau蛋白和p-tau(Ser396)表达量的影响


图4TEN对AD大鼠神经元PKA和PP2A表达量的影响
细胞内tau蛋白磷酸化水平主要受蛋白激酶(如PKA、GSK-3β等)和蛋白磷酸酶(如PP2A、PP2B等)的调节,正常情况下tau蛋白磷酸化与去磷酸化处于动态平衡。但在AD时这种动态平衡遭到破坏而引起tau蛋白磷酸化异常增高。PKA是催化tau蛋白磷酸化最重要的蛋白激酶之一,它不仅自身直接催化tau蛋白多个位点的磷酸化,而且其对tau蛋白的预磷酸化使tau蛋白的构象发生改变更易被GSK-3β、CDK5等蛋白激酶磷酸化[13]。PP2A是神经细胞中活性最强的磷酸酶,它能催化异常磷酸化tau蛋白去磷酸化(脱磷酸基)、释放游离tau蛋白、恢复tau蛋白生物学活性以及松解NFT缠绕结构[14-15]。用PP1和PP2A的抑制剂可引起大鼠海马神经元突触和树突丢失,伴有tau蛋白的过度磷酸化[16]。另外在PP2A基因突变小鼠脑中发现tau蛋白异常过度磷酸化现象[17]。研究证明,AD患者脑中PP2A和PP2B活性均低于正常老人。目前认为AD患者大脑神经细胞中蛋白激酶活性增高和磷酸酶活性缺陷可能是引起tau蛋白过度磷酸化的主要原因。本研究发现大鼠脑内注射Aβ1-40可导致PKA表达含量升高及PP2A的活性受到抑制,经TEN干预治疗后,PKA表达含量明显降低,同时PP2A的活性恢复。
综上所述,TEN对AD大鼠脑神经元的保护作用可能是通过下调PKA蛋白和上调PP-2A蛋白表达,从而降低脑神经元总tau蛋白含量,恢复tau蛋白正常磷酸化,进而达到保护脑神经元的作用。关于TEN治疗AD是否还有其它途径,尚待进一步研究。
[1] Kayed R.Anti-tau oligomers passive vaccination for the treatment of Alzheimer disease[J].Hum Vaccin,2010,6(11):931-935.
[2] 姜 勇,屠鹏飞. 远志的研究进展[J].中草药,2001,32(8):759- 761.
[3] 陈 勤,曹炎贵,张传惠,等.远志皂苷对β-淀粉样肽和鹅膏蕈氨酸引起胆碱能系统功能降低的影响[J].药学学报,2002,37(12):913- 917.
[4] 陈 勤,高晨曦,葛礼浩.远志皂苷对脑定位注射Aβ1-40拟AD大鼠脑内神经形态病理学变化的影响[J].激光生物学报,2006,15(3):294- 298.
[5] 陈 勤,李磊珂.远志皂苷对β淀粉样蛋白1-40诱导的体外培养皮层神经细胞损伤的保护作用[J].中国中药杂志,2007,32(13):1336- 1339.
[6] 陈庆林,陈 勤,金蓓蓓.远志皂苷对AD小鼠学习记忆能力及中枢胆碱能系统标志酶活性的影响[J].中药药理与临床,2011,27(3):33- 36.
[7] 张 蕊,苑玉和,赵 明,等.细胞骨架与神经退行性疾病[J]. 中国药理学通报,2011,27(8):1041-1044.
[8] Blennow K,deLeon MJ,Zetterberg H.Alzheimer’s disease[J].Lancet,2006,368 (9533):387-403.
[9] Hanger DP,Anderton BH,Noble W.Tau phosphorylation:the therapeutic challenge for neurodegenerative disease[J].Teeads Mol Med,2009,15(3):112-119.
[10]Zhou XW, Li X, Bjorkdahl C,et al.Assessments of the accumulation severities of amyloid beta-protein and hyperphosphorylated tau in the medial temporal cortex of control and Alzheimer’s brains[J].Neurobiol Dis,2006, 22(3):657-668.
[11]Liu SJ,Zhang AH, Li HL,et al.Overactivation of glycogen synthase kinase-3 by inhibition of phosphoinositol-3 kinase and protein kinase C leads to hyperphosphorylation of tau and impairment of spatial memory[J].J Neurochem,2003,87(6):1333-1344.
[12]Yatin SM,Aksenova M,Aksenov M,et al.Temporal relations among amyloid β-peptide-induced free-radical oxidative stress,neuronal toxicity,and neuronal defensive responses[J].J Mol Neurosci,1998,11(3):183-197.
[13]Gong CX, Liu F, Grundke-Iqbal I,et al. Post-translational modifications of tau protein in Alzheimer’s disease[J].J Neural Transm,2005,112(6):813-838.
[14]胡志红,田 青,王建枝,等. 丝氨酸苏氨酸蛋白磷酸酯酶在tau蛋白异常磷酸化中的作用[J]. 生理科学进展,2006,37(2):33-37.
[15]鲁远君. 阿尔茨海默病中针对tau蛋白治疗的研究进展[J]. 中国神经免疫学和神经病学杂志,2008,15(3):211-213.
[16]Vogelsberg-Ragaglia V,Schuck T,Trojanowski JQ,et al.PP2A mRNA expression is quantitatively decreased in Alzheimer’s disease hippocampus[J].Exp Neurol,2001,168(2):402-412.
[17]Schild A,Ittner LM, Gotz J.Altered phosphorylation of cytoskeletal proteins in mutant protein phosphatase 2A transgenic mice[J].Biochem Biophys Res Commun,2006,343(4):1171-1178.
EffectoftenuigeninontauproteinphosphorylationatSer396siteinneuronsofADratsinducedbyAβ1-40
XU Ke-le, CHEN Qin, LIU Wei, YAO Yuan-yuan, XIA Xing-xing, ZHANG Bei-lei, LI Yan-fei
(SchoolofLifeScience,AnhuiUniversity,AnhuiProvinceKeyLaboratoryofR&DofChineseMedicine,Hefei230039,China.E-mail:chenqin169@163.com)
AIM: To investigate the effect of tenuigenin (TEN) on hyperphosphorylation of tau protein in neurons of amyloid β-peptide1-40(Aβ1-40) -induced Alzheimer disease (AD) rats.METHODSAβ1-40was injected into hippocampus CA1 region of the rats to establish AD model. TEN at different doses (18.5 mg/kg, 37.0 mg/kg and 74.0 mg/kg) was intragastrically administered. The protein expression of protein kinase A (PKA),protein phosphatase 2A (PP2A), total tau and p-tau (Ser396) in the neurons was observed by the method of immunohistochemistry. The protein content of total tau and p-tau (Ser396), and the expression level of PKA and PP-2A were detected by Western blotting analysis.RESULTSIn Aβ1-40group, the level of total tau, the phosphorylation of tau protein and the expression of PKA were significantly increased compared with those in sham operation group. Meanwhile, the expression of PP2A in Aβ1-40group was lower than that in sham operation group. In TEN treatment group, the level of total tau, the phosphorylation of tau protein and the expression of PKA were markedly decreased, and the expression of PP2A was increased as compared with Aβ1-40group.CONCLUSIONTEN may protect the neurons from the toxic effect of Aβ1-40and reduce the hyperphosphorylation of tau (Ser396) in the neurons of AD rats by activating the expression of PP2A and inhibiting the expression of PKA.
Tenuigenin; Amyloid β-peptide; Alzheimer disease; Rats; Tau protein; Phosphorylation
R966
A
10.3969/j.issn.1000-4718.2012.09.012

