葡萄糖对人脐静脉内皮细胞蛋白C受体表达的影响及吡格列酮的干预作用
郭小芳, 刘海波, 任惠龙, 陈宏卫, 赖静波, 龚维坤, 成兴波, 卢国元
(鄞州人民医院 1内分泌科, 2心内科,浙江 宁波 315040;苏州大学附属第一医院 3内分泌科, 4肾内科,江苏 苏州 215006)
1000-4718(2012)09-1565-06
2012-03-29
2012-07-13
△通讯作者 Tel:0574-87016961;E-mail:liuhaibo79@eyou.com
葡萄糖对人脐静脉内皮细胞蛋白C受体表达的影响及吡格列酮的干预作用
郭小芳1,3, 刘海波2△, 任惠龙1, 陈宏卫1, 赖静波1, 龚维坤1, 成兴波3, 卢国元4
(鄞州人民医院1内分泌科,2心内科,浙江 宁波 315040;苏州大学附属第一医院3内分泌科,4肾内科,江苏 苏州 215006)
目的研究葡萄糖对人脐静脉内皮细胞蛋白C受体(EPCR) mRNA 表达的影响,以及吡格列酮的干预作用。方法体外培养人脐静脉内皮细胞(HUVECs),分别以流式细胞术和RT-PCR技术确认HUVECs膜上EPCR的表达水平和 mRNA 水平的表达。再分别以含不同浓度D-葡萄糖(5、10、30、50 mmol/L)的培养基以及含吡格列酮(5、10、20 μmol/L)或不含吡格列酮的高糖(50 mmol/L)培养基孵育HUVECs 24 h,行剂量和时间依赖性实验,并采用实时定量PCR技术测定HUVECs细胞 EPCR mRNA 的表达。结果随着培养基D-葡萄糖浓度的增加,HUVECs培养24 h后其EPCR mRNA 的表达逐渐下调。在采用吡格列酮干预后, 50 mmol/L高糖处理的HUVECs EPCR mRNA 表达的下调得到明显改善。结论(1)EPCR 在HUVECs上高表达,高糖可通过下调EPCR mRNA 的表达而损伤内皮细胞功能。(2)吡格列酮可阻止高糖诱导的HUVECs EPCR mRNA表达的下调,从而保护内皮细胞功能。
内皮细胞; 葡萄糖; 吡格列酮; 内皮细胞蛋白C受体
高血糖是糖尿病(diabetes mellitus,DM)大血管并发症发生发展的主要危险因素,而糖尿病血管并发症的发生与内皮功能受损密切相关[1],内皮功能受损后可引起凝血活化及一系列的炎症反应[2],从而参与动脉粥样硬化(atherosclerosis,AS)的进程。因此减少血管内皮功能损伤,对防治糖尿病血管并发症具有重要的临床意义。 内皮细胞蛋白C受体(endothelial cell protein C receptor,EPCR) 是近年发现的蛋白C(protein C,PC)系统的一个新成员,主要表达于内皮细胞,它能与PC特异性结合,使PC活化效率提高5倍,而发挥抗凝作用[3]。同时有研究表明EPCR也有重要的抗炎作用[4]。因此,EPCR在维持血管内皮功能中发挥着重要的作用。 吡格列酮(pioglitazone)是近年来发现的一类新型口服胰岛素增敏剂,已有研究表明吡格列酮具有抗炎及保护内皮功能的作用[5],但其具体机制尚不十分清楚。 本研究通过体外培养人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs),初步探讨高糖对HUVECs EPCR mRNA 表达的影响,以及吡格列酮对高糖造成的内皮细胞 EPCR mRNA 表达下调的改善作用,探讨糖尿病大血管病变及吡格列酮保护血管内皮功能的新机制,为糖尿病血管并发症的防治提供新的思路。
材 料 和 方 法
1材料
1.1药物与试剂 RPMI-1640 培养基购自Gibco;小牛血清、胎牛血清购自杭州四季青公司;琼脂糖购自Amresco;胰酶购自 Difcd;FITC-羊抗鼠Ⅱ抗购自Immunotech; Trizol 购自Invitrogen;DEPC购自BBI; M-MLV、随机引物和 dNTP购自Promega;RNA 酶抑制剂(RNasin)购自上海华美生物技术公司;Taq 酶购自上海晶美生物工程有限公司;D-葡萄糖为国产分析纯; HUVECs(ECV304)为苏州大学附属第一医院血栓与止血研究室冻存细胞株;鼠抗人 EPCR 多克隆抗体由王迎春教授惠赠;吡格列酮储存液由苏州大学附属第一医院心内科王育林博士惠赠。鼠抗人单克隆β-actin 购自 Sigma。
1.2主要仪器 Ex TaqTMR-PCR Version 2.1 购自大连宝生物公司;Eva Green 购自Biotium;流式细胞仪 Cytomics FC500 购自 Beckman Coulter;实时定量(real-time) PCR 仪 MJ Research Opticon2TM购自MJ Research;PCR 引物由上海生物工程有限公司合成。
2方法
2.1HUVECs的培养 复苏HUVECs细胞,用含 15%小牛血清的 RPMI-1640 培养基在 37 ℃、5%CO2条件下培养。2~3 d换液1次,并按合适密度传代。将HUVECs细胞以 1×108/L密度接种于 6 孔板中,用含 15%小牛血清的 RPMI-1640 培养基在 37 ℃、5% CO2条件下培养 24 h,在高倍显微镜下观察,发现细胞贴壁生长,并有 80%~90%融合。再用无血清的 RPMI-1640 培养基替换完全培养基,37℃、5% CO2条件下孵育过夜。
2.2实验分组 实验一 : HUVECs细胞用含D-葡萄糖的低血清(含 3%小牛血清)RPMI-1640 培养基培养 24 h,观察不同D-葡萄糖浓度(5 mmol/L 、10 mmol/L、30 mmol/L、50 mmol/L)时 EPCR mRNA 的表达;同时以 D-葡萄糖浓度为 50 mmol/L 的低血清(含 3%小牛血清)RPMI-1640 培养基培养HUVECs细胞,观察不同时点(0.5 h、3 h、6 h、12 h、24 h)时 EPCR mRNA 的表达。以相同时间的不加刺激剂组为对照。实验二: HUVECs细胞先以含不同浓度(5 μmol/L、10 μmol/L、20 μmol/L)吡格列酮的低血清(含 3%小牛血清)RPMI-1640 培养基培养 6 h,然后置于含 50 mmol/L葡萄糖的新鲜低血清(含 3%小牛血清)RPMI-1640 培养基中孵育至 24 h。同时以相同时间的不加刺激剂组为空白对照,以相同时间含 50 mmol/L 葡萄糖的低血清(含 3%小牛血清)RPMI-1640 培养基培养 24 h 组为阳性对照。每个实验组设 5 复孔,每次实验重复 3 次。
2.3流式细胞仪检测EPCR在HUVECs细胞的表达 采用流式细胞仪技术检测HUVECs细胞膜上 EPCR 的表达。生长至 80%融合的细胞以 0.25%胰酶消化,收集细胞,保证细胞数达到 1×109/L,1×PBS 洗涤3次;每管加 200 μL 1×PBS,重悬;均匀分成2管,其中一管加入 20 μL 鼠抗人 EPCR Ⅰ抗(1 μg∶20 μL),另一管加入 20 μL 1×PBS 作为空白对照;4 ℃ 湿盒中反应 1 h;离心、弃上清,1×PBS 洗涤3次,每管加 250 μL 1×PBS,重悬;每管加入 10 μL FITC-羊抗鼠Ⅱ抗(1 μg∶10 μL),黑暗处反应 30 min;离心、弃上清,1×PBS 洗涤3次,每管加 250 μL 1×PBS,重悬;流式细胞仪上检测。
2.4采用逆转录-聚合酶链反应(reverse transcription-polymerase chain reaction,RT-PCR)和实时定量PCR(real-time quantitative PCR)技术检测EPCR mRNA的表达。
2.4.1总RNA抽提 利用Trizol试剂从各组HUVECs中提取总RNA,紫外分光光度计测定A260/A280为1.8~2.2,并将 mRNA 浓度调整至 0.5 g/L。
2.4.2逆转录反应 取mRNA 3 μg,随机引物 2 μL,加 DEPC 水补足反应总体积至 15 μL,65 ℃ 变性 5 min 后立即冰浴;加 M-MLV 1 μL、 缓冲液 8 μL 、RNasin 0.5 μL 和 dNTP 1.25 U,加 DEPC 水补足反应总体积至 25 μL,37 ℃ 1 h 后,95 ℃ 5 min灭活逆转录酶。
2.4.3聚合酶链反应(polymerase chain reaction,PCR) β-actin上游引物5’-CTCGCGCTACTCTCTCTTTC-3’,下游引物5’-CAGTCTCGATCCCACTTAA-3’,扩增片段330 bp。EPCR 上游引物 5’-ATTGCTGCCGATACTGCT-3’,下游引物5’-AGAGGAAAGGCCAAGGTC-3’,扩增片段318 bp。以上序列由上海生物工程有限公司合成。以β-actin(330 bp)作内参照。反应条件:EPCR为 94 ℃ 4 min 后开始循环,94 ℃ 40 s→58 ℃ 40 s→72 ℃ 40 s,共 30 个循环,最后72 ℃ 10 min;β-actin 为 94 ℃ 4 min 后开始循环,94 ℃ 40 s→58 ℃ 40 s→72 ℃ 40 s,共 28 个循环,最后 72 ℃ 10 min。反应后 1.5%琼脂糖凝胶上样,电泳鉴定结果。
2.4.4实时定量PCR 反应体系:5×buffer 5 μL,Mg2+(250 mmol/L)0.25 μL,dNTP(10 mmol/L)0.75 μL,Taq酶(250 U∶50 μL) 0.25 μL,上游引物(10 mmol/L) 0.5 μL,下游引物 (10 mmol/L) 0.5 μL,Evagreen(10 mmol/L) 0.5 μL,双蒸水 15.45 μL,cDNA 2 μL,共 25 μL 体系;反应条件:95 ℃ 5 min 预变性,95 ℃ 15 s→58 ℃ 25 s→72 ℃ 25 s→78 ℃ 0.1 s;读板;50 个循环;60 ℃~96 ℃ 0.3 s 熔解曲线;72 ℃ 5 min;4 ℃,forever。结果计算公式:(1)相对量=2-ΔCt,ΔCt=目的基因 Ct-内参基因 Ct;(2)实验组∶对照组的相对量=2-ΔΔCt,ΔΔCt=实验组ΔCt-对照组ΔCt。
3统计学处理

结 果
1流式细胞术检测结果
EPCR在HUVECs表面高表达,为96.5%,见图1。
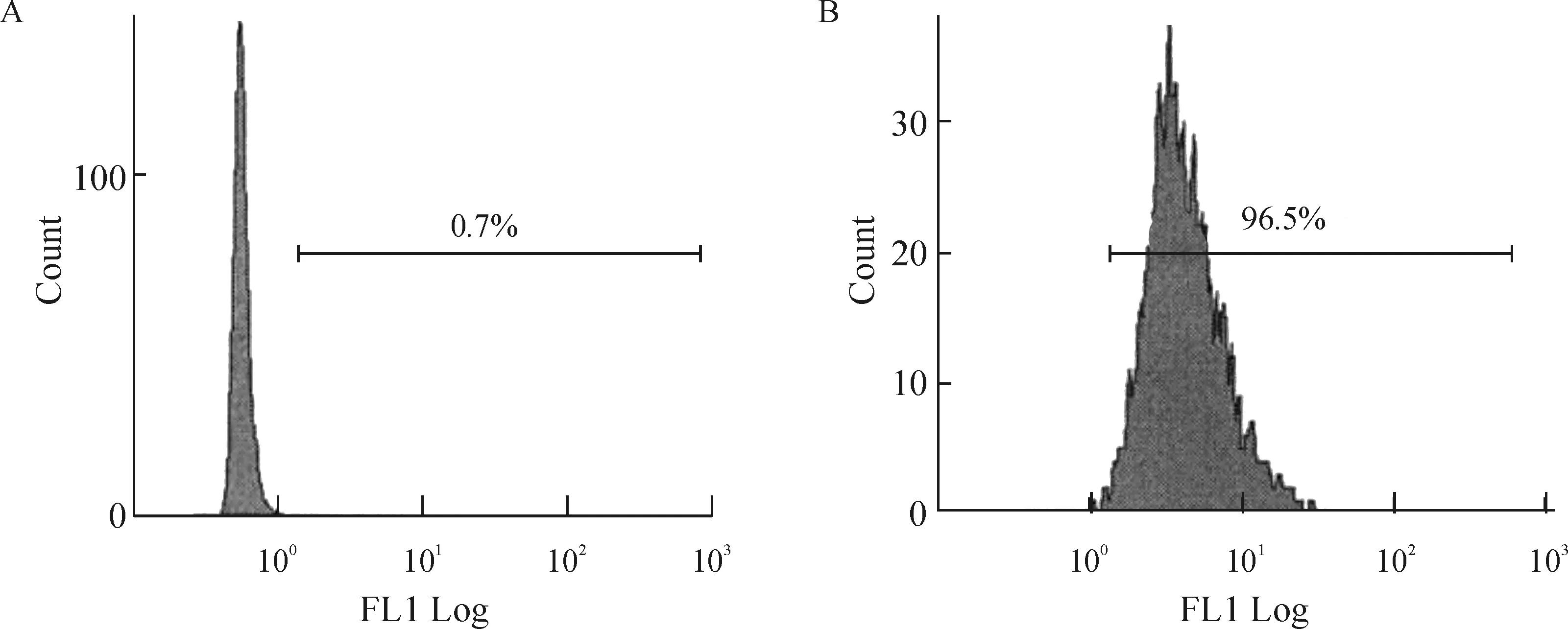
Figure 1. The expression of EPCR protein in HUVECs was confirmed by flow cytometry. A: HUVECs control, treated with PBS; B: HUVECs test, treated with mouse anti-human EPCR antibody.
图1流式细胞术检测EPCR在HUVECs表面的表达
2RT-PCR结果
RT-PCR结果显示HUVECs细胞膜上有较高的EPCR mRNA表达,见图2。

Figure 2. The expression of EPCR mRNA in HUVECs was confirmed by reverse transcription-polymerase chain reaction (RT-PCR) technique. M:marker;EPCR:318 bp;β-actin:330 bp.
图2HUVECs细胞EPCRmRNA的表达
3D-葡萄糖和吡格列酮对HUVECs细胞EPCRmRNA表达的影响
3.1相同时间不同浓度D-葡萄糖对HUVECs EPCR mRNA的影响 已80%融合的HUVECs细胞中加入D-葡萄糖使其浓度分别达5 mmol/L、10 mmol/L、30 mmol/L和50 mmol/L,以低血清(含 3%小牛血清)RPMI-1640 培养基培养HUVECs细胞为空白对照。24h后EPCR mRNA水平分别是空白对照组(100%)的(93.58±0.96)%(P>0.05)、(91.42±0.13)%(P>0.05)、(85.14±0.56)%(P<0.05)和(65.02±0.62)%(P<0.01),高糖明显下调HUVECs细胞EPCR mRNA的表达(P<0.05)。EPCR mRNA 的表达随加入D- 葡萄糖浓度的增加而逐渐减少,在 D- 葡萄糖浓度为30 mmol/L和50 mmol/L时EPCR mRNA的表达呈显著下降(P<0.05),并呈剂量依赖性,见图3。
3.2相同浓度D-葡萄糖不同时间培养HUVECs对EPCR mRNA的影响 加入50 mmol/L D-葡萄糖分别培养HUVECs细胞0.5 h、3 h、6 h、12 h和24 h。与空白对照组(100%)相比,0.5 h、3 h和6 h时EPCR mRNA水平分别为(95.68±0.76)%、(95.62±0.56)%和(92.58±0.58)%,但与对照组相比无显著差异(P>0.05);12 h和24 h时EPCR mRNA水平分别为(82.96±0.89)%(P<0.05)和(64.78±0.86)%(P<0.01),D-葡萄糖对EPCR mRNA表达的影响呈时间依赖性,见图4。
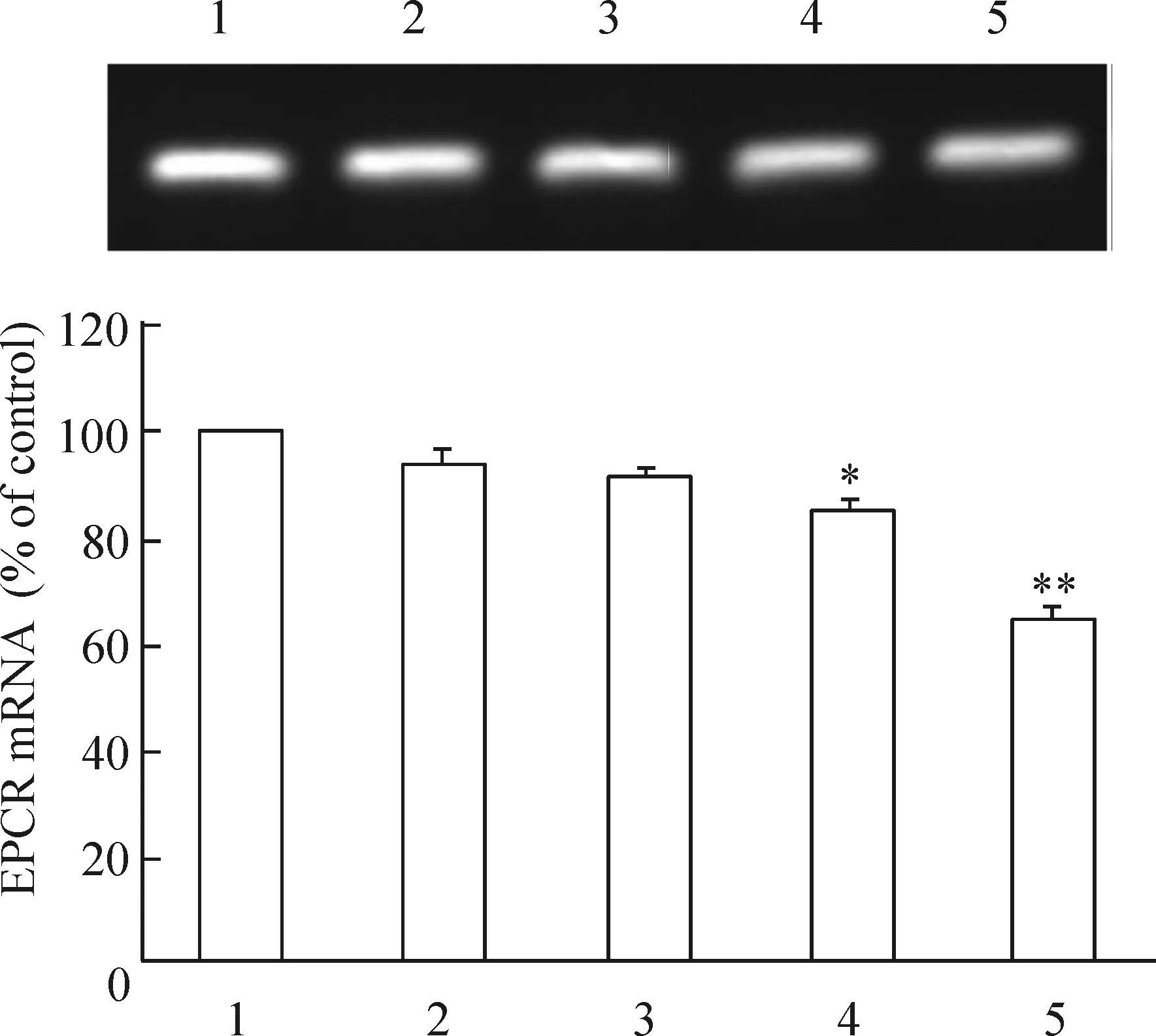

图3不同浓度D-葡萄糖对EPCRmRNA表达的影响

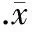
图4不同时间相同浓度D-葡萄糖对EPCRmRNA表达的影响
3.3不同浓度吡格列酮预处理对HUVECs EPCR mRNA表达的影响 HUVECs细胞生长至80%融合后分为5组,分别为低血清(含 3%小牛血清)RPMI-1640培养基培养的空白对照组、仅加50 mmol/L D-葡萄糖的阳性对照组和以不同浓度吡格列酮(5 μmol/L、10 μmol/L及20 μmol/L)预处理的实验组。实验组加入不同浓度吡格列酮预作用6 h,然后换新鲜的含50 mmol/L D-葡萄糖的培养基孵育至24 h。其中以空白对照组EPCR mRNA的表达设为100%,阳性对照组EPCR mRNA的表达为(65.50±0.81)%,不同吡格列酮浓度(5 μmol/L、10 μmol/L和20 μmol/L)预处理后其EPCR mRNA的表达分别为(72.82±0.46)%、(76.60±1.59)%和(82.60±0.57)%(与对照组比)。高糖刺激下HUVECs细胞EPCR mRNA表达明显降低,适宜浓度的吡格列酮预处理HUVECs细胞能显著改善高糖对EPCR mRNA表达的下调作用(P<0.05),见图5。
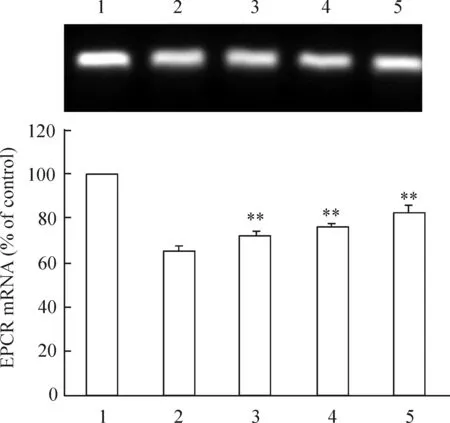

图5不同浓度吡格列酮干预对EPCRmRNA表达的影响
讨 论
高血糖是糖尿病的主要代谢特征,国内外的研究均已证实高血糖可直接或间接损伤内皮细胞功能,促进炎症反应及血栓形成,参与糖尿病血管并发症发生和发展的进程。
EPCR 是近年发现的PC系统的一个新成员,是一个由 221 个氨基酸组成的Ⅰ型跨膜糖蛋白,主要表达于大血管内皮细胞,其通过凝血酶(thrombin)-凝血酶调节蛋白(thrombomodulin,TM)复合物增进PC活性,提高PC的活化率。活化蛋白 C(the activated protein C,APC)在蛋白S、膜磷脂、Ⅴ因子及钙离子等辅因子参与下,灭活 FVa 和Ⅷa,发挥抗凝作用[6]。另外,APC的抗炎作用也是近年来研究的热点。其可能主要通过以下机制实现抗炎作用:首先,APC可直接作用于内皮细胞,通过下调 NF-κB的2个亚基(P50 和P52)的表达而下调下游基因的肿瘤坏死因子的表达;其次,其还能下调黏附分子ICAM-1、VCAM-1和E-选择素的表达;同时,APC 还能直接上调内皮细胞bcl-2等抗凋亡基因的表达[7]。而所有这些分子机制的进程,均需要EPCR作为辅因子参与[3]。同时,新近的研究也表明EPCR对炎症导致的内皮损伤具有直接的保护作用。Taylor等[8]已证明,EPCR能介导APC保护狒狒,使之抵抗因大肠杆菌输入引起的致死作用。EPCR也可以直接抑制病原体介导的内皮细胞炎症反应[9]。
综上所述,EPCR可通过与PC/APC特异性结合发挥抗凝及抗炎作用,对维持血管内皮功能起着至关重要的作用。因此,EPCR也有可能参与高糖损伤内皮细胞的进程。
目前,高血糖损伤内皮细胞功能机制的研究主要集中在如下几个方面:(1)多元醇途径活性增强,导致细胞生长必需的肌醇减少及胞内山梨醇聚集以及高渗透压而损伤内皮细胞(endothelial cells,ECs); (2)非酶糖基化及糖基化终末产物(AGEs)的形成,AGEs引起ECs增殖异常,并促进ECs死亡;(3)高糖状态下产生过多的氧自由基,其对ECs产生严重的毒害作用[10]。现有研究已表明EPCR在维持血管内皮细胞功能中发挥重要的作用,但目前关于高血糖是否通过EPCR损伤内皮细胞功能国内外还未见相关报道。
本研究通过体外培养HUVECs,采用定量 real-time PCR 技术测定 HUVECs EPCR mRNA 的表达水平,证实在HUVECs细胞膜上有较高的EPCR mRNA表达,并且在高糖条件下培养的HUVECs,其 EPCR mRNA 的表达明显下降,这表明高糖可通过下调EPCR mRNA的表达而导致血管内皮功能受损,这可能是糖尿病并发血管病变的新机制之一。
吡格列酮(troglizone)是一种噻唑烷二酮(thiazolidinedione,TZD) 类降血糖药物,其可以通过改善胰岛素抵抗,促进靶组织肌肉、肝脏、脂肪组织中糖的转运及脂肪分解,达到降低血糖的目的[11]。新近的研究显示,TZDs不但可以改善胰岛素抵抗,降低血糖,还可以直接通过抑制炎症反应、保护内皮功能等非降糖途径来发挥血管保护作用[12-13]。近年来的研究也表明吡格列酮通过保护内皮细胞功能而延缓动脉粥样硬化的早期进程[14]。然而,目前关于吡格列酮保护内皮细胞功能的机制还不十分明确,其是否可通过上调EPCR的表达来发挥其保护内皮细胞功能作用的研究还未见相关报道。
本研究发现在适量浓度的吡格列酮预处理HUVECs后,能明显改善高糖所致的HUVECs EPCR mRNA表达的下调。这表明吡格列酮在高糖环境下能上调EPCR mRNA的表达而拮抗高糖对HUVECs内皮功能的损伤,实现其血管保护作用。这可能对今后 DM 血管并发症发生发展的机制研究及靶向治疗具有重要意义。
综上所述,高血糖可通过下调EPCR mRNA的表达而损伤内皮细胞功能,而吡格列酮能通过改善高血糖导致的EPCR mRNA下调而发挥保护内皮细胞功能的作用,这可能是吡格列酮预防糖尿病血管并发症的新机制。
[1] Hartge MM, Unger T, Kintsher U. The endothelium and vascular inflammation in diabetes [J]. Diab Vasc Dis Res, 2007, 4(2):84-88.
[2] Schouten M, Wiersinga WJ, Levi M, et al. Inflammation, endothelium, and coagulation in sepsis[J]. J Leukoc Biol, 2008, 83(3): 536-545.
[3] Van de Wouwer M,Collen D,Conway EM,et al. Thrombomodulin-protein C-EPCR system: integrated to regulate coagulation and inflammation[J].Arterioscler Thromb Vasc Biol, 2004, 24(8):1374-1383.
[4] O’Brien LA, Richardson MA, Mehrbod SF,et al. Activated protein C decreases tumor necrosis factor-related apoptosis-inducing ligand by an EPCR-independent mechanism involving Egr-1/Erk-1/2 activation [J]. Arterioscler Thromb Vasc Biol, 2007, 27(10):2634-2641.
[5] 燕 子,武 烨,刘慧荣,等. 吡格列酮对高脂血症大鼠内皮功能的保护作用[J].中国病理生理杂志,2007,23(11):2086-2090.
[6] Van de Water NS, French JK, McDowell J, et al. The endothelial protein C receptor (EPCR) 23bp insert in patients with myocardial infarction [J]. Thromb Haemost, 2001, 85(4):749-750.
[7] Joyce DE, Gelbert L, Ciacha A, et al. Gene expression profile of antithrombotic protein C defines new mechanisms modulating inflammation and apoptosis[J]. J Biol Chem, 2001, 276(14):11199-11203.
[8] Taylor Jr FB, Stearns-Kurosawa DJ, Kurosawa S, et al. The endothelial cell protein C receptor aids in host defense againstEscherichiacolisepsis [J]. Blood, 2000, 95(5):1680-1686.
[9] DeAnna C Bublitz, Courtney E Noah, Jorge L Benach, et al. Francisella tularensis suppresses the proinflammatory response of endothelial cells via the endothelial protein C receptor[J]. J Immunol, 2010, 185(2): 1124-1131.
[10]李 岩,唐可欣,成 敏,等. 高糖对大鼠晚期内皮祖细胞增殖、迁移、黏附及分泌功能的影响[J]. 中国病理生理杂志,2011,27(12):2296-2301.
[11]Ceriello A, Johns D, Widel M, et al. Comparison of effect of pioglitazone with metformin or sulfonylurea (monotherapy and combination therapy) on postload glycemia and composite insulin sensitivity index during an oral glucose tolerance test in patients with type 2 diabe [J]. Diab Care, 2005, 28(2):266-272.
[12]Naka KK,Papathanassiou K, Bechlioulis A,et al.Effects of pioglitazone and metformin on vascular endothelial function in patients with type 2 diabetes treated with sulfonylureas[J]. Diab Vasc Dis Res, 2012,9(1):52-58.
[13]Papathanassiou K, Naka KK, Kazakos N, et al. Pioglitazone vs glimepiride: differential effects on vascular endothelial function in patients with type 2 diabetes [J]. Atherosclerosis, 2009, 205(1): 221-226.
[14]Davidson M, Meyer PM, Haffner S, et al. Increased high-density lipoprotein cholesterol predicts the pioglitazone-mediated reduction of carotid intima-media thickness progression in patients with type 2 diabetes mellitus [J]. Circulation, 2008, 117(16): 2123-2130.
EffectsofglucoseandpioglitazoneonexpressionofendothelialproteinCreceptorinhumanumbilicalveinendothelialcells
GUO Xiao-fang1,3, LIU Hai-bo2, REN Hui-long1, CHEN Hong-wei1, LAI Jing-bo1, GONG Wei-kun1, CHENG Xing-bo3, LU Guo-yuan4
(1DepartmentofEndocrinology,2DepartmentofCardiology,YinzhouPeople’sHospital,Ningbo315040,China;3DepartmentofEndocrinology,4DepartmentofNephrology,theFirstAffiliatedHospitalofSoochowUniversity,Suzhou215006,China.E-mail:liuhaibo79@eyou.com)
AIM: To investigate the effects of glucose and pioglitazone on the expression of endothelial protein C receptor (EPCR) in human umbilical vein endothelial cells (HUVECs).METHODSCultured HUVECs were used as target cells. The expression of EPCR in HUVECs at mRNA and protein levels was confirmed by reverse transcription-polymerase chain reaction (RT-PCR) and flow cytometry, respectively. Different concentrations of glucose were added to the culture medium to establish the injury model of HUVECs. Pioglitazone was also added to the culture medium to observe the reversible influence. The mRNA levels of EPCR were measured by real-time quantitative PCR.RESULTSThe expression of EPCR in HUVECs was down-regulated by hyperglycemia in a dose-and time-dependent manner. Pioglitazone reversed the down-regulation of the mRNA expression of EPCR by hyperglycemia in HUVECs.CONCLUSIONHUVECs express EPCR mRNA at a high level. Hyperglycemia damages the function of endothelial cells by down-regulating the expression of EPCR. Pioglitazone attenuates the injury of HUVECs induced by hyperglycemia.
Endothelial cells; Glucose; Pioglitazone; Endothelial protein C receptor
R589.9
A
10.3969/j.issn.1000-4718.2012.09.006

