EGFR蛋白在食管鳞癌中的表达及其临床意义
吴金训,余英豪,刘 伟
(中国人民解放军南京军区福州总医院病理科,福州350025)
食管癌是人类最常见的恶性肿瘤之一,其发生率和病死率居第4位[1]。目前食管癌的治疗仍以手术治疗为主,放疗、化疗为辅,70%的患者确诊时已处于临床中晚期,化疗效果不明显,5年生存率不足20%,复发和转移是导致患者死亡的主要原因,寻求新的治疗靶点,制订新的化疗方案是临床迫切需要解决的问题[2]。鉴于目前国内尚未见食管癌中表皮生长因子受体(epidermal growth factor receptor,EGFR)蛋白表达的大宗病例研究,该项研究采用免疫组织化学法检测食管鳞癌组织中EGFR的表达,探讨EGFR蛋白表达与食管癌发生、发展、浸润转移等临床病理特征的关系,以期为食管癌患者靶向治疗的深入研究提供一定的理论基础。
1 资料与方法
1.1一般资料 选择2004年1月至2010年6月在南京军区福州总医院手术切除的食管鳞癌标本1300例,选择其中临床资料完整的1034例进行研究,其中男778例,女256例,年龄24~87(平均56.9)岁。所有病例术前均未行放疗、化疗。肉眼分型为蕈伞型、溃疡型、髓质型、缩窄型。食管鳞癌TNM分期采用AJCC标准(2002)[3]。
1.2实验仪器与试剂试剂购自福州迈新生物技术开发公司,一抗为鼠抗人单克隆抗体EGFR。试剂盒选用EliVisionTM plus试剂盒;石蜡切片机(LEICA RM2245);显微镜(OLYMPUS BX51);电热恒温干燥箱(上海-恒科技有限公司)。所有标记均设阳性对照并用磷酸盐缓冲液代替一抗作阴性对照。
1.3方法 手术标本经10%中性甲醛固定,石蜡包埋,3 μm厚连续切片,分别进行HE和免疫组织化学染色。采用EliVisionTM plus方法进行免疫组织化学染色的主要步骤:石蜡切片、脱蜡、水化,磷酸盐缓冲液(phosplate buffer saline,PBS)冲洗3次,每次冲洗3 min;胃酶抗原修复,37℃ 10 min;加3%过氧化氢溶液,室温下孵育10 min,以阻断内源性过氧化物酶;PBS冲洗3次,每次冲洗3 min;加第一抗体,室温下孵育60 min;PBS冲洗3×5 min;室温下孵育20 min;PBS冲洗3次,每次冲洗3 min;加酶标抗鼠聚合物,室温下孵育30 min;PBS冲洗3次,每次冲洗3 min;加新配制的3,3'-二氨基联苯胺显色液,自来水冲洗,苏木素复染,0.1%盐酸分化,自来水冲洗,PBS冲洗返蓝;梯度乙醇脱水干燥,中性树脂封片。
1.4EGFR过表达的判断标准 肿瘤细胞不着色或<10%的肿瘤细胞着色为阴性,≥10%的肿瘤细胞着色为阳性,并根据肿瘤阳性细胞数所占比例分为10%~25%为弱阳性(+),>25%为强阳性(++)[2]。
1.5统计学方法 采用SPSS 16.0软件进行统计分析,计数资料采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1EGFR蛋白在食管鳞癌中的表达 食管鳞癌组织中EGFR阳性表达定位于胞膜,少量定位于胞质,其表达呈明显的异质性(图 1)。癌旁(距癌灶>2 cm)非肿瘤性食管黏膜未见EGFR过表达(图2)。
2.2EGFR蛋白表达与食管鳞癌患者临床及病理参数的关系 在1034例食管鳞癌组织中EGFR过表达率高达74.9%(774/1034),阴性表达260例。EGFR蛋白过表达阳性率与患者性别,年龄,肿瘤大小,肉眼分型,TNM分期,浸润深度,淋巴结转移及远处转移等临床及病理参数无统计学意义(P>0.05),而高、中分化胃癌中EGFR的表达阳性率显著高于低、未分化胃癌(P <0.05)(表1)。

图1 EGFR蛋白在食管鳞癌中过表达(×100)
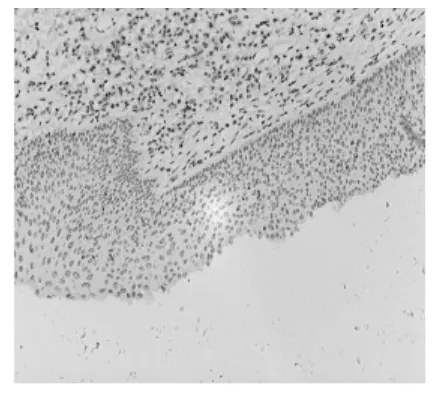
图2 癌旁非肿瘤性食管黏膜EGFR阴性(×100)

表1 EGFR蛋白过表达与食管鳞癌患者临床病理参数的关系 [例(%)]
3 讨论
EGFR是原癌基因 C-erbB-1的表达产物,是EGFR家族的成员之一,即ErbB1。EGFR基因定位于人第 7号染色体的短臂(7p12.3~p12.1),长约118 kb,含有28个外显子,编码一个相对分子质量为170 ×103的糖蛋白[3]。刘伟等[4]在前期研究中发现,EGFR在胃癌中的过表达率为17.03%,且其表达与浸润深度、组织类型、分化程度、淋巴结转移等密切相关(P<0.05),EGFR过表达可以作为评价胃癌恶性生物学行为和预后的参考指标。研究发现,胃癌、肝癌、结直肠癌、肺癌以及乳腺癌中均存在EGFR蛋白过表达,且与肿瘤细胞的增殖、血管生成、黏附、侵袭和转移等相关[5-6]。
该项研究结果显示,1034例食管鳞癌EGFR过表达率为74.9%(774/1034),与文献报道一致[7-9]。关于EGFR蛋白过表达与食管鳞癌患者的临床参数及预后的相关性尚有争议。李洪胜等[10]观察42例食管癌,局部淋巴结转移者的EGFR阳性率高于无局部淋巴结转移者(56.52%vs 26.32%,P <0.05);远处转移者EGFR阳性率高于无远处转移者(47.62%vs 27.08%,P <0.05)。Wang 等[11]报道 103 例食管及与胃交界处腺癌,EGFR蛋白过表达率为32%(33/103),EGFR蛋白过表达与病理分期、淋巴结转移以及TNM分期有关,而与肿瘤分化无关,且具有EGFR过表达患者的预后较差。然而,有些学者认为EGFR蛋白过表达与患者的临床参数及预后无明显相关性[12-13]。该项研究中EGFR蛋白过表达与患者性别、年龄、肿瘤大小、肉眼分型、TNM分期、浸润深度、淋巴结转移及远处转移等临床病理参数均无相关性(P>0.05),而高、中分化胃癌中EGFR的表达显著高于低、未分化胃癌(P<0.05),这种差异可能与样本量大小不一及阳性判断标准不同有关。关于EGFR与食管癌患者的临床病理参数及预后的相关性尚需多中心大样本及标准化的免疫组织化学检测进一步证实。
目前,关于EGFR与肿瘤靶向治疗的研究多数集中于非小细胞肺癌,以 EGFR酪氨酸激酶抑制剂为靶点的肿瘤分子靶向治疗研究,成为肿瘤治疗研究的热点。在非小细胞肺癌中EGFR的突变位点主要位于外显子18、19、20及外显子21上,占总突变的95%以上[14-15]。研究表明,EGFR基因酪氨酸激酶ATP结合域的体细胞突变及扩增与非小细胞肺癌患者对酪氨酸激酶抑制剂吉非替尼及抗EGFR单克隆抗体西妥昔单克隆抗体治疗敏感性密切相关。在EGFR突变患者中应用吉非替尼及西妥昔单克隆抗体有效率可达80%以上,而EGFR野生型患者的有效率在10%以下[16-17];具有EGFR基因扩增患者有效率达40%以上,而EGFR基因无扩增患者有效率在10%以下[18]。EGFR在食管癌中的过表达,为其靶向治疗提供新的治疗靶点,EGFR靶向药物在食管鳞癌中的使用目前尚无大规模的临床试验报道,得出的结论也不一致。Ferry等[19]采用吉非替尼治疗进展期食管腺癌27例,研究显示单药吉非替尼二线治疗食管癌,特别是男性、腺癌、低表达EGFR的病例并未显示出明显的优势,而食管鳞癌、女性、过表达EGFR的的病例的治疗效果较传统化疗有较明显的优势。Janmaat等[20]Ⅱ期临床研究二线治疗食管癌的研究发现,吉非替尼对EGFR过表达的女性、鳞癌患者的有效率较高。虽然早期的临床试验应用针对EGFR的靶向药物治疗食管癌已显示出一定的疗效,但仍有很大部分患者不能从靶向治疗中获益。研究EGFR蛋白表达、基因扩增及基因突变状态对研究EGFR基因与靶向治疗的关系及筛选对EGFR靶向治疗敏感的患者都具有重要意义。
目前,关于食管癌中EGFR基因扩增率及与蛋白表达是否具有一致性尚存在争议。食管癌中EGFR是否存在基因突变,突变位点、突变率如何,对于具有基因突变或扩增的患者应用靶向药物的疗效如何等都需要进一步的基础及临床试验研究。该项本研究的后续研究中,将选取部分EGFR蛋白过表达的病例,应用荧光原位杂交技术和直接测序法分别检测EGFR基因扩增和基因突变情况,进一步探索食管癌EGFR过表达的机制,为临床选取针对EGFR抗体的靶向药物提供初步的理论依据。
[1]Jemal A,Siegel R,Ward E,et al.Cancer statistics,2009[J].CA Cancer J Clin,2009,59(4):225-249.
[2]Racette AL,Miller RT.Esophageal carcinoma:matching patients with treatment methods[J].JAAPA,2011,24(1):28-31.
[3]Hofstetter W,Correa AM,Bekele N,et al.Proposed modification of nodal status in AJCC esophageal cancer staging system[J].Ann Thorac Surg,2007,84(2):365-373.
[4]刘伟,余英豪,陈娟,等.EGFR在中国胃癌患者中的表达及其临床意义[J].世界华人消化杂志,2010,18(25):2648-2653.
[5]Ciardiello F,Tortora G.EGFR antagonists in cancer treatment[J].N Engl J Med,2008,358(15):1160-1174.
[6]Ruppert AM,Wislez M,Poulot V,et al.A simple view on lung cancer biology:The EGFR pathway[J].Rev Mal Respir,2011,28(4):565-577.
[7]Rocha-Lima CM,Soares HP,Raez LE,et al.EGFR targeting of solid tumors[J].Cancer Control,2007,14(3):295-3.4.
[8]付建华,杨达宽,黄云超,等.EGFR和 E-cadherin在食管癌组织中的表达及两者的相关性[J].癌症,2005,24(2):241-245.
[9]Hanawa M,Suzuki S,Dobashi Y,et al.EGFR protein overexpression and gene amplification in squamous cell carcinomas of the esophagus[J].Int J Cancer,2006,118(5):1173-1180.
[10]李洪胜,王远东,谭小军,等.EGFR及 E-cadherin表达与食管癌的关系[J].肿瘤研究与临床,2005,17(3):175-177.
[11]Wang KL,Wu TT,Choi IS,et al.Expression of epidermal growth factor receptor in esophageal and esophagogastric junction adenocarcinomas association with poor outcome[J].Cancer,2007,109(4):658-667.
[12]Gotoh M,Takiuchi H,Kawabe S,et al.Epidermal growth factor receptor is a possible predictor of sensitivity to chemoradiotherapy in the primary lesion of esophageal squamous cell carcinoma[J].Jpn J Clin Oncol,2007,37(9):652-657.
[13]Kii T,Takiuchi H,Kawabe S,et al.Evaluation of prognostic factors of esophageal squamous cell carcinoma(stageⅡ~Ⅲ)after concurrent chemoradiotherapy using biopsy specimens[J].Jpn J Clin Oncol,2007,37(8):583-589.
[14]Kimura H,Kasahara K,Kawaishi M,et al.Detection of epidermal growth factor receptor mutations in serum as a predictor of the response to gefitinib in patients with non-small cell lung cancer[J].Clin Cancer Res,2006,12(13):3915-3921.
[15]Tiseo M,Rossi G,Capelletti M,et al.Predictors of gefitinib outcomes in advanced non-small cell lung cancer(NSCLC):study of a comprehensive panel of molecular markers[J].Lung Cancer,2010,67(3):355-360.
[16]Miller VA,Riely GI,Zakowski MF.Molecular characteristics of bronchioloalveolar carcinoma and adenocarcinoma,bronchioloalveolar carcinoma subtype,predict response to erlotinib[J].J Clin Oncol,2008,26(9):1472-1478.
[17]Cappuzzo F,Ligorio C,Jänne PA,et al.Prospective study of gefitinib in epidermal growth factor receptor fluorescence in situ hybridization positive/phospho-Akt-positive or never smoker patients with advanced nonsmall-cell lung cancer:the ONCOBELL tria1[J].J Clin Oncol,2007,25(16):2248-2255.
[18]Pinto C,Di Fabio F,Siena S,et al.Phase Ⅱ study of cetuximab in combination with FOLFIRI in patients with untreated advanced gastric or gastroesophageal junction adenocarcinoma(FOLCETUX study)[J].Ann Oncol,2007,18(3):510-517.
[19]Ferry DR,Anderson M,Beddard K,et al.A phase Ⅱ study of gefitinib monotherapy in advanced esophageal adenocarcinoma:evidence of gene expression,cellular,and clinical response[J].Clin Cancer Res,2007,13(19):5869-5875.
[20]Janmaat ML,Gallegos-Ruiz MI,Rodriguez JA,et al.Predictive factors for outcome in a phaseⅡstudy of gefitinib in second-line treatment of advanced esophageal cancer patients[J].J Clin Oncol,2006,24(10):1612-1619.

