G-四链体的结构及其与小分子配体成复合物的结构研究进展
姜志辉,张大志
(第二军医大学药学院有机化学教研室,上海 200433)
·综述·
G-四链体的结构及其与小分子配体成复合物的结构研究进展
姜志辉,张大志
(第二军医大学药学院有机化学教研室,上海 200433)
通过与DNA的结合而从生物学源头阻止疾病的发生成为近年研究的热点,DNA G-四链体结构的发现以及分子生物学相关技术对其与癌症关系的揭示,为抗肿瘤药物的设计提供了一个良好的突破口。本文综述了近三年来G-四链体的结构及其与小分子配体成复合物的结构研究进展,有助于理解G-四链体与小分子配体的作用模式,以期为合理设计抗肿瘤药物有所帮助。
G-四链体;小分子配体;复合物结构
恶性肿瘤是危害人类健康和生命的重大疾病,在抗肿瘤药物的众多研发路线上,以生物靶分子为基础进行抗肿瘤药物先导化合物的筛选成为抗肿瘤药物的研究热点之一[1]。端粒是位于真核细胞线性染色体末端的一段长为5~15 kb的(TTAGGG)n重复序列和一些结合蛋白组成的特殊结构。正常细胞中端粒长度随着 DNA的复制而相应缩短,当端粒缩短到临界长度时细胞开始凋亡。癌细胞中独有存在的端粒酶可以保持端粒长度而使得癌细胞无限繁殖下去。众所周知,端粒末端由富含G的单链构成,当此单链在一定的生理条件下形成G-四链体时,会使得端粒酶无法产生作用。基于此,能稳定G-四链体的小分子配体的设计研究在抗肿瘤药物研究中占有重要一席。本文对当今 G-四链体的结构及其与小分子配体成复合物的结构研究进展进行综述,有助于理解G-四链体与小分子配体的作用模式,从而有利于此类抗肿瘤药物的合理设计。
1 G-四链体的结构
1962年,Gellert等首次发现了G-四链体结构[2],直到90年代,随着分子生物学对端粒结构及其生物过程的揭示,发现端粒末端的富G片段能在一定生理条件下形成G-四链体而阻止癌细胞中端粒酶对端粒进行延长。因此,G-四链体的结构和生物功能引起了人们极大的兴趣。随后,科学家们又在人类基因组和RNA中发现了多处能形成G-四链体的序列。G-四链体由1个以上的G-四集体构成,而G-四集体又由四个鸟嘌呤通过 Hoogsteen氢键作用连接而成,如图1所示。
当G-四集体堆叠形成G-四链体时,需要金属离子的稳定[3],特别是碱金属离子,如K+,Na+等。这些金属离子位于G-四集体的中心,与鸟嘌呤的O6有静电相互作用,如图2。
据Julian等研究表明,一段序列需具有d(G3+N1-7G3+N1-7G3+N1-7G3+) 这种形式才能在特定条件下形成G-四链体[4]。G-四链体分为分子间和分子内两大类。分子间G-四链体结构又分为两类,一类是由两条链构成,每条链通常含两个连续的G序列,如Oxytricha nova端粒序列d (G4T4G4)。另一类由四条独立的链连接而成,每条链含至少一个连续的G序列。图3为图1、图2两类结构的示意图。
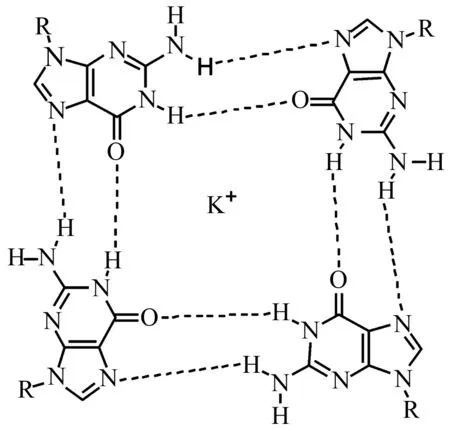
图1 四个鸟嘌呤通过氢键作用形成G-四集体结构(虚线为氢键作用,中心为钾离子)

图2 G-四链体的立体模型(左图为侧面示意图,右图为从上往下看的示意图)
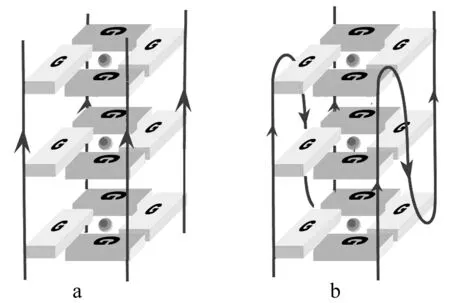
图3 两种G-四链体结构示意图a为四条链构成的分子间G-四链体,b为两条链构成的分子间G-四链体[5]
分子内G-四链体由一条含至少四段连续G序列的单链构成,它在不同的生理条件下(如金属离子的类型与浓度,pH,细胞因子等)能形成不同的构型,如图4。
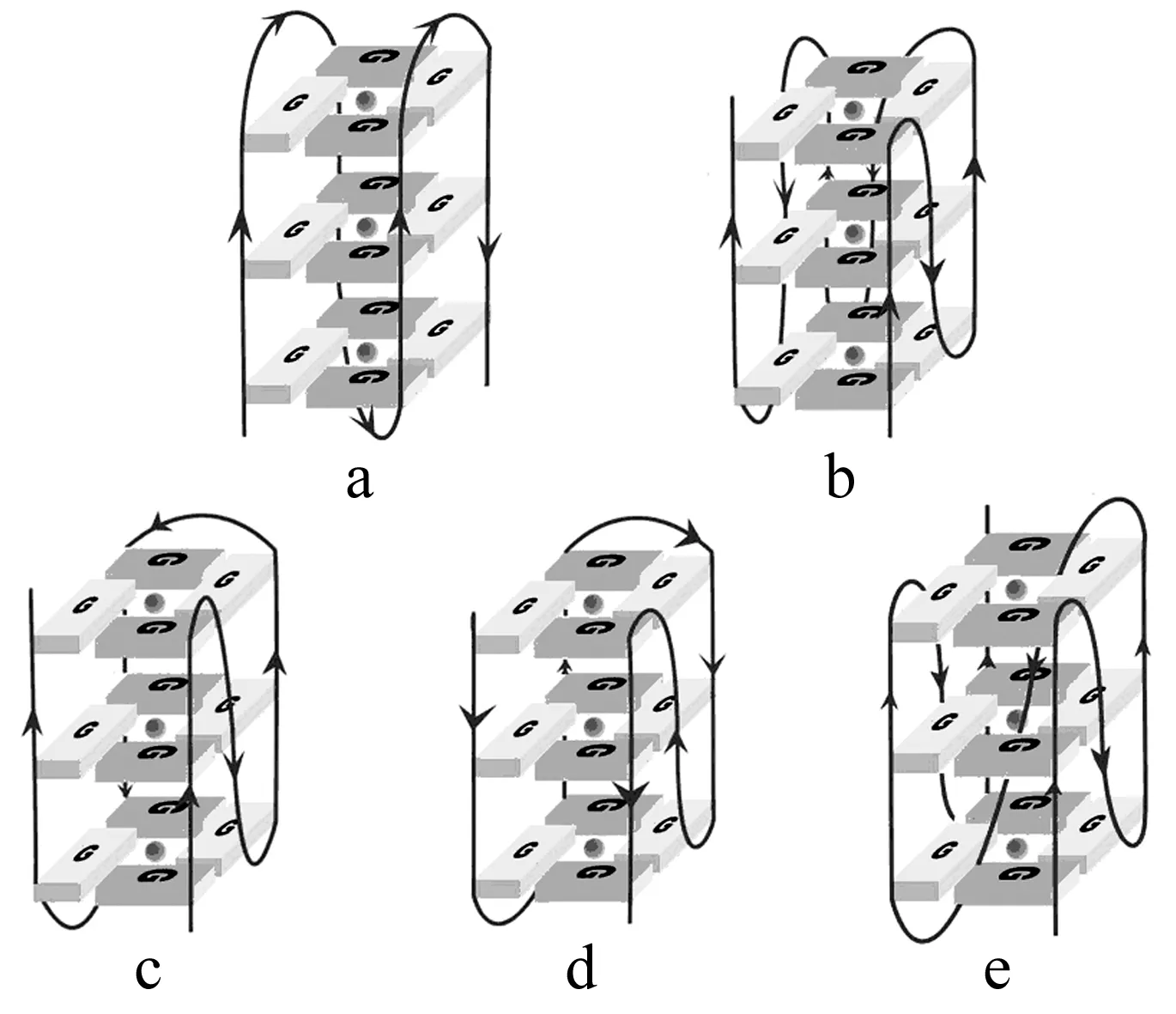
图4 分子间G-四链体的不同构型[6]
a-存在于Na+中的人端粒四链体的反向平行结构;b-存在于K+中的人端粒四链体的平行结构;c-存在于K+中的人端粒四链体的(3 + 1) 杂合结构;d-存在于K+中的人端粒四链体的另一(3 + 1) 杂合结构;e-c-kit启动子的四链体结构。
G-四链体的构型不仅与它形成的周围环境密切相关,还与它自身的性质相关,例如形成它的不同核苷酸序列[7],自身的浓度,链的立体异构,链的极性,连接回路的不同,糖苷的扭转角度[6]等。根据PDB的记录,目前已经有118种G-四链体结构被发现。
因此,笼统的称G-四链体为某一种构型,是不合适的[6]。
2 G-四链体与小分子配体成复合物的结构
既然G-四链体能阻断端粒酶对端粒的延长,那么能稳定G-四链体结构的小分子配体无疑会成为抗肿瘤药物的先导化合物。20世纪90年代以来,药物化学家研究发现了若干类能稳定G-四链体的化合物,这些化合物都具有平面芳香大共轭体系以及基本的取代侧链,其中一部分还带正电荷,主要通过π-π堆积作用及静电相互作用与G-四链体结合,其余的结合力还包括疏水相互作用,氢键作用等。结合的部位包括螺旋的沟区,连接回路,G-四集体中间的负电腔等[8,9]。这些化合物包括蒽醌类衍生物,阳离子卟啉类化合物(TMPyP4),苝类化合物(perylenes),溴乙啡啶衍生物,吖啶衍生物,三嗪类衍合物,小檗碱类化合物,金属离子配合物,喹啉吲哚类衍生物,二苯邻二氮杂菲衍生物,锌指蛋白,端粒抑素及其衍生物,新型非共平面的生物碱,手性超分子复合物等。
2.1经典的早期小分子配体 这类分子包括主体结构为三个连接芳香环的蒽醌类与吖啶类以及主骨架成环的卟啉类化合物,如图6。其中蒽醌类和吖啶类化合物与G-四链体的结合模式基本相当,如图5,主体结构的芳香环与末端G-四集体有π-π堆积作用,而侧链的不同基团则与G-四链体的沟区或是连接回路有相互作用,这些相互作用包括氢键作用或是静电相互作用或是兼而有之。对于蒽醌类化合物,增大共轭芳香平面有利于增强其与G-四链体的稳定性[10,11]。对于吖啶类化合物,BRACO19是研究得最多也是抑癌效果较强的一个化合物。Jarstfer课题组将BRACO19用不同类型和长度的链连接起来,得到的二聚体能在无阳离子的情况下辅助形成G-四链体,然后与其1:1稳固结合,这与BRACO19单体2:1与G-四链体结合相异,而且二聚体抑制端粒酶的效果相当甚至高于BRACO19单体[12]。最近Ferreira等将吖啶和喹啉吲哚通过氨基脯氨酸连接起来形成寡聚体,其中的喹啉吲哚能以π-π堆积作用结合在端粒序列的G-四链体上,而吖啶的存在更加强两者之间的结合力[13]。
阳离子卟啉类化合物TMPyP4与G-四链体的结合有若干种,如插入到G-四集体之间,堆积在末端G-四集体上以π-π共轭作用维系等。最新研究表明,它是通过堆积在TTA 核苷外侧的模式与G-四链体结合的[14]。Huang课题组将卟啉类化合物与蒽醌类化合物用不同长度的链连接起来得到混杂二聚体,发现用长链连接的混杂二聚体能出人意料的双插入到G-四集体中去,而短链连接的不行,并且长链连接的混杂二聚体比短链连接的更能稳定G-四链体[15]。
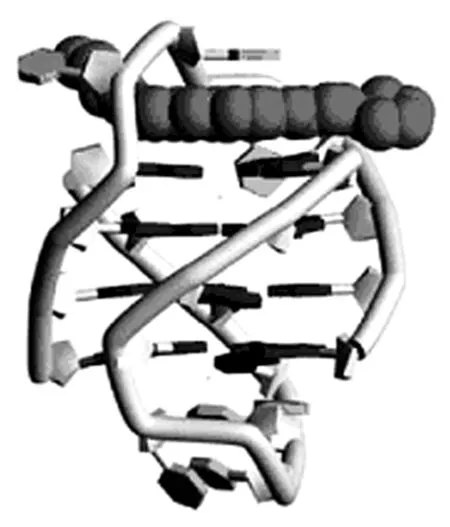
图5 二取代吖啶配体与G-四链体的复合物结构PDB ID:1L1H
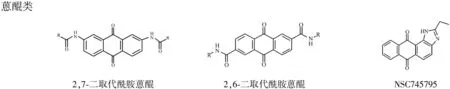
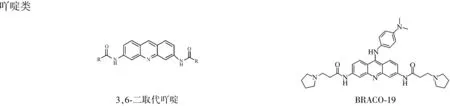
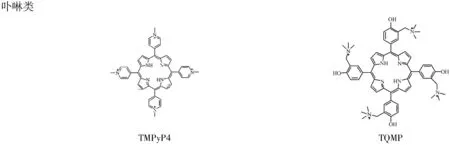
图6蒽醌类、吖啶类以及卟啉类
2.2更大芳香平面的小分子配体 这类化合物主要包括苝类化合物及coronene衍生物,见图8。它们有更大的芳香共轭平面,能与末端G-四集体产生更强的π-π共轭作用力,而不同的侧链则可与G-四链体的沟区有静电相互作用或氢键作用或两者兼而有之。其结合模式如图7。配体与G-四链体结合的化学计量比为1:1或是2:1。Franceschin课题组发现,增加侧链的正电性,会增强配体与G-四链体的结合力,但是同时也降低了对G-四链体的选择性[16]。最近,该课题组对苝类化合物进行了变换不同侧链的改造,通过引入含哌啶环的烷基侧链,此苝类衍生物的结合力大大增强,同时还能选择性地引起肿瘤细胞内端粒的损伤,而对正常细胞内的端粒无影响,这为抗肿瘤药物设计提供了一个良好的先导化合物[17]。Samudrala等发现,通过改变侧链降低配体与G-四链体的结合力,但选择性却得以增强[18]。另外,在生理环境下,侧链还会受到其中的离子及pH的影响而改变与G-四链体的选择性[19]。
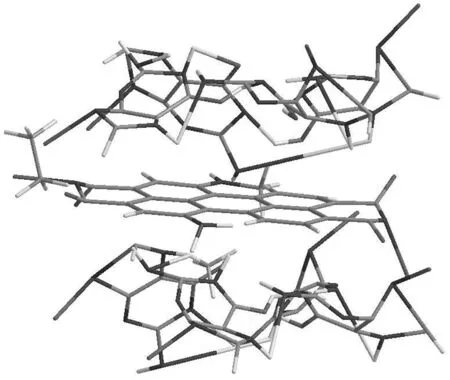
图7 苝类化合物与G-四链体的结合模式图[20]
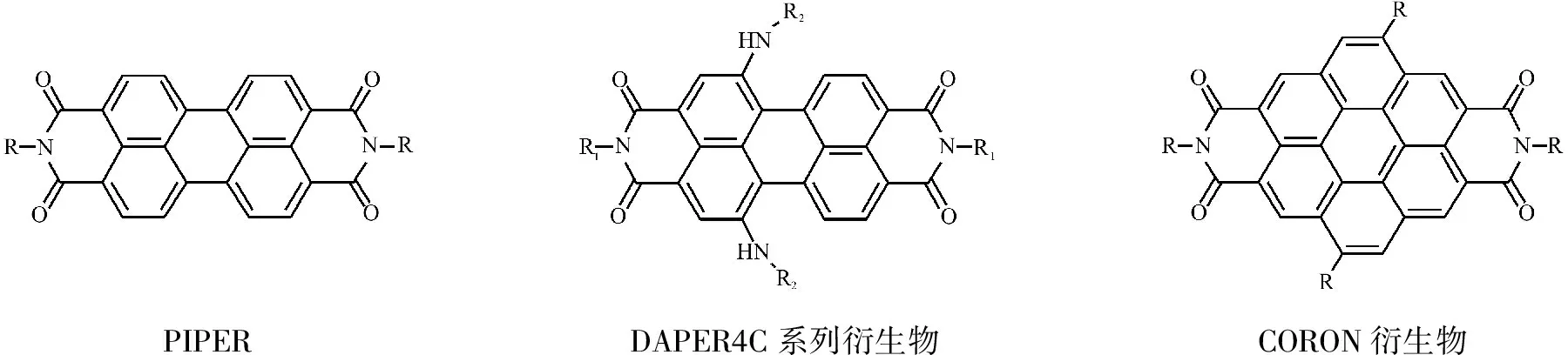
图8苝类化合物及coronene衍生物
2.3主体结构含阳离子的小分子配体 这类化合物主要包括小檗碱衍生物,大多数的喹啉吲哚类衍生物及金属离子复合物,见图9。主体结构的阳离子的作用类似G-四集体中心的阳离子,起诱导形成和稳定结合G-四链体的作用。而且当阳离子是不同种类的金属离子时,可介导对G-四链体的选择性[21]。而其余的芳香结构则与末端G-四集体产生π-π共轭堆积作用,侧链一般与G-四链体的沟区或回路结合,对G-四链体有选择结合作用。最近Huang课题组将两个喹啉母体用非芳香性的烯酮作为连接子连接起来,增大了整个分子的柔韧性,使得配体对不同结构的G-四链体具有了很高的选择性[22]。另外,该课题组还将小檗碱的母体结构的芳香环进一步扩大,运用各种生物物理及生物化学的方法,发现此类改造比9位N原子处的改造更有效,不仅结合力及选择性变强了,还发现此类衍生物能下调白血病细胞系HL60的c-myc基因表达[23]。此后,该课题组还先后发展出5位N甲基化喹啉吲哚类[24],咪唑衍生物等一系列小分子配体。金属离子复合物一般是金属离子(包括Ni (Ⅱ) ,Cu(Ⅱ) ,Fe (Ⅲ) ,Zn (Ⅱ),Pt (Ⅱ)等)与小分子配体络合,它可以与G-四链体通过插入的方式结合。目前报道得最多的是金属离子与TMPyP4所成的复合物,如Cu(Ⅱ)-TMPyP4, Ni(Ⅱ)-TMPyP4, Mn(Ⅲ)-卟啉等[25~27],其余还有Corrole类及salphen类金属络合物[28,29]。Mao等人将金属离子Ru与不同的小分子配体络合起来,形成一个大平面的螯合物,运用DNA融解和圆二色谱等实验方法,确定了此类螯合物与G-四链体结合的计量比是1:1,而且结合上去以后,即便是在高浓度的K+溶液中也很稳定[30]。
2.4主体结构成环的小分子配体 这类化合物主要包括端粒抑素及其衍生物,噁唑大环类化合物等,见图10。此类分子的设计原理来自端粒抑素。作为一种天然产物,端粒抑素分离自treptomyces anulatus 3533-SV4,具有良好的抑制端粒酶的活性[31]。它不仅能稳定结合G-四链体,而且能在没有金属离子的情况下诱导形成G-四链体,对分子内G-四链体结构的选择性是 B-DNA的70倍,并且选择性高于分子间的G-四链体结构。鉴于此,人们合成了一系列端粒抑素的衍生物,在环的连接子上延伸出侧链,以期进一步增强对G-四链体的结合力和选择性。Pilch等对合成出的端粒抑素衍生物HXDV和HXLV-AC进行研究发现,它们与G-四链体的结合主要还是π-π共轭作用,2分子配体分别结合在1分子G-四链体的2个末端G-四集体上[32]。另外,据文献记载,HXDV与G-四链体的结合与中间环合空腔有很大的关系[33]。推测可能原因是由于主体结构成环,这与G-四集体中间形成的负电腔有类似的结构效应,从而与G-四集体中心的金属离子产生静电相互作用而进一步与G-四链体稳定结合。Maiti课题组将呋喃环作为成环的基本单元,合成出三个呋喃环以类酰胺键连接起来的环状结构,通过对呋喃环上的取代基进行变换,得到的小分子配体能诱导c-MYC的G-四链体的形成,同时稳定G-四链体的结构,并达到下调70%转录的效果[34]。Rzuczek等人将基本组成单元噁唑环之间插入吡啶环得到的24元大环化合物MPP,能极好的稳定编码细胞周期的蛋白质激酶Aurora A的mRNA的G-四链体。进一步药理实验发现此配体还具有显著的体内抗乳腺癌活性[35],这值得药物化学家对其进行更深的构效关系研究。
图9各种主体结构含阳离子的小分子配体
图10主体结构成环的小分子配体
2.5其它 这类化合物包括噁嗪类,联萘衍生物及一些非平面的小分子配体。作为与前四大类不同的化合物,它们引起了人们极大的关注。McLuckie等运用基于细胞的报告基因序列法设计合成了一类苯并吩噁嗪类小分子配体,能通过与G-四链体的结合降低人胃癌细胞系c-KIT的表达[36]。Li等运用基于药效团的虚拟筛选发现了能诱导形成G-四链体和能稳定结合G-四链体的非平面的小分子配体[37],如图11。运用圆二色谱和NMR等方法,发现贝母碱和去氢贝母碱是结合在平行G-四链体的侧沟,配体与G-四链体的化学计量比为2:1。同时还发现此类配体能诱导形成G-四链体。由此可见,平面的芳香结构并不是必须的,这将为基于G-四链体的抗肿瘤药物的合理设计提供一个新的突破口。
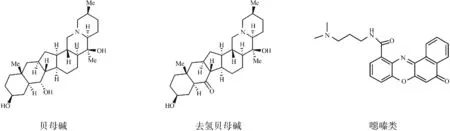
图11贝母碱,去氢贝母碱及噁嗪类的化学结构
3 结语
本文讨论了G-四链体的结构及G-四链体与小分子配体成复合物的结构研究中的最新进展,对G-四链体与小分子配体的结合模式有了更清晰的认识。基于此,人们可以对已发现的化合物进行结构修饰甚至发现新型的能与G-四链体稳定结合的先导化合物。
然而,由于G-四链体结构的多样性及构型的易变性,致使小分子配体的作用靶点难以明确。另外,小分子配体对G-四链体结构的选择性不强及毒性太大的缺点也限制了它向先导药物的发展。目前,仅化合物CX-3543[38]和寡聚核苷酸AS1411[39]进入了临床研究。怎样克服上述缺点呢?科研工作者发现,由于小分子配体对G-四链体的选择性主要体现在G-四链体的沟区和连接回路,因此,通过改变小分子配体的侧链可以达到提高选择性的目的。鉴于G-四链体的生物功能被解析得越来越明确,开发更高效、低毒及选择性高的抗肿瘤小分子配体势在必行。
[1] Jenkins TC. Targeting multi-stranded DNA structures[J]. Curr Med Chem, 2000, 7(1): 99.
[2] Mata JE, Joshi SS, Palen B,etal. A hexameric phosphor Othioate oligonucleotide telomerase inhibitor arrests growth of burkitt′s lymphoma cellsin vitroandin vivo[J]. Toxicol Appl Pharm, 1997, 144(1): 189.
[3] Engelhart AE, Plavec J, Persil O,etal. Metal ion interactions with G-quadruplex structures[A]. In: Edited by Hud NV. Nucleic acid-metal ion interactions[M]. Cambridge, UK:RSC Publishing, 2008: 118.
[4] Huppert JL, Balasubramanian S. Prevalence of quadruplexes in the human genome[J]. Nucleic Acids Research, 2005, 33(9): 2908.
[5] Kong DM, Wu J, Wang N,etal. Peroxidase activity-structure relationship of the intermolecular four-stranded G-quadruplex-hemin complexes and their application in Hg2+ion detection[J]. Talanta, 2009, 80(2): 459.
[6] Neidle S. The structures of quadruplex nucleic acids and their drug Complexes[J]. Current Opinion in Structural Biology, 2009, 19(3): 239.
[7] Dai J, Carver M, Yang D. Polymorphism of human telomeric quadruplex structures[J]. Biochimie, 2008, 90(8): 1172.
[8] Schouten JA, Ladame S, Mason SJ,etal. G-quadruplex-specific peptide-hemicyanine ligands by partial combinatorial selection[J]. J Am Chem Soc, 2003, 125(19): 5594.
[9] Haider SM, Parkinson GN, Neidle S. Structure of a G-quadruplex-ligand complex[J]. J Mol Biol, 2003, 326(1): 117.
[10] Zagotto G, Sissi C, Moro S,etal. Amide bond direction modulates G-quadruplex recognition and telomerase inhibition by 2,6 and 2,7 bis-substituted anthracenedione derivatives[J]. Bioorg Med Chem, 2008, 16(1): 354.
[11] Huang HS, Chen TC, Chen RH,etal. Synthesis, cytotoxicity and human telomerase inhibition activities of a series of 1,2-heteroannelated anthraquinones and anthra[1,2-d]imidazole-6,11-dione homologues[J]. Bioorg Med Chem, 2009, 17(21): 7418.
[12] Fu YT, Keppler BR, Soares J,etal. BRACO19 analog dimers with improved inhibition of telomerase and hPot 1[J]. Bioorg Med Chem, 2009, 17(5): 2030.
[13] Ferreira R, Artali R, Farrera-Sinfreu J,etal. Acridine and quindoline oligomers linked through a 4-aminoproline backbone prefer G-quadruplex structures[J]. Biochim Biophys Acta, 2011, 1810(8): 769.
[14] Parkinson GN, Gosh R, Neidle S. Structural basis for binding of porphyrin to human telomeres[J]. Biochemistry, 2007, 46(9): 2390.
[15] Zhao P, Xu LC, Huang JW,etal. Cationic porphyrin-anthraquinone dyads: Modes of interaction with G-quadruplex DNA[J]. Dyes and Pigments, 2009, 83(1): 81.
[16] Franceschin M, Pascucci E, Alvino A,etal. New highly hydrosoluble and not self-aggregated perylene derivatives with three and four polar side-chains as G-quadruplex telomere targeting agents and telomerase inhibitors[J]. Bioorg Med Chem Lett, 2007, 17(9): 2515.
[17] Casagrande V, Salvati E, Alvino A,etal. N-Cyclic bay-substituted perylene G-quadruplex ligands have selective antiproliferative effects on cancer cells and induce telomere damage[J]. J Med Chem, 2011, 54(5): 1140.
[18] Samudrala R, Zhang X, Wadkins RM,etal. Synthesis of a non-cationic, water-soluble perylenetetracarboxylic diimide and its interactions with G-quadruplex-forming DNA[J]. Bioorgan Med Chem, 2007, 15(1): 186.
[19] Tuntiwechapikul W, Taka T, Béthencourt M,etal. The influence of pH on the G-quadruplex binding selectivity of perylene derivatives[J]. Bioorg Med Chem Lett, 2006, 16(15): 4120.
[20] Casagrande V, Alvino A, Bianco A,etal. Study of binding affinity and selectivity of perylene and coronene derivatives towards duplex and quadruplex DNA by ESI-MS[J]. J Mass Spectrom, 2009, 44(4): 530.
[21] Monchaud D, Yang P, Lacroix L,etal. A metal-mediated conformational switch controls G-quadruplex binding affinity[J]. Angew Chem Int Ed, 2008, 47(6): 4858.
[22] Peng D, Tan JH, Chen SB,etal. Bisaryldiketene derivatives: A new class of selective ligands for c-myc G-quadruplex DNA[J]. Bioorgan Med Chem, 2010, 18(23): 8235.
[23] Ma Y, Ou TM, Tan JH,etal. Quinolino-benzo-[5, 6]-dihydroisoquindolium compounds derived from berberine: A new class of highly selective ligands for G-quadruplex DNA in c-myc oncogene[J]. European Journal of Medicinal Chemistry, 2011, 46(5): 1906.
[24] Xu W, Tan JH, Chen SB,etal. Studies on the binding of 5-N-methylated quindoline derivative to human telomeric G-quadruplex[J]. Biochemical and Biophysical Research Communications, 2011, 406(3): 454.
[25] Evans SE, Mendez MA, Turner KB,etal. End-stacking of copper cationic porphyrins on parallel-stranded guanine quadruplexes[J]. J Biol Inorg Chem, 2007, 12(8): 1235.
[26] Maraval A, Franco S, Vialas C,etal. Porphyrin-aminoquinoline conjugates as telomerase inhibitors[J]. Org Biomol Chem, 2003, 1(6): 921.
[27] Dixon IM, Lopez F, Estève JP,etal. Porphyrin derivatives for telomere binding and telomerase inhibition[J]. Chem Bio Chem, 2005, 6(1): 123.
[28] Dixon IM, Lopez F, Tejera AM,etal. A G-quadruplex ligand with 10 000-fold selectivity over duplex DNA[J]. J Am Chem Soc, 2007, 129(6): 1502.
[29] Fu B, Zhang D, Weng X,etal. Cationic Metal-Corrole Complexes: Design, Synthesis, and Properties of Guanine-Quadruplex Stabilizers[J]. Chem Eur J, 2008, 14(30): 9431.
[30] Sun J, An Y, Zhang L,etal. Studies on synthesis, characterization, and G-quadruplex binding of Ru(II) complexes containing two dppz ligands[J]. Journal of Inorganic Biochemistry, 2011, 105(2): 149.
[31] Shin-ya K, Wierzba K, Matsuo K,etal. Telomestatin, a novel telomerase inhibitor from Streptomyces anulatus[J]. J Am Chem Soc, 2001, 123(6): 1262.
[32] Pilch DS, Barbieri CM, Rzuczek SG,etal. Targeting human telomeric G-quadruplex DNA with oxazole-containing macrocyclic compounds[J]. Biochimie, 2008, 90(8): 1233.
[33] Tera M, Sohtome Y, Ishizuka H,etal. Design and synthesis of telomestatin derivatives and their inhibitory activity of telomerase[J]. Heterocycles, 2006, 69: 505.
[34] Agarwal T, Roy S, Chakraborty TK,etal. Furan based cyclic homo-oligopeptides bind G-quadruplex selectively and repress c-MYC transcription[J]. Bioorganic & Medicinal Chemistry Letters, 2010, 20(15): 4346.
[35] Suzanne G, Rzuczek, Daniel S,etal. Macrocyclic Pyridyl Polyoxazoles: Selective RNA and DNA G-quadruplex ligands as antitumor agents[J]. J Med Chem, 2010, 53(9): 3632.
[36] McLuckie KI, Waller ZA, Sanders DA,etal. G-quadruplex-binding benzo[a] phenoxazines down-regulate c-KIT expression in human gastric carcinoma cells[J]. J Am Chem Soc,2011, 133(8): 2658.
[37] Li Q, Xiang J, Li X,etal. Stabilizing parallel G-quadruplex DNA by a new class of ligands: Two non-planar alkaloids through interaction in lateral grooves[J]. Biochimie, 2009, 91(7):811.
[38] Papadopoulos K, Mita A, Ricart A,etal. Pharmacokinetic findings from the phase I study of Quarfloxin (CX-3543): a protein-rDNA quadruplex inhibitor, in patients with advanced solid tumors[J]. Mol Cancer Ther, 2007, 6: 3462.
[39] Laber DA, Taft BS, Kloecker GH. Pharmacokinetics of the anti-nucleolin aptamer AS1411 in a phase I study[J]. Mol Cancer Ther, 2007, 6: 3574.
ProgressonstructuresandbindingstructureswithsmallmoleculesofG-quadruplex
JIANG Zhi-hui, ZHANG Da-zhi
(Department of Organic Chemistry, School of Pharmacy, Second Military Medical University, Shanghai 200433, China)
There was a research focus for the prevention of diseases by way of binding to DNA using small molecules. The discovery of structures of G-quadruplex and its function related to cancer through modern molecular biology techniques provided a big chance for the design of anti-cancer drug. This article aimed to present recent advances for the structures of G-quadruplex and these small binding molecules, which would contribute to understand these binding modes and thus provide a steady support in the rational design of anti-cancer drug.
G-quadruplex; small molecule; binding structure
国家自然科学基金资助课题(30672533), 军队十一五科技课题(06H013).
姜志辉(1985-),男,博士研究生, Tel: 13701896816, E-mail:jandsphy@163.com.
张大志.Tel: (021)81871226,E-mail:zhangdzh@hotmail.com.
R914
A
1006-0111(2012)04-0241-07
10.3969/j.issn.1006-0111.2012.04.001
2011-01-30
2011-05-25

