IPaH-1基因在志贺氏菌表达的检测及PCR条件的优化
罗雁非,丁 旭,文 雪,张晓静,李洪军,何成彦,赵丽纯*
(1.吉林出入境检验检疫局,吉林 长春130021;2.吉林大学药学院,吉林 长春130021:3.吉林大学中日联谊医院,吉林 长春130033)
志贺氏菌(Shigella)又称痢疾杆菌,是一类以引起腹泻症状为主的常见致病菌,据 WHO报道,世界上每年有1.65亿感染志贺氏菌,年死亡人数达110万,99%发病人数在发展中国家,尤其是卫生条件差的地区,以5岁以下的儿童为主[1]。多种致病菌导致的肠道传染病严重威胁着人类健康。致病菌的实验室金标准鉴定手段仍然是培养、血清学和生化等传统的细菌学检测方法,步骤相对繁琐,一般需要数天才能得到结果,给检验带来不便。因此建立快速、准确、灵敏的致病菌检测方法对此类传染病的早期判定至关重要。近年来,PCR和核酸杂交技术的应用,促进了细菌检测技术的发展[2]。侵袭性质粒抗原H基因(invasion plasmid antigen H,ipaH,IPaH)是同时存在于痢疾杆菌染色体和侵袭性大质粒上的侵袭基因。通过分子生物学方法检测IPaH基因,可以快速检测腹泻患者粪中的痢疾杆菌,且在发病率评估上比细菌培养法灵敏准确[3-5]。但目前未见通过PCR法全面系统检测IPaH1基因在鲍氏志贺氏菌、野生志贺氏菌、大肠埃希氏菌、出血性大肠埃希氏菌(O157:H7)、肠炎沙门氏菌、阪崎肠杆菌、普通变形杆菌、蜡样芽孢杆菌、粪肠球菌、金黄色葡萄球菌、单增生李斯特菌、副溶血性弧菌、产气荚膜梭菌等常见致病菌中的表达的报道。因此本研究检测了IPaH1基因在志贺氏菌等几种常见肠道致病菌中的表达,以确定IPaH1基因在志贺氏菌表达的特异性,为进一步进行ipaH1基因液态芯片的研究奠定实验基础。
1 材料与方法
1.1 菌种及来源
实验所用标准菌株及其来源见表1。

表1 菌种及来源
标准株均采购于北京中原公司,分离株来自吉林出入境检验检疫局微生物实验室。
1.2 主要试剂和仪器
LB培养基、胰酪胨大豆酵母浸膏肉汤培养基(TSB-YE)、氯化钠蔗糖培养基、氯化钠结晶紫增菌液、亚硫酸盐-多粘菌素-磺胺嘧啶琼脂(SPS)(液体硫乙醇酸钠等购自北京陆桥技术有限责任公司、Wizard○RGenomic DNA Purification Kit 试 剂 盒(Promega)、2×Easy Taq PCR SuperMix、琼脂糖、100bp DNA Ladder Marker(大连宝生物)、DL2000 DNA Ladd er Marker(大连宝生物)等。
恒温培养箱(德国Binder)、水浴箱(美国Shellab)、PCR仪(美国 ABI)、电泳仪(PS500A)、Alphalmager EC紫外凝胶成像分析系统(美国Alpha)等。
1.3 引物
根据GenBank上IPaH-1基因序列,用Primer Premier 5.0软件设计2对引物,以16srRNA作为内参基因。由上海捷瑞生物工程公司合成,序列如表2。

表2 引物序列
1.4 菌株的培养
鲍氏志贺氏菌、野生志贺氏菌、大肠埃希氏菌、出血性大肠埃希氏菌(O157:H7)、肠炎沙门氏菌、阪崎肠杆菌、普通变形杆菌、蜡样芽孢杆菌用LA平板,粪肠球菌、金黄色葡萄球菌、单增生李斯特菌用TSA平板,37℃温箱过夜培养,然后挑取单菌落接种到相应的液体培养基,37℃水浴振荡培养过夜;副溶血性弧菌用氯化钠蔗糖平板37℃温箱过夜培养后挑取单菌落接种到氯化钠结晶紫增菌液,37℃水浴振荡培养过夜;产气荚膜梭菌用SPS平板37℃厌氧培养24-48h,然后挑取黑色单菌落于液体硫乙醇酸钠中37℃过夜培养。
1.5 细菌基因组DNA的提取
按照 Promega Wizard?Genomic DNA Purification Kit试剂盒使用说明操作,简述如下:取1ml过夜培养物至1.5ml离心管中;13,000r/mim 离心2min收集菌体;加入600μl核裂解液重悬菌体;80℃ 孵育5min裂解细胞,冷却至室温;加入3μl RNA酶溶液,颠倒5次;37℃孵育35min,冷却至室温;加入200μl蛋白沉淀液,剧烈振荡20s,冰上孵育5min;13,000r/mim离心3min;移上清至一离心管中,加入600μl异丙醇;轻轻颠倒混匀;13,000 r/mim离心2min;弃上清;加入600μl 70%乙醇,轻柔颠倒离心管数次;13,000r/mim 离心2min。小心吸去乙醇,将离心管倒置在干净的吸水纸上,自然干燥15min;加入100μl DNA溶解液,4℃ 孵育过夜后,-20℃保存备用。
1.6 PCR扩增目的基因
PCR反应体系(25μl):2×Easy Taq PCR SuperMix 12.5μl;上、下游引物(10μM)各0.5μl;基因组DNA 模板1ng/μl 1μl;无菌水定容至25μl。循环参数:95℃ 2min;94℃ 45sec、52℃ 30sec、72℃30sec,30个循环;72℃ 延伸5min。
1.7 PCR反应条件优化
1.7.1 退火温度优化:PCR体系中各成分浓度不变,反应程序,退火温度依次为49.0℃,50.0℃,51.0℃,52.0℃,53.0℃,54.0℃,55.0℃,56.0℃,57.0℃,58.0℃,59.0℃。
1.7.2 引物浓度优化:PCR反应体系为25μL,反应程序不变,其他成分浓度不变,引物终浓度依次为0.02μM、0.1μM、0.2μM、0.3μM、0.4μM。
2 实验结果
2.1 IPaH1在几种肠道致病菌的表达
以鲍氏志贺氏菌、野生志贺氏菌、大肠埃希菌、出血性大肠埃希氏菌(O157:H7)、肠炎沙门氏菌、阪崎肠杆菌、普通变形杆菌、蜡样芽孢杆菌、粪肠球菌、金黄色葡萄球菌、单核细胞增生李斯特菌、副溶血性弧菌、产气荚膜梭菌等基因组DNA为模板进行PCR,结果可见IPaH1-1、IPaH1-2两对引物均在志贺氏菌扩增出较高表达水平的目的条带,片段长度与预期一致,其他11种菌均为阴性,见图1A、B。

A:引物为IPaH1-1;B:引物为IPaH1-2;M:DL 2000Marker;1-14的模板依次为:志贺氏菌ATCC 9207,志贺氏菌JL 08036,大肠埃希菌,出血性大肠埃希氏菌(O157:H7),肠炎沙门氏菌,阪崎肠杆菌,普通变形杆菌,蜡样芽孢杆菌,粪肠球菌,金黄色葡萄球菌,单核细胞增生李斯特菌,副溶血性弧菌,产气荚膜梭菌,空白对照
2.2 PCR反应条件优化
以鲍氏志贺氏菌基因组DNA为模板,对退火温度、引物浓度及模板浓度等PCR反应条件进行了优化。
2.2.1 退火温度的优化
结果显示,引物IPaH1-1在55.0℃-59.0℃退火温度下,扩增产物条带均很清晰,表明该反应体系的最佳退火温度在55.0℃-59.0℃之间;引物IPaH1-2在51.0℃-55.0℃条带均很清晰,说明该反应体系的最佳退火温度在51.0℃-55.0℃之间;如图2、3所示。以下实验反应中以56℃为引物IPaH1-1的退火温度,以52℃为引物IPaH1-2的退火温度。
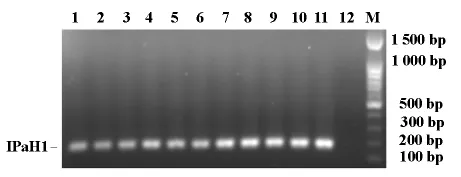
图2 退火温度对IPaH1基因扩增的影响引物(引物为IPaH1-1)
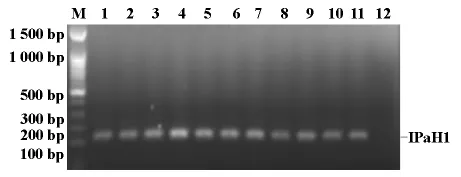
图3 退火温度对IPaH1基因扩增的影响引物(引物为IPaH1-2)
2.2.2 引物浓度的优化
结果显示,引物IPaH1-1、IPaH1-2终浓度为0.1μM时扩增条带已经很清晰,图4。
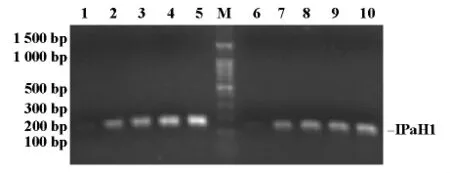
图4 引物浓度对IPaH1基因扩增的影响
3 讨论
志贺氏菌引起肠道传染病发病率位居法定传染病之首,严重危害人们的身体健康,因此建立比传统检测方法更快速、准确、实用的检测方法尤为重要[6]。近年来,建立了一些新的检测方法,如PCR检测技术和基因芯片技术等分子生物学检测技术。这些检测技术在很大程度上依赖于PCR扩增,特别是多重PCR,对于引物的要求更高。我们设计引物时,根据志贺氏菌毒力基因表达产物侵袭性质粒抗原 H基因(ipaH)、侵袭相关基因(ial)、志贺菌肠毒素1基因(ShET-1)和志贺菌肠毒素2基因(ShET-2)[7,8]。但志贺氏菌同许多病原菌一样都存在毒力相关基因也称毒力岛[9],这对志贺氏菌特异性引物的设计增加了难度。
1987年Buysse等[10]发现IPaH以多拷贝同时存在于各型志贺氏菌染色体和侵袭性大质粒上,不随传代而丢失。以IPaH设计引物建立PCR检测方法具有较高敏感性并可避免因基因突变、质粒丢失而导致的假阴性。已有研究以IPaH基因扩增为基础进行了IPaH4.5的功能研究[11]。本文根据引物设计原则和相关信息设计了包括管家基因在内的七对引物(未全部列出),从中筛选出符合分子生物学检测志贺氏菌IPaH1基因表达,具较高特异性的两对引物,在大肠埃希氏菌、出血性大肠埃希氏菌(O157:H7)、肠炎沙门氏菌、阪崎肠杆菌、普通变形杆菌、蜡样芽孢杆菌、粪肠球菌、金黄色葡萄球菌、单增生李斯特菌、副溶血性弧菌、产气荚膜梭菌未见表达;并从退火温度、引物浓度方面对PCR反应条件进行了优化,两对引物理想终浓度均为0.1μM,最适退火温度分别为55.0℃-59.0℃、51.0℃-55.0℃。本研究结果为进一步建立IPaH1基因液态芯片检测系统奠定了实验基础。
[1]Golovliov I,Sjstedt A,Mokrievich A,Pavlov V.A method for allelic replacement in Francisella tularensis [J].FEMS Microbiol Lett,2003,222(2):273.
[2]邵 晖,吴玲玲,王 伟,等.食品中病原微生物检测方法进展及优缺点评价[J].中国食品工业,2008,23(4):40.
[3]李小丽,阴赪宏,温 艳,等.PCR快速检测腹泻患者粪中痢疾杆菌致病基因ipaH和iaI[J].世界华人消化杂志,2007,15(19):2128.
[4]李智琼,邓尚廉,孙承谋.用检测ipaH基因的PCR检测志贺菌属[J].临床检验杂志,2009,27(3):185.
[5]王松梅,郝志勇,马景臣,等.PCR检测与细菌培养方法在细菌性痢疾监测中的应用比较[J].复旦学报(医学版),2006,33(6):766.
[6]赵丽华,周 勇,万成松.分子信标PCR检测志贺菌ipaH基因[J].热带医学杂志,2006,6(5):499.
[7]Fasano A,Noriega FR,Maneval DR Jr,et al.Shigella enterotoxin 1:an enterotoxin of Shigella flexneri 2aactive in rabbit small intestine in vivo and in vitro[J].J Clin Invest,1995,95(6):2853.
[8]Venkatesan MM,JM Buysee,DJ Kopecko,et al.Use of Shigella flexneri ipaC and ipaH gene sequences for the general identification of Shigella spp.and enteroinvasive Escherichia coli[J].J Clin Microbiol,1989,27(12):2687.
[9]龙北国,江丽芳.高级医学微生物学[M].北京:人民卫生出版社,2003.10.
[10]Buysse J M,Stover CK,Oaks EV,et al.Molecular cloning of invasion plasmid antigen(ipa)genes from Shigella flexneri analysis of ipagene products and genetic mapping[J].J Bacteriol,1987,169(6):2561.
[11]王 芳,马红芳,何 湘,等.福氏志贺菌Ⅲ型分泌系统效应子IpaH4.5功能的初步研究[J].军事医学科学院院刊,2009,33(2):120.

