一株产凝乳酶解淀粉芽孢杆菌的筛选、鉴定及酶学性质
张卫兵,甘伯中,*,梁 琪,米 兰,张 炎
(1.甘肃农业大学食品科学与工程学院,甘肃兰州730070;2.甘肃省功能乳品工程实验室,甘肃兰州730070;3.甘肃省干酪素工程技术研究中心,甘肃兰州730000)
一株产凝乳酶解淀粉芽孢杆菌的筛选、鉴定及酶学性质
张卫兵1,2,3,甘伯中1,2,3,*,梁 琪1,2,3,米 兰1,2,3,张 炎1,2,3
(1.甘肃农业大学食品科学与工程学院,甘肃兰州730070;2.甘肃省功能乳品工程实验室,甘肃兰州730070;3.甘肃省干酪素工程技术研究中心,甘肃兰州730000)
采用酪蛋白培养基,从甘南牦牛放牧区分离筛选产凝乳酶细菌。通过形态学、生理生化特征和16S rDNA序列同源分析对菌株进行鉴定,并对该菌株所产凝乳酶的特性进行了研究。从牧区采集的56个样品中共筛选得到6株产凝乳酶细菌,复筛得到一株凝乳活力高、蛋白水解力低的菌株GN4.1,经鉴定为解淀粉芽孢杆菌(Bacillus amyloliquefaciens),在麸皮培养基中发酵48h,凝乳活力可达1011.56SU/mL,蛋白水解力为14.61U/mL。凝乳酶的最适作用温度为60℃,65℃加热10min后凝乳活力丧失;最适作用pH为5.5,在pH3.5~8.5内稳定性较好。预期该菌株所产凝乳酶有用于乳品加工业的潜力。
解淀粉芽孢杆菌,凝乳酶,酶学性质
凝乳酶(EC4.4.1.4)是酶法干酪和酶法干酪素生产中的关键性酶,又称天冬氨酸蛋白酶,其主要的生物学功能是切断κ-酪蛋白的Phe 105-Met 106肽键,导致牛奶凝结[1]。凝乳酶来源广泛,主要有动物源凝乳酶、植物源凝乳酶以及微生物源凝乳酶。动物源凝乳酶是干酪生产过程中使用最多的凝乳酶,但随着世界干酪产量逐年上升,每年屠宰大量的犊牛已经无法满足工业生产干酪的需求;植物源凝乳酶蛋白水解活力太强,且受时间、地点等因素限制[2-3];由于微生物生长不受地域和气候的影响,发酵容易控制,且来源广泛,价格便宜,微生物源凝乳酶最有可能成为小牛凝乳酶替代品。国内外已进行了大量关于凝乳酶的研究,到目前为止研究发现产凝乳酶的微生物主要包括链霉菌属(Streptomyces)、小单胞菌属(Micromonospora)、马杜拉放线菌属(Actinomadura)、根霉(Rhizopus)、微小毛霉(Mucor pusillus)、总状毛霉(Mucor racemosu)、易脆毛霉(Mucorfuagilis)、米黑毛霉(Mucornichei)、寄生内座壳菌(Endothiaparasitisa)、粟疫菌(Endothia parasitica)等,不同来源的凝乳酶酶学性质差异很大[4-6]。利用高效优良的产凝乳酶微生物,通过发酵法生产凝乳酶是目前最有前途的发展方向。国内外关于产凝乳酶真菌和放线菌的报道很多,但关于产凝乳酶细菌的报道仅有枯草芽孢杆菌(Bacillus subtilis)和地衣芽孢杆菌(Bacillus licheniformis),由于凝乳活力不高而不能达到发酵生产的要求[7-10]。因此,筛选高效优良的产凝乳酶细菌,发挥细菌体积小、繁殖快、产物易于提取分离的优点,对微生物凝乳酶的研发和应用十分必要。本研究拟从甘肃甘南牦牛牧区采集的土壤样品中分离筛选产凝乳酶细菌,根据形态学、生理生化特征和16S rDNA同源性分析对菌株进行鉴定,并对其凝乳活力、蛋白水解活力和酶学性质进行研究,以期为细菌凝乳酶开发和利用奠定基础。
1 材料与方法
1.1 实验材料
样品 甘肃甘南合作市、夏河县、碌曲县和玛曲县等地牧区牧场、牛舍、饮水区和挤奶区的土壤样品56个,土壤采样时用无菌刮铲采集离地面10cm左右的土样,放在玻璃瓶中于4℃保存备用;培养基 牛肉膏蛋白胨固体和液体培养基参照文献[11]配制;酪蛋白液体培养基 蛋白胨0.25%,葡萄糖1%,酵母膏0.1%,干酪素1.0%,脱脂牛乳5%,pH7.0;酪蛋白固体培养基 酪蛋白液体培养基中加入2%的琼脂;麸皮培养基 将10g麸皮加入100mL自来水,煮沸10min,过滤后用自来水补足100mL,pH自然。
1.2 实验方法
1.2.1 菌种初筛 称1g样品,进行梯度稀释后吸取1mL涂布于酪蛋白培养基平板上,37℃下培养48h,选择沉淀圈与水解圈比值大的单菌落,在牛肉膏蛋白胨平板进一步划线分离,分纯后编号接入斜面种子培养基,以备复筛和鉴定。
1.2.2 菌种复筛 将初筛所得菌种分别接种于麸皮培养基、牛肉膏蛋白胨液体培养基和酪蛋白液体培养基中,37℃,140r/min摇床培养48h后,取发酵液测定凝乳酶和蛋白水解活力。
1.2.3 菌株的鉴定
1.2.3.1 形态学特征 牛肉膏蛋白胨培养基平板37℃恒温培养24h,观察菌落形态。将菌体进行芽孢染色,革兰氏染色后于高倍显微镜下观察菌体形态。1.2.3.2 生理生化特征测定 参考《常见细菌系统鉴定手册》[12]和《微生物学实验》[13]测定菌株的生理生化特征。
1.2.3.3 16S rDNA序列测定及系统发育分析 将菌体于10μL灭菌水中99℃变性10min,离心取上清液作为模板,采用通用引物。
上游:5’-ATGGATCCGAGAGTTTGATCCTGGCT CAG-3’。
下游:5’-TATCTGCAGTGGTGTGACGGGCGGTG
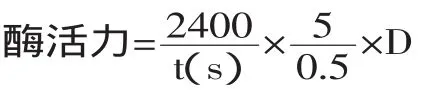
其中:t为凝乳时间,D为稀释倍数。
1.2.4.2 蛋白水解力测定 将发酵液于4000r/min,4℃下离心10min,取上清液测定其蛋白分解活力。取15×100mm试管3支,编号1、2、3,每管内加入粗酶液1mL,置于40℃水浴中预热2min,再各加入经同样预热的酪蛋白1mL,精确保温10min。时间到后,立即再各加入0.4mol/L三氯乙酸2mL,以终止反应。继续置于水浴中保温20min,使残余蛋白质沉淀后过滤。然后另取15×150mm试管3支,编号1、2、3,每管内加入滤液1mL,再加0.4mol/L碳酸钠5mL,已稀释的福林试剂1mL,摇匀后40℃保温发色20min后进行光密度(OD660)测定。空白实验也取试管3支,编号1、2、3,测定方法同上,在加酪蛋白之前先加0.4mol/L三氯乙酸2mL,使酶失活,再加入酪蛋白。T-3’。

使用16S rDNA Bacterial Identification PCR仪,进行PCR扩增目的片段。反应体系共50μL,94℃预变性5min,94℃变性1min,55℃退火1min,72℃延伸1.5min,30个循环,72℃保温5min。取5μL进行1%琼脂糖凝胶电泳,然后切胶回收目的片断进行DNA测序。测序由大连宝生物公司完成,将测定的16S rDNA序列在NCBI使用Blast与GenBank中核酸序列数据库进行比对分析,从GenBank数据库中获得与菌株16S rDNA同源的公认标准序列数据,使用ClustalX 1.8对齐后利用软件MEGA4.0构建系统发育树。
1.2.4 酶活力的测定
1.2.4.1 凝乳酶活力测定 采用Arima方法[6]。将发酵液在4000r/min,4℃下离心10min,取上清液测定凝乳酶活力。取5mL 100g/L的脱脂乳,在35℃下保温5min,加入0.5mL粗酶液,迅速混合均匀,准确记录从加入酶液到乳凝固的时间(s)。把40min凝固1mL 100g/L脱脂乳的酶量定义为一个索氏单位(SU)。
式中:K为每度OD660所相当的酪氨酸量,4为4mL反应液取出1mL测定(即4倍),T为反应时间10min。
1.2.5 生长曲线和产酶曲线
1.2.5.1 生长曲线 将菌种接入麸皮培养基中培养,接种量为3%,37℃振荡培养,分别在培养0、2、4、6、8、10、12、14、16、18、20、22h测定菌体OD600值,绘制生长曲线。
1.2.5.2 产酶曲线 将菌种接入麸皮培养基中培养,接种量为3%,振荡培养37℃,分别在培养0、6、12、18、24、30、36、42、48、54、60h测定发酵液的凝乳酶活力和蛋白水解力,并绘制产酶曲线。
1.2.6 酶学性质的研究
1.2.6.1 酶的最适作用温度 分别在25、30、35、40、45、50、55、60、65、70、75℃下测定发酵液的凝乳活力,以最高酶活为对照,记为100%。
1.2.6.2 酶的热稳定性 分别在35、45、55、65℃下保温10、20、30、40、50、60min,冷却后在35℃测定发酵液的剩余凝乳活力,以最高酶活为对照,记为100%。
1.2.6.3 酶的最适作用pH 用0.1mol/L HCl和0.1mol/L NaOH将100g/L的脱脂乳调节到不同pH,在酶最适宜的凝乳温度下测定发酵液的凝乳活力,以最高酶活为对照,记为100%。
1.2.6.4 酶的pH稳定性 用0.1mol/L盐酸和0.1mol/L氢氧化钠将酶液调节到不同pH,在室温下放置24h,再将酶液调回到最适pH,在酶最适温度下测定发酵液的凝乳活力,以最高酶活为对照,记为100%。
2 结果与分析
2.1 菌种筛选
将样品梯度稀释后涂布于酪蛋白平板培养基上,由于菌株产生凝乳酶作用于培养基中的酪蛋白而产生白色沉淀圈。一般情况下,沉淀圈越大越厚说明菌株产凝乳酶活力越高,蛋白活力高的菌株则会分解培养基中酪蛋白而产生透明圈。经过初筛,从56个样品中共分离得到6个产生沉淀圈的菌株,其菌落、沉淀圈和透明圈形态见图1。将这些菌株分别在三种发酵培养基中培养48h,凝乳酶和蛋白水解活力的测定结果如表1所示。

图1 不同菌株在酪蛋白平板的菌落形态Fig.1 Colony morphology of different strains on the solid casein medium

表1 不同菌株在不同培养基中的产酶活力Table 1 Enzyme activities of different strains in different fermentation medium
由表1可以看出,在6株菌中,菌株GN 4.1在麸皮培养基中发酵时,凝乳活力最高可达1011.56SU/mL,此时蛋白水解活力为14.61U/mL,酶活比值最大。
2.2 菌种鉴定
2.2.1 形态学特征 菌株GN 4.1在酪蛋白平板上菌落边缘不整齐且粘稠湿润,微白色不透明,不光滑,有皱褶,中间隆起。显微镜镜检菌株为长杆状,有芽孢,呈椭圆形,中生。液体静置培养表面形成菌膜。菌株GN 4.1革兰氏染色照片及扫描电镜照片见图2。
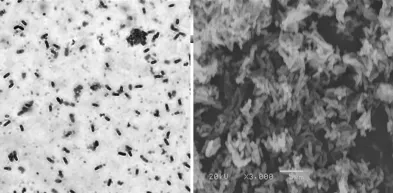
图2 菌株GN4.1革兰氏染色照片(1000×)及扫描电镜照片(3000×)Fig.2 Gram stain(1000×)and electron micrograph(3000×)of strain GN 4.1
2.2.2 生理生化特征 菌株GN 4.1的部分生理生化实验结果见表2,参照《常见细菌系统鉴定手册》[12],初步确定其为芽孢杆菌属。

表2 菌株GN 4.1部分生理生化特征Table 2 Partly biochemical and physiological characteristics of the strain GN 4.1
2.2.3 16S rDNA序列测定及系统发育分析 采用芽孢杆菌16S rDNA特异保守序列引物对菌株GN 4.1进行PCR扩增,对PCR产物进行琼脂糖凝胶电泳和分析,序列长度为1518bp。与已报道芽孢杆菌属的16S rDNA序列进行比较后,从中选出部分菌株,根据其16S rDNA序列,利用MEGA 4.0软件构建其进化树,如图3所示。

图3 菌株GN 4.1与相关菌株系统进化树Fig.3 Phylogenetic tree showing relationship between GN 4.1 and related strains
图3表明菌株GN 4.1与解淀粉芽孢杆菌BCRC11601和解淀粉芽孢杆菌LCEP-1为同一簇,相似性在99%以上,结合形态学和生理生化特征,最终确定菌株GN 4.1为解淀粉芽孢杆菌属,命名为解淀粉芽孢杆菌GN 4.1。
2.3 生长曲线和产酶曲线
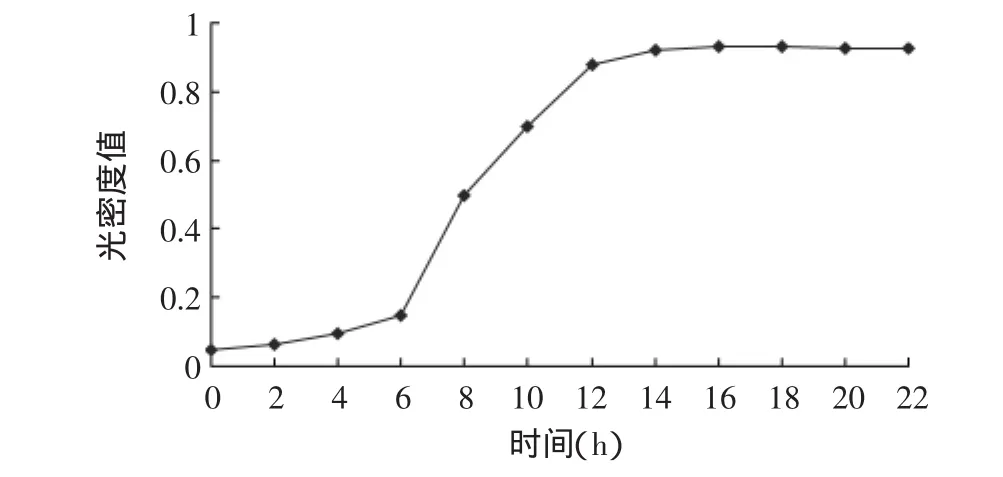
图4 菌株GN 4.1生长曲线Fig.4 Growth curve of strain GN 4.1

图5 菌株的产酶变化曲线Fig.5 Enzyme activity changes in fermentation process
由图4可以看出,菌株GN 4.1在液体培养基中0~6h生长速率缓慢,这个时期为迟缓期;6~12h生长速率最快,这一阶段即为指数生长期;12~20h菌体量随时间延长基本保持平衡,这一阶段为稳定期。由产酶曲线(图5)可以看出,菌株GN 4.1在迟缓期内不产酶,12h后凝乳酶活力迅速增加,在发酵48h时凝乳酶活力达到最高,随后凝乳酶活力略有降低;随着凝乳酶产量的增加,蛋白水解力也逐渐增大,两者变化趋势基本相同,蛋白水解力在42h时达到最大,随后逐渐降低。
2.4 酶学性质
2.4.1 酶的最适作用温度 图6显示了不同反应温度下发酵液的凝乳活力。结果表明,凝乳酶活力在反应温度为60℃时最高。以60℃时的酶活为标准,55℃时相对酶活性下降至81%,70℃时相对酶活性仅为20%,反应温度提高到75℃时,凝乳活力丧失。

图6 不同温度对凝乳酶活力的影响Fig.6 Effect of temperature on milk-clotting activity
2.4.2 酶的热稳定性 发酵液在不同温度水浴处理后,测得的凝乳活力见图7。结果表明,在35℃条件下处理时酶活力变化不大,加热60min后,剩余酶活性为75.70%。在55℃条件下处理时酶活力下降较快,加热40min后,剩余酶活性为8.40%,加热50min后,酶活丧失。在65℃条件下处理时酶活力下降更快,加热10min后,剩余酶活性为6.50%,加热20min后,酶活丧失。

图7 凝乳酶的热稳定性Fig.7 Thermo-stability of milk-clotting enzyme
2.4.3 酶的最适作用pH 不同pH下测定的凝乳酶活力结果见图8。结果表明,在pH3.5~8.0的范围内,均有一定的凝乳活力,其中pH为5.5时凝乳活力最高。以pH5.5时的酶活为标准,在pH4.0~6.5的范围内,凝乳活力下降不多,相对活力均在74%以上。在pH4.0~6.5的范围外,凝乳活力下降较多,pH为3.5时相对活力仅为9%,pH为8.0时相对活力仅为6%。
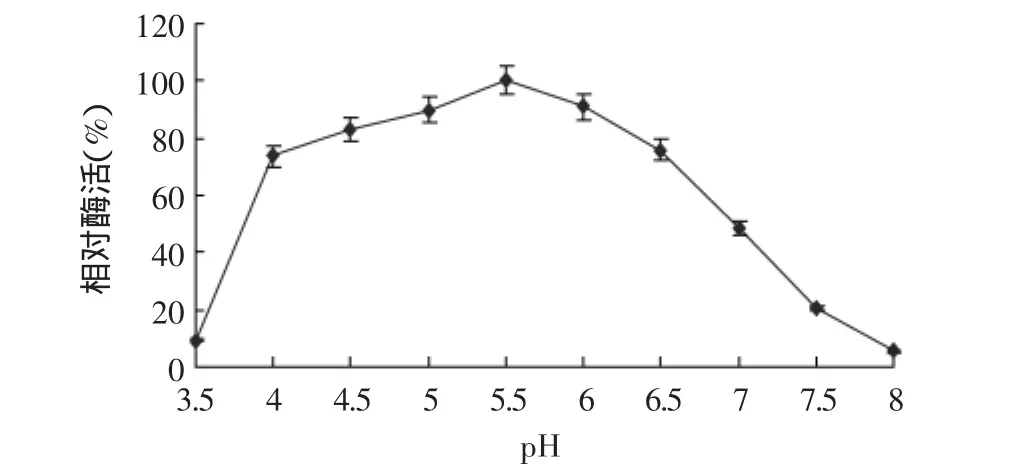
图8 不同pH对凝乳酶活力的影响Fig.8 Effect of different pH on enzyme activity
2.4.4 酶的pH稳定性 凝乳酶在不同pH条件下酶活稳定性结果见图9。结果表明,该酶pH3.5~8.5内相对稳定,pH小于3.5或pH大于8.5时酶活性下降较快,在pH3.0处理时,剩余酶活约为10%,在pH9.0处理时,剩余酶活仅为9%。
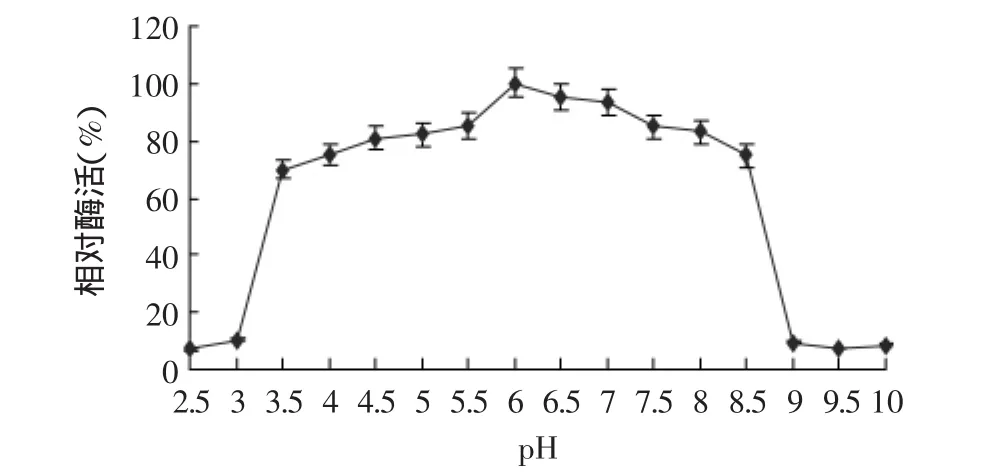
图9 凝乳酶的pH稳定性Fig.9 pH stability of milk-clotting enzyme
3 结论与讨论
3.1 结论
本实验通过酪蛋白培养基,从甘南牧区采集的土壤样品中共筛选得到6株产生沉淀圈的细菌;采用麸皮培养基、牛肉膏蛋白胨培养基和酪蛋白培养基复筛得到一株凝乳活力高、蛋白水解力低的菌株GN 4.1,菌株GN 4.1用麸皮培养基发酵48h时,凝乳活力最高可达1011.56SU/mL,此时蛋白水解活力为14.61U/mL。通过形态学特征、生理生化特征结合16S rDNA序列分析,菌株GN 4.1被鉴定为解淀粉芽孢杆菌(Bacillus amyloliquefaciens)。酶学性质的研究结果表明该菌产生的凝乳酶的最适作用温度为60℃,最适作用pH为5.5,65℃加热10min后凝乳活力丧失,在pH3.5~8.5内稳定性较好。总体来看,菌株GN 4.1不仅发酵产酶周期短,而且具有能利用廉价原料-麸皮、凝乳酶活力高、蛋白水解力弱等特点,该菌株所产凝乳酶热稳定性和pH稳定性较好、可操作性强,有用于乳品工业加工的潜力。该菌株也是国内外首次分离到的产凝乳酶的解淀粉芽孢杆菌属菌株。
3.2 讨论
随着世界奶酪产业不断发展,每年需要大量的凝乳酶。动物凝乳酶的缺乏使得微生物凝乳酶替代品的研究和开发成为热点。本研究从甘肃甘南牦牛放牧区采集了大量土壤样品,进行产凝乳酶微生物的分离。甘南牧区是甘肃省主要的畜牧业基地,地处青藏高原东北边缘,大部分地区在3000m以上,四季温差大,紫外线强度大。当地特殊的地理、气候和人文环境为微生物群落的多样化和繁衍进化提供了条件,这里必然蕴藏着具有独特酶类和特殊的代谢途径的微生物。本研究从牦牛牧区采集的大量土壤样品中共分离得到6个产生沉淀圈的菌株,复筛后得到一株高产凝乳酶细菌GN 4.1,形态学特征、生理生化特征和16S rDNA序列同源分析结果表明它是一株解淀粉芽孢杆菌。目前关于解淀粉芽孢杆菌(Bacillus amyloliquefaciens)在食品工业上应用的报道主要集中在其能产生α-淀粉酶、甲基转移酶、抗菌脂肽、豆豉溶栓酶等[14-17],对于产凝乳酶尚未见报道,菌株GN 4.1的发现丰富了凝乳酶产生菌的资源库。
在实际生产中,缩短发酵周期,设备的利用率就会大大提高。菌株GN 4.1的生长曲线显示其对数生长期在培养6~12h,而在发酵过程中其产酶高峰期却在发酵12h以后,且随着发酵时间的增加产酶活力也不断增加,到48h达到最高,比目前已报道的产凝乳酶真菌米黑毛霉(Mucor mihei)和微小毛霉(Mucor pusillus)发酵周期短[18-20];与已报道的产凝乳酶细菌枯草芽孢杆菌(Bacillus subtilis)和地衣芽孢杆菌(Bacillus licheniformis)相比,菌株GN 4.1不仅发酵产酶周期短,而且具有能利用廉价原料-麸皮、凝乳酶活力高、蛋白水解力弱等特点[7-10]。在后续实验中可对其培养基和培养条件进一步优化,以提高其凝乳活力,降低蛋白水解力。
酶学性质与酶能否工业化应用有很大关系,不同菌株来源的凝乳酶的酶学性质有很大差异。pH和温度是影响凝乳糖酶活性的重要因子,过高或过低会改变凝乳酶蛋白的构象,甚至会导致凝乳酶变性失活;当pH改变不剧烈时,凝乳酶虽尚未变性,但活力会受到一定影响,从而影响酶制剂在生产中的使用效果。根据国际乳业联合会(International Dairy Federation,IDF)要求[21],生产用凝乳酶需具备下列特征:凝乳活性与蛋白水解活性比值(C/P)高;凝乳活性对pH的依赖性较小;在干酪加工中应用的温度和pH条件下活性稳定;在乳清加工中的热稳定性较低;贮藏期间稳定性好。菌株GN 4.1凝乳酶的最适作用温度与微小毛霉凝乳酶同为60℃,均高于小牛皱胃酶。热稳定性与微小毛霉凝乳酶类似,65℃加热10min后凝乳活力丧失;凝乳酶的最适作用pH为5.5,与微小毛霉凝乳酶接近,略低于小牛皱胃酶;菌株GN 4.1凝乳酶的在pH3.5~8.5范围内稳定性良好,说明它适宜的pH范围比小牛皱胃酶和微小毛霉凝乳酶要宽[22-23]。关于菌株所产凝乳酶的其它酶学性质、凝乳酶的氨基酸序列、活性位点和结构预测等有待于进一步研究。
[1]郭本恒.干酪[M].北京:化学工业出版社,2004.
[2]张红梅,刘仲滨.凝乳酶的研究进展[J].同济大学学报:医学版,2004,25(3):254-256.
[3]曾剑超.国内凝乳酶及其代替品的研发进展[J].中国牛业科学,2008,34(2):48-49.
[4]周俊清,林亲录,赵谋明.微生物源凝乳酶的研究进展[J].中国食品添加剂,2004(2):6-9.
[5]郭光远,姜成林,马俊.微生物凝乳酶的研究[J].微生物学通报,1988,15(5):207-210.
[6]K Arima,I Shinjiro,T Gakuzo.Milk-clotting enzymes from microorgainism,Part I,Screening test and identification of potent fungus[J].Agric Biol Chem,1967,31(5):540-545.
[7]宋曦,甘伯中,贺晓玲,等.天祝县牦牛牧区土壤中产凝乳酶细菌筛选及鉴定[J].食品科学,2009,30(11):158-162.
[8]胡永金,石振兴,朱仁俊,等.一株产凝乳酶细菌的分离与鉴定[J].中国酿造,2010(5):81-83.
[9]刘河涛.一株产凝乳酶枯草芽孢杆菌的筛选、鉴定及其酶活性质的研究[D].兰州:兰州大学,2008.
[10]C Shieh,L Thi,I Shih.Milk-clotting enzymes produced by culture of Bacillus subtilis natto[J].Biochemical Engineering Journal,2009,43(1):85-91.
[11]刘慧.现代食品微生物学实验技术[M].北京:中国轻工业出版社,2006.
[12]东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001.
[13]沈萍,范秀容,李广武.微生物学实验[M].第三版.北京:高等教育出版社,1999.
[14]刘洋,沈微,石贵阳,等.解淀粉芽孢杆菌BamHI甲基转移酶基因克隆、功能鉴定与序列分析[J].生物技术通报,2009(11):65-68.
[15]史永昶,姜涌明,樊飚,等.蛋白酶对解淀粉芽孢杆菌α-淀粉酶活力的影响[J].微生物学通报,1995,22(1):23-25.
[16]孙力军,陆兆新,别小妹,等.培养基对解淀粉芽孢杆菌ES-2菌株产抗菌脂肽的影响[J].中国农业科学,2008,41(10):3389-3398.
[17]彭勇,张义正.解淀粉芽孢杆菌(Bacillus amyloliquefaciens)DC-4产豆豉溶栓酶发酵条件的优化[J].食品与发酵工业,2002, 28(4):19-23.
[18]J Escobar,S Barenett.Synthesis of acid protease from Mucor miehei integration of production and recovery[J].Process Biochemistry,1995,30(8):695-700.
[19]K Arima,J Yu,S Iwasaki.Milk-clotting enzyme from Muor pusillus var.lindt[J].The Acidic Proteases,1972,30:446-459.
[20]G Somkuti,F Babel.Conditions influencing the synthesis of acid protease by Mucor pusillus Lindt[J].Applied Microbiology, 1967:1309-1312.
[21]T Guinee.Rennet coagulation and coagulants in cheese manufacture[J].Journal of the Society of Dairy Technology,1992,45(4):94-104.
[22]卢蓉蓉,黄艳艳.皱胃酶酶学性质的研究[J].食品科技,2002(5):254-256.
[23]矫庆华,钱世钧,孟广震.微小毛霉凝乳酶的生物合成和性质的研究[J].微生物学报,1992,32(1):30-35.
Study on isolation,identification of Bacillus amyloliquefaciens producing chymosin and enzyme properties
ZHANG Wei-bing1,2,3,GAN Bo-zhong1,2,3,*,LIANG Qi1,2,3,MI Lan1,2,3,ZHANG Yan1,2,3
(1.College of Food Science and Engineering,Gansu Agricultural University,Lanzhou 730070,China;2.Gansu Provincial Key Laboratory of Functional Dairy,Lanzhou 730070,China;3.Gansu Casein Engineering Technical Research Center,Lanzhou 730000,China)
The casein culture medium was used to isolate milk-clotting enzyme producing bacteria from soil of yak grazing district in Gannan County.Strain identification was carried out based on the morphology,physiology,biochemical test and 16S rDNA sequences analysis,and the property of the milk-clotting enzyme produced by the strain was studied.Six bacteria producing milk-clotting enzyme were screened out.Furthermore,one bacterium GN4.1 had the highest milk-clotting enzyme activity and the lowest protein hydrolyzed enzyme activity,identified as Bacillus amyloliquefaciens.The milk-clotting enzyme activity and the protein hydrolyzed enzyme activity of GN 4.1 was 1011.56SU/mL and 14.61U/mL after fermentation for 48h,respectively.The optimal reaction condition for milk-clotting enzyme was at 60℃,pH5.5.The activity was stable at pH ranging from 3.5 to 8.5 but totally lost after heating at 65℃for 10min.The milk-clotting enzyme produced by strain GN 4.1 might have the potential applicatin in dairy industry.
Bacillus amyloliquefaciens;milk-clotting enzyme;enzyme properties
TS201.3
A
1002-0306(2012)07-0172-06
2011-07-14 *通讯联系人
张卫兵(1974-),男,副教授,博士,研究方向:应用微生物学。
国家863计划(2011AA100903);甘肃省科技重大专项项目(0702NKDA034);甘肃农业大学创新基金(GAU-CX1107)。

