体外循环导致大鼠小肠微循环损伤的机制研究
吴海卫,许 飚,景 华,王常田,钱建军,董国华
体外循环(cardiopulmonary bypass,CPB)过程中非生理性血流可引起全身炎症反应综合征(systemic inflammatory response syndrome,SIRS),造成各种器官功能损伤。小肠在SIRS发生发展中即是“靶”又是“源”,CPB后肠黏膜屏障功能的损害可以造成内毒素入血、肠道菌群易位,从而触发瀑布效应,甚至引起多脏器功能障碍,影响临床治疗效果[1-2]。CPB引起肠道损伤的机制尚不清楚,本研究采用大鼠CPB模型,用荧光活体显微镜技术对小肠微循环变化进行直接观察,定量分析肠壁血流灌注、血管通透性及白细胞附壁情况,探讨CPB后肠道损伤的发生机制。
1 材料与方法
1.1 动物模型及分组 采用450~550 g成年雄性SD大鼠,建立常温CPB模型[3-4]。简要步骤如下,大鼠麻醉后气管切开接小动物呼吸机辅助通气,吸入氧浓度100%。左股静脉置22G套管针,接微量输液泵,维持静脉通道;右侧颈动脉置24G套管针,连接动脉泵管,用于CPB动脉血泵入。右颈静脉置入带网状侧孔的16G穿刺导管,深入至右心房水平,引流静脉血入贮血槽。全身肝素化(500 IU/kg)后开始转流。静脉血由右房经颈静脉管依靠重力和虹吸引出,引流到位于心脏平面下方30 cm的开放贮血槽,经微型膜肺(广东科威医疗器械有限公司,气血交换面积0.05 m2,预充量4 ml)氧合,氧合血由小型蠕动泵(保定兰格恒流泵有限公司,BT00-300M型)泵入右颈动脉。预充液由8 ml贺斯和8 ml供体血液构成。在贮血槽和膜肺上方,用100W白炽灯照明加热,以维持肛温在36.5~38.3℃。逐渐增加流量,稳定于100~150 ml/(kg·min),维持平均动脉压在60~80 mm Hg。转流60 min后,逐步降低灌注流量并停机,依次拔除各管道。缓慢输入贮血槽中的余血,维持循环稳定。继续辅助呼吸120 min并进行微循环观察。20只大鼠随机分为CPB组及对照组,每组各10只。两组动物手术操作相同,CPB组连接CPB装置并转流60 min,对照组同样连接装置并肝素化但不转流。
1.2 活体观察方法 在观察开始前,经股静脉分别注入异硫氰酸荧光素标记牛白蛋白(fluorescein isothiocyanate-bovine serum albumin,FITC -BSA)(5%,0.2 ml/100 g)和吖啶橙(0.2%,0.1 ml/100 g),其中FITC-BSA可以使血浆着色,以显示肠壁毛细血管结构,吖啶橙可以标记体内白细胞,使其细胞核在镜下呈现为发光亮点。做腹部正中切口,将末段回肠连同肠系膜轻轻拉出腹外,逆肠系膜方向纵形切开肠管约1 cm,以6-0单丝线缝于四周,舒展、固定于载玻片,置于观察台,连续用37~38℃生理盐水表面灌流给肠壁保温、保湿。黏膜及黏膜下层由通过切口由内向外,浆膜层及肌层则直接从肠管外由外向内进行观察。采用荧光显微镜(上海2XC4TV型)进行活体观察,用100W汞灯分别通过I2/3(绿色,波长530~560 nm)和 N2(兰色,波长450~490 nm)滤色板顶部照明。分别于CPB前(T1)、CPB 30 min(T2)、CPB 60 min(T3)、CPB 后60 min(T4)、CPB后120 min(T5)对小肠微循环状态进行显微观察,选定有代表性的4个不交叉区域经行各项指标检测,通过摄影、摄片记录有关图像资料,用Image J图像分析系统做评估。
1.3 指标检测
1.3.1 微循环血流动力学指标 选择无分枝、长度100μm、直径30μm左右的小动脉,测量其直径变化;用逐祯回放分析技术,测量黏膜下层收集静脉中的红细胞流速;测量观察区域内荧光灌注毛细血管长度,分别计算肌层、黏膜层单位面积FITC-BSA灌注毛细血管的长度,即功能毛细血管密度(functional capillary density,FCD),FCD 值以单位面积FITC-BSA灌注毛细血管的长度表示(/cm)。
1.3.2 毛细血管通透性 FITC-BSA分子量大,正常情况下不能通透血管壁而位于血管腔内,当毛细血管通透性增加时,FITC-BSA可穿过血管壁进入组织间隙,使血管周围出现散在的不规则斑片状荧光。利用计算机图像处理技术,将其转为255灰阶图时,可以表现为灰度值增加,其增加幅度与FITC-BSA的漏出程度呈正相关。通过测定微血管周围的灰度值变化,可以定量了解血管壁的通透性情况,灰度值越高,则表示组织间的大分子物质越多,血管通透性就越大。
1.3.3 白细胞浸润情况 于高倍视野下找到黏膜下层清晰的毛细血管后微静脉,通过摄像系统记录白细胞的流动状态。将静止于血管内皮>30 s和游走于血管外但仍在小血管旁的白细胞认定为附壁状态,对其计数,并计算100μm长度血管的附壁白细胞数。
2 结果
2.1 小动脉直径 小动脉直径自CPB开始后开始逐步下降,到观察结束时最为明显,从(30.8±3.6)μM降至(20.6 ±3.7)μm,差异显著(P <0.001),这种血管收缩与小血管的自律运动无关,见图1。
2.2 小静脉血流速度 CPB开始后小静脉内血流速度减慢,随着CPB时间的延长,血流速度进一步降低。在T4和T5时小静脉血流速度仍持续降低,从T1时的(1.38±0.08)mm/s降为至 T5时的(0.44 ±0.06)mm/s,见图2。
2.3 功能毛细血管密度 对照组黏膜层毛细血管网丰富,绒毛内小血管细而迂曲,结构清晰;肌层毛细血管网在正常情况下呈规则矩形,毛细血管网丰富,显影清晰,见图3A。CPB状态下可见到明显的血管充盈减少,并有血管边缘模糊表现;转流后120 min FITC-BSA灌注血管影明显减少,并有相互之间的交通中断现象,见图3B。对照组肌层和黏膜层FCD值随时间的延长无明显变化,而CPB后则逐渐减少,至CPB后120 min时分别由从CPB前(511±17)/cm和(221±13)/cm降为(150±17)/cm和(64 ±7)/cm,差异显著(P <0.001),见图4。
2.4 毛细血管通透性 对照组术后120min毛细血管轮廓清晰,FITC-BSA局限于血管内,血管周围背影黑暗,见图5A。CPB转流开始后,随时间延长可以见到逐步增多的血管外透亮区,在小肠黏膜层绒毛微血管和黏膜下层毛细血管后微静脉中尤为明显,至观察结束时,个别小血管结构变得模糊不清,边界难以确认,见图5B。定量分析则表现为小血管周围灰度值的逐步增加,由开始时的(142±7)升至实验结束时的(220±13),有显著统计学差异 (P<0.001),表明CPB后小血管通透性增加。见图6。
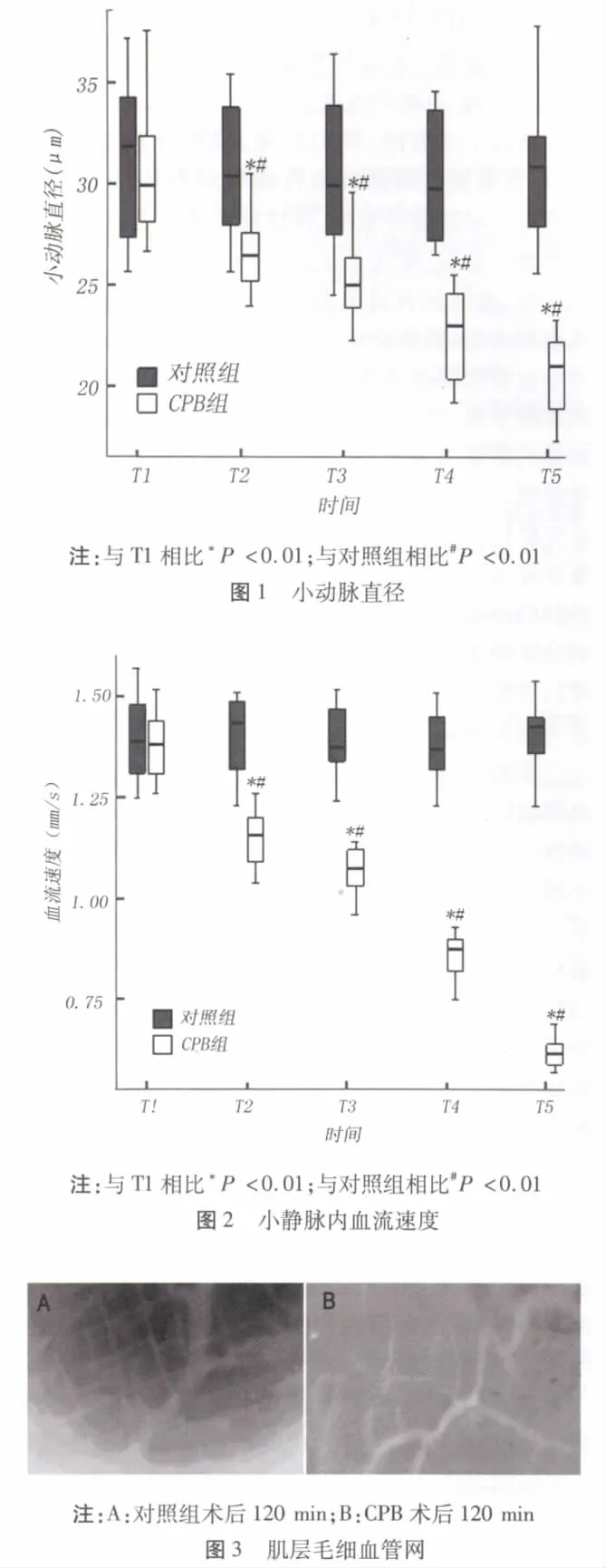
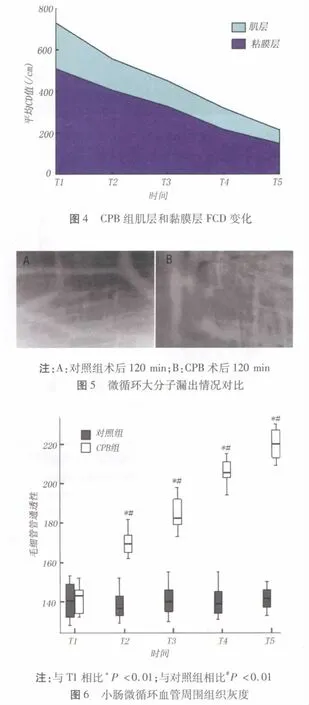
2.5 白细胞浸润情况 对照组毛细血管内很少见到附壁白细胞,毛细血管内偶见被吖啶橙染亮的白细胞颗粒,见图7A,箭头所示为停留于血管边缘的白细胞,在吖啶橙染色下呈现桔红色颗粒;而CPB组大鼠在转流120 min后,附壁的白细胞数目明显增加,以黏膜下层小静脉内最为突出,可见到许多的白细胞亮点聚集于小血管内及血管周边,见图7B。定量分析显示白细胞附壁数由CPB前(2.8±1.3)个/100 μM升至(30.3±1.3)个/100 μm,差异显著(P <0.001),见图8。
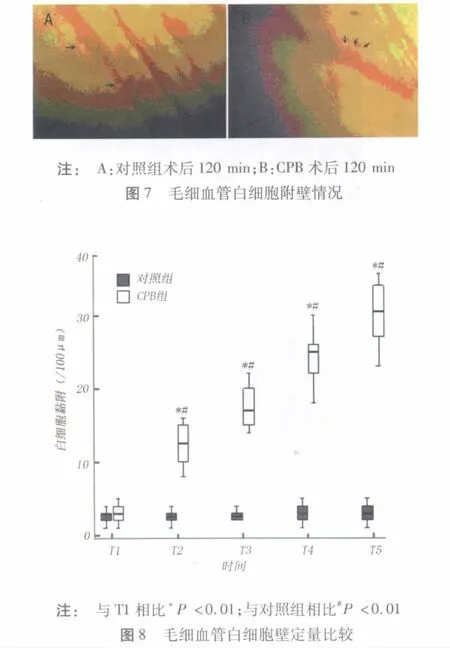
3 讨论
限于伦理道德方面的制约,对CPB所致胃肠道损伤及其在术后全身炎症反应中作用的研究,在人体上难以深入,大多限于临床经验总结或间接测定,如:对术后消化系统并发症的分析、Doppler超声腹内血管血流测定、动脉-胃黏膜pHi测定等,从而推断胃肠道缺血及黏膜损伤程度,无法做到直接、定量分析,进一步的研究必须依赖适当的动物模型[4-5]。本实验建立大鼠CPB模型,采用活体荧光显微镜技术,对小肠微血管形态、管壁结构完整性及血管内的细胞运动状态进行直接、定量观察和分析研究。过去的研究常采用肠系膜作为微循环观测对象,然而,肠系膜与肠壁内的微血管在结构分布和血流状态上存在很大差别,且肠壁各层之间也有明显不同[6-7],因此,必须对肠壁各层(包括绒毛层、黏膜层、黏膜下层及肌层等)微循环直接观测,才是判断其损伤程度最直观、有效的方法。
通过上述方法,我们发现,CPB可造成肠道缺血、血管通透性增加和炎性细胞浸润等病理现象。CPB后小动脉管径变细,伴随着血流速度减慢,导致肠壁血供减少、灌注不足;FCD进行性下降,到观察结束时,大约只有转流前的30%,表明肠道存在血流重新分布,肠壁缺血的程度严重;白蛋白的外溢,显示血管壁通透性增加,屏障功能受损,而周围组织的水肿形成,可以进一步加重微循环损害;小静脉内聚集的附壁白细胞,可能是最早参与炎症反应的活化细胞,它们产生、释放各种炎性介质,破坏血管内皮完整性,加重液体外渗,并在随后的病理改变中伴演重要角色。研究还发现,毛细血管和黏膜下收集静脉的改变最早、最明显,是CPB损伤中最易受影响的结构单元。而转运毛细血管减少和腔内淤滞,可以导致小肠肌层毛细血管灌注和营养紊乱,肌肉活力丧失或减少,最后导致肠麻痹[8]。
实验中为了避免药物作用的影响,未使用任何血管活性药物,然而在这种状态下,小肠微循环损伤的改变仍然非常明显。因此,可以认为,CPB导致的小肠微循环缺血不仅仅是机体低灌注或低心排的结果,而非生理性转流过程中的血流重新分配可能是最初的致伤原因[9]。值得注意的是,这种损伤在CPB结束后的2小时没有任何缓解的征象,反而达到了高峰。这表明,CPB诱发的炎症反应可能是肠道损伤最主要的机制,CPB过程尽管已经停止,但炎症反应却仍在继续。CPB过程中血液和血细胞与体外管道人工表面接触、泵的机械损伤、缺血再灌注损伤导致白细胞活化、炎性介质释放、血浆酶、补体活化、白细胞溢出、氧自由基释放[10-11],这些都可以直接或间接影响微循环,导致血管收缩,血液浓缩和血流淤滞,随后内皮细胞肿胀,阻塞血管,血管通透性增加,大分子渗漏。
总之,本研究利用大鼠CPB模型和活体荧光显微镜技术,直观地研究了CPB所致小肠微循环进行性损伤的现象,初步揭示了其微观病理生理机制。研究发现,在体循环状态稳定的情况下,常温CPB可以导致大鼠明显而持续的小肠微循环损伤,血流重新分配和炎性细胞浸润可能是最主要的致伤因素。
[1]柴文祥,李刚,荣金明,等.体外循环心脏术后腹部并发症临床分析[J].实用医药杂志,2009,26(09):1-4.
[2]董国华,景华,李德闽,等.体外循环术后消化系统功能障碍的临床分析[J].中国医师杂志,2004,6(11):1498-1500.
[3]Dong GH,Xu B,Wang CT,etal.A ratmodelof cardiopulmonary bypasswith excellent survival[J].JSurg Res,2005,123(2):171-175.
[4]黄海嵘,王常田,申翼,等.体外循环后大鼠肝损伤的研究[J].医学研究生学报,2009,22(1):5.
[5]李志浩,苏肇伉,陈冬英,等.小儿先天性心脏病术后肠道通透性的研究[J].中国体外循环杂志,2007,5(1):7-10.
[6]Rimpilainen R,VakkalaM,Rimpilainen E,etal.Minimized and conventional cardiopulmonary bypass damage intestinalmucosal integrity[J].Scand Cardiovasc J,2011,45(4):236 -246.
[7]林宝泉,王军,王强,等.中低温停循环经下腔静脉逆灌对猪肠系膜微循环的影响[J].中国体外循环杂志,2011,09(1):36-39.
[8]Beuk RJ,Tangelder GJ,Maassen RL,et al.Leucocyte and platelet adhesion in different layers of the small bowel during experimental totalwarm ischaemia and reperfusion[J].Br JSurg,2008,95(10):1294 -1304.
[9]Dong GH,Wang CT,Li Y,et al.Cardiopulmonary bypass induced microcirculatory injury of the small bowel in rats[J].World JGastroenterol,2009,15(25):3166 -3172.
[10]Geissler HJ,Fischer UM,Grunert S,etal.Incidence and outcome ofgastrointestinal complications after cardiopulmonary bypass[J].Interact Cardiovasc Thorac Surg,2006,5(3):239 -242.
[11]刘小雄,彭金华,徐建军,等.谷氨酰胺对体外循环患者肠道保护作用的临床研究[J].中国体外循环杂志,2007,5(1):11-13.

