低体重患儿围体外循环期实施新节约用血策略的研究
刘晋萍,冯正义,崔勇丽,赵 举,赵明霞,胡金晓,李守军,闫 军,晏馥霞,王 旭,龙 村
输入同源异体血液是心脏直视手术体外循环中为避免先天性心脏病(先心病)患儿过度血液稀释的一项重要措施。但输血的同时会给患儿带来许多不良影响,如感染艾滋病、乙型和丙型肝炎等;术后早期高热;过敏变态反应;输血相关急性肺损伤等[1]。多项研究已表明先心病患儿的输血量与手术预后不良有显著相关性[2]。同时由于近期国内多家心脏中心受到血源紧张的限制已严重影响了正常手术诊疗安排。因此,如何减少用血需求以应对“血荒”问题,已成为当前临床工作中的重中之重。自2011年10月起,我们对低体重先心病患儿制定并实施了改良“省血策略”,并对其可行性和有效性给予评价,现将研究结果报告如下:
1 资料与方法
1.1 临床资料 2011年8月至2012年1月,共有76名行心脏直视手术的低体重先心病患儿(≤8 kg)纳入本研究。将其分成两组:对照组(n=38)在体外循环中采用经典预充血制品策略;实验组(n=38)患儿实施无血预充方案并结合新改良节约用血策略。两组患儿病种介绍见表1。急诊、二次手术、中重度紫绀(红细胞比容>0.45)及术前患严重贫血者(红细胞比容<0.30)排除研究之外。本研究经申请院所伦理委员会答辩通过后并均与患儿家属签订知情同意书。患儿一般资料见表1。
表1 两组患儿的病种介绍((n=38))
1.2 麻醉与体外循环方法 采用静吸复合麻醉方法。全部患儿采用Jostra HL 20型人工心肺机(德国Maquet公司),预充液成分有勃脉力(Plasmalyte-A,美国百特公司,批号S1001082)、20%人血白蛋白(美国百特公司,批号VNA1J105pAA)、万汶(德国费森优斯卡比公司)、5%碳酸氢钠(上海博升公司,批号091212)、10%葡萄糖酸钙(福建古田药业公司,批号0910241)、甲泼尼龙(美国普强制药厂,批号S10373)及呋塞米(武汉远大制药集团,批号1002112)等。体外循环主要物品及预充液成分的差异见表2。分别在浅、中度低温(25~30℃)体外循环下完成手术,灌注流量维持(80~200)ml/(kg·min),术中平均动脉压控制在30~60 mm Hg,静脉血氧饱和度维持在60%以上。
1.3 资料收集 两组患儿术前一般资料、围体外循环期预充红细胞和血浆用量及体外循环术前、中、后的红细胞比容、胶体渗透压和相应血气指标变化的资料;两组患儿术后24 h胸液量、机械通气时间、ICU停留时间和死亡率。
1.4 统计学处理 采用SPSS 13.0软件进行统计学处理。计量资料以均数±标准差(±s),计数资料采用频率和率表示;计量资料两组间比较采用t检验,计数资料组间比较采用X2检验,P≤0.05为差异有统计学意义。
2 结果
2.1 一般情况 对照组和实验组患儿性别(女性31.6%vs 26.3%)、年龄[(9.4 ±3.6)个月vs(9.6 ±4.1)个月]、体重[(6.2 ±1.9)kg vs(7.1 ±1.2)kg]、体外循环时间[(92.2 ±29.0)min vs(101.4 ±32.6)min]和主动脉阻断时间[(70.6 ±12.5)min vs(74.8±19.7)min]均无显著性差异(P >0.05);实验组患儿的体外循环管路静态预充量(203.8±10.9)ml明显低于对照组(347.3 ±15.8)ml(P <0.01)。
2.2 血液制品应用情况 实验组患儿体外循环平均采用悬浮少白红细胞(PRBC)(95.7±20.1)ml的预充量显著少于对照组(275.6±17.5)ml(P <0.01);实验组中只有3例(占0.08%)患儿术中预充100 ml新鲜冰冻血浆(FFP),显著少于对照组患儿预充血浆率(100%)(P <0.01);实验组中有12例患儿围术期无血液制品输入,其术前平均血红蛋白浓度(131.1±10.4)g/L高于另26例输血患儿的术前平均血红蛋白浓度(110.3 ±23.2)g/L(P <0.05)。
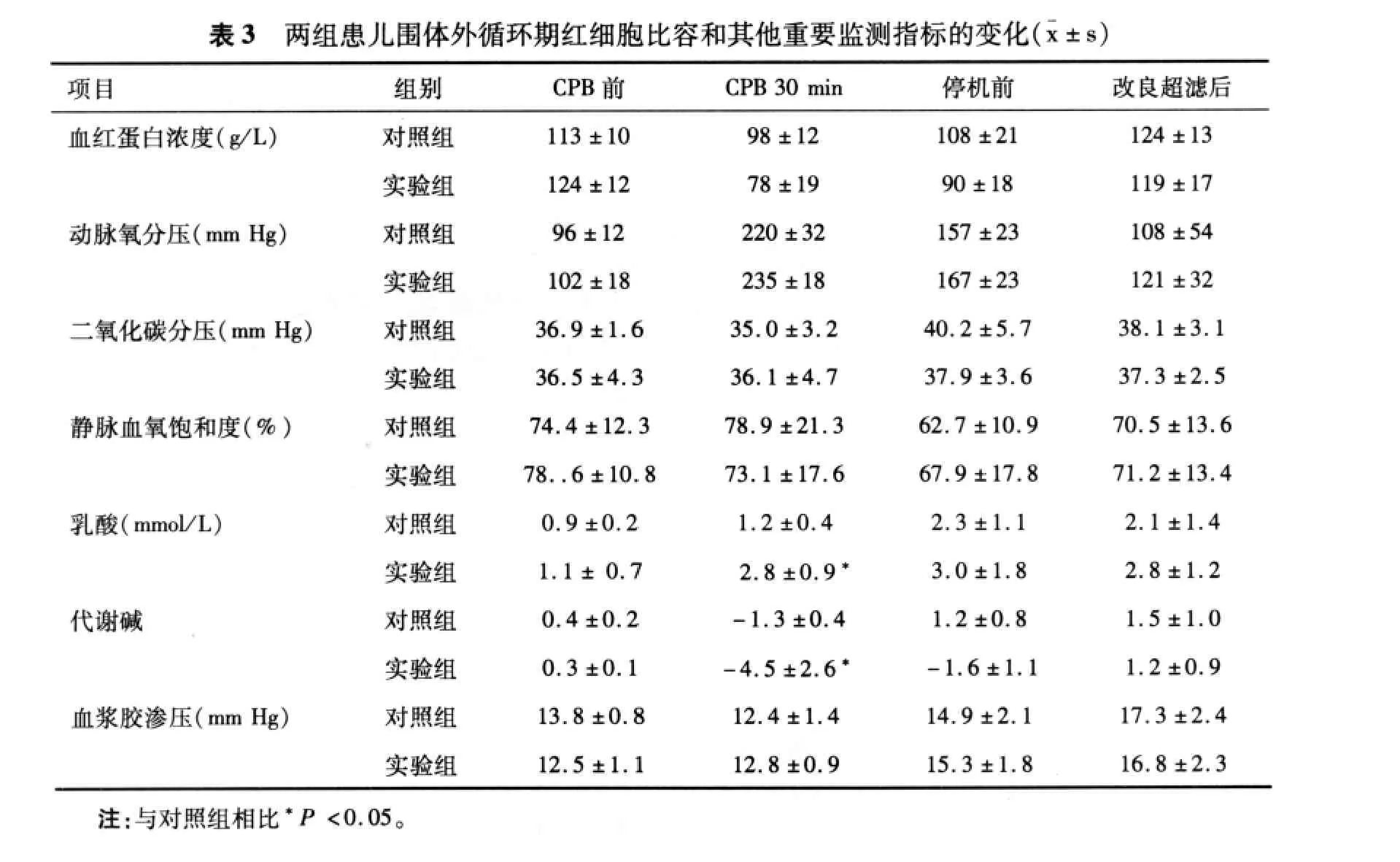
2.3 血液中重要监测指标的变化 实验组患儿的乳酸值在体外循环转流初期明显高于对照组(P<0.05);实验组患儿的代谢碱负值在体外循环转流初期明显高于对照组(P<0.05);其他各时点监测指标在两组间无统计学差异(P >0.05),见表3。
2.4 术后早期恢复指标 两组间患儿术后24 h胸液量无显著性差异;机械通气时间、ICU停留时间无显著性差异(P>0.05);两组患儿术后均无严重并发症发生,均无院内死亡。
3 讨论

?
?
婴幼儿体重小、体内血容量相对少,如果体外循环术中血液过度稀释会造成组织器官水肿、机体供氧不足及出血等并发症。体重较大、病情较轻的婴幼儿体外循环术中采用无血预充在国内已有报道[3-4],但如何应对我国目前数量日益增长的先心病患儿的低龄化、病情复杂化的特点,我们借鉴了国外多家先进小儿心脏中心对耶和华见证人(Jehovah witness)教派的患儿所实施的无血体外循环技术[5-6],力求探索出一套适合国人的无血预充技术。
心脏手术中节约用血是一项团队性工作,需要术前心内科医生、术中心外科、麻醉、体外循环医生,以及术后监护室医护人员的密切配合和科学管理才得以完成。本院小儿心脏中心开展该项工作就是在团队全体成员共同商议、相互学习、统一认识的前提下,制定了详细周密的管理流程,并要求外科医生精细操作、认真止血,其他环节人员尽其所能地节约每一滴血,为实施省血策略奠定重要基础。
体外循环管道是决定预充总量的关键因素。本院以往常规低体重患儿(<8 kg)的管道内径为动脉3/16英寸(相当于4.8 mm),泵管段为1/4英寸,静脉1/4英寸(相当于6.35 mm),管道套包的预充总量(包括氧合器和微栓滤器)约为350 ml。为了有效实施无血或少用血的管理策略,我们将低体重患儿所使用的管道套包进一步迷你化,将动脉管路内径缩小为1/8英寸(3.1 mm),泵管段为3/16英寸,静脉管路依然保持1/4英寸。此外,还将会占有一定预充量的左心心内吸引管细化到1/8英寸,这些改变能明显降低体外循环预充量至200 ml左右。本研究实验组的患儿全部采用改良后的管道套包,灌注流量可达到100~150 ml/kg,也无一例发生溶血现象,并为减少血液制品应用奠定重要基础。
除了减低体外循环预充总量外,患儿术前红细胞比容水平也是实现无血或少血手术的关键因素。本研究为探讨改良策略用于低体重患儿的普遍性和可行性,并未选择术前即有高红细胞比容水平的中重度紫绀患儿。众所周知,血红蛋白是机体携氧的重要载体,其浓度变化也是影响机体氧代谢的关键因素。体外循环中安全的血红蛋白浓度究竟维持多少,也一直是众多无血体外循环研究的焦点。本研究将术中稀释后的安全血红蛋白浓度定为70 g/L,当低于该水平时应适时补充红细胞。研究发现,对于术前红细胞比容水平大于0.36的低体重患儿较易实现无血体外循环手术,而对于红细胞比容水平小于0.36的患儿补充红细胞数量明显增多,但应用总量仍显著少于以往实施经典预充方案的患儿预充总量。
我们发现在实施无血预充过程中,无血组患儿的体外循环预充液以晶体液(勃脉力)和人工胶体液(万汶)为主,由于该液体均呈酸性,导致患儿转流初期的血气呈现代谢性酸中毒的状态,因此,需要在预充液中常规加入5%碳酸氢钠溶液进行中和。其次,由于实验组患儿进行无血预充,故转流早期受血液稀释的影响,血红蛋白浓度明显低于对照组患儿;而且乳酸水平也会有轻度增高,可能与低血红蛋白浓度影响对机体的氧供有关,随着转流中温度降低和进行超滤等管理,可以逐步调节机体进入氧供需平衡的状态。但是,当患儿通过调节灌注流量、温度、氧浓度等措施后,机体依然表现有乳酸增高、混合静脉氧饱和度降低、代谢性酸中毒等时,要积极补充红细胞,将血红蛋白浓度提高到满意水平。故实验组的26名患儿在术中及时补充红细胞才得以顺利完成手术。
改良超滤技术在婴幼儿体外循环管理中的优势已被广泛认可。但连接该装置却不可避免地占用一定的预充量(约60~80 ml)。有学者报道弃掉超滤装置可减少预充量[7],但本研究小组普遍认为改良超滤的技术在提高体外循环术后红细胞比容水平和改善低体重患儿术后预后方面的优势作用是无可替代的。为了完善该技术,我们在连接方法上做了改进,有效降低了因其预充量所带来的不利影响。
本研究结果证实了改良节约用血策略的可行性和有效性,但仍存在不足之处:首先,患儿样本量少,尚需要进一步收集临床资料以验证其安全性;其次,在评价术中安全血红蛋白浓度水平时,还应加强脑氧饱和度的监测,以探讨血液稀释后对围术期脑损伤的影响,减少术后脑并发症的发生;最后,静脉负压引流装置是减少体外循环预充量的一项重要手段[8],本研究实验组患儿尚未使用该设备,在下一步的研究中我们会将其应用于临床,以进一步完善节约用血策略。
总之,节约用血已是当务之急,通过合理改良现有的体外循环技术可以显著减少血液制品的应用。但在实施无血或少用血的过程中,应视患儿安全为首位,需要结合患儿术前状态,针对某些手术情况如二次手术、长时间体外循环、再次转流等应谨慎对待。该研究对无血或少血手术患儿早期术后恢复未发现异常,但长期预后还有待进一步研究。
[1]Rogers MA,Blumberg N,Saint SK,et al.Allogeneic blood transfusions explain increased mortality in women after coronary artery bypass graft surgery[J].Am Heart J,2006,152(6):1028-1034.
[2]Koch CG,Li L,Duncan AI,etal.Morbidity andmortality risk associated with red blood cell and blood-component transfusion in isolated coronary artery bypass grafting[J].Crit Care Med,2006,34(6):1608-1616.
[3]郭仙.无血预充液在小儿体外循环中的临床应用[J].河南医学研究,2006,15(2):150-152.
[4]陈萍,张镜方,章晓华,等.体重15~25千克小儿体外循环心脏手术无血预充及减少围术期输血的探讨[J].临床麻醉学杂志,2002,18(9):492-493.
[5]Olshove VF Jr,Preston T,Gomez D,et al.Perfusion techniques toward bloodless pediatric open heart surgery[J].JExtra Corpor Technol,2010,42(2):122 -127.
[6]Stein J,Gombotz H,Rigler B,et al.Open heart surgery in children of Jehovah's Witnesses:Extreme hemodilution on cardiopulmonary bypass[J].Pediatr Cardiol,1991,12(3):170-174.
[7]Durandy Y.Usefulness of low prime perfusion pediatric circuit in decreasing blood transfusion[J].ASAIO J,2007,53(6):659-661.
[8]Durandy Y.The impact of vacuum -assisted venous drainage andminiaturized bypass circuits on blood transfusion in pediatric cardiac surgery[J].ASAIO J,2009,55(1):117 -121.
——体外循环质量控制的基石

