原核表达肺炎链球菌毒力蛋白PspA对人类嗜中性粒细胞释放CXCL8的影响
徐 蕾,陈 丹,甘 萍,曹 炬
(1.重庆医科大学病原生物学教研室 400016;2.重庆建设医院药剂科 400050;3.重庆三峡中心医院儿童分院儿内科 404000;4.重庆医科大学附属第一医院检验科 400016)
原核表达肺炎链球菌毒力蛋白PspA对人类嗜中性粒细胞释放CXCL8的影响
徐 蕾1,陈 丹2,甘 萍3,曹 炬4
(1.重庆医科大学病原生物学教研室 400016;2.重庆建设医院药剂科 400050;3.重庆三峡中心医院儿童分院儿内科 404000;4.重庆医科大学附属第一医院检验科 400016)
目的探讨原核表达肺炎链球菌表面蛋白A(PspA)对人类嗜中性粒细胞释放CXCL8的影响。方法将重组质粒pET-32a(+)/PspA转化到大肠埃希菌BL21(DE3)中,经异丙基-β-D-硫代吡喃半乳糖苷诱导重组菌表达 TRx-His-PspA融合蛋白并纯化;通过肠激酶切掉融合蛋白的TRx-His部分,获得PspA蛋白。用PspA蛋白免疫小鼠,获得抗PspA抗体。再将PspA蛋白加入到人类嗜中性粒细胞的培养基中共孵育,检测CXCL8释放水平的差异;最后,用抗PspA抗体检测其对PspA蛋白促人类嗜中性粒细胞释放CXCL8的影响。结果中性粒细胞细胞内合成和释放到培养基上清液的CXCL8显著增加(P<0.05);而加入了抗PspA抗体后,PspA蛋白刺激人中性粒细胞释放CXCL8的能力明显减弱。结论PspA可以上调人类嗜中性粒细胞趋化因子CXCL8的合成和释放,揭示了中性粒细胞和肺炎链球菌致病因素之间的关系。
链球菌,肺炎;膜蛋白质类;中性粒细胞;CXCL8
据世界卫生组织统计,每年死于肺炎链球菌侵入性疾病的人数有1.6亿[1]。肺炎链球菌表面蛋白A(pneumococcal surface protein A,PspA)是肺炎链球菌的主要毒力蛋白之一,该菌在侵入性疾病的发病机制中发挥重要作用。另一方面,中性粒细胞从血液中迁移到炎症病灶是固有免疫反应抗侵入性肺炎链球菌疾病的初始阶段[4]。然而,中性粒细胞和肺炎链球菌的相互作用还不完全清楚。本研究通过揭示肺炎链球菌毒力蛋白PspA和人嗜中性粒细胞释放炎性因子CXCL8的密切关系,从而了解肺炎链球菌与机体免疫细胞、免疫体系的相互关系,现报道如下。
1 材料与方法
1.1 菌株及质粒 大肠埃希菌BL21(DE3)为本实验室保存;pET-32a(+)/PspA为本实验室构建。
1.2 动物及主要试剂 BALB/c小鼠由重庆医科大学动物中心提供,均为雌性,8~10周龄,18~20g。异丙基-β-D-硫代吡喃半乳糖苷、丙烯酰胺为Sigma产品,质粒抽提试剂盒为Omega公司产品,组氨酸单克隆抗体及辣根过氧化物酶标记羊抗鼠IgG为Novagen公司产品,SYBR绿色荧光定量PCR购自罗氏公司,RPMI-1640培养基、胎牛血清、HEPES购自Gibco公司。
1.3 融合蛋白TRx-His-PspA的诱导表达、鉴定及纯化 将重组质粒pET-32a(+)/PspA转化至大肠埃希菌BL21中,挑取阳性克隆,接种于含氨苄西林的普通琼脂培养液中,于37℃振荡至对数增长期时,加入异丙基-β-D-硫代吡喃半乳糖苷(终浓度为1.5mmol/L)诱导4h,取样进行12%十二烷基磺酸钠聚丙烯酰胺凝胶电泳(sodium dodecylsulfonate polyacrylate gel electrophoresis,SDS-PAGE)分析。表达产物经 SDS-PAGE 后电转移至聚偏氟乙烯(polyvinylidene fluoride,PVDF)膜上,用5%脱脂奶粉封闭2h,加入组氨酸单克隆抗体孵育过夜;PBS液洗涤后加入辣根过氧化物酶标记的二抗IgG,室温作用1h后二氨基联苯胺(3,3′-diaminobenzidine,DAB)显色,观察结果。超声波破菌后,细菌滤液采用亲和层析法纯化融合蛋白,将所得的融合蛋白溶液经透析除盐复性。
1.4 去除标签蛋白,获得PspA蛋白 肠激酶切除融合蛋白TRx-His-PspA溶液,取少量溶液经12%SDS-PAGE分析确认被切除部分分别是TRx-His和PspA后,将剩余溶液加入到Ni-Agarose His柱,滤去TRx-His蛋白,获得PspA蛋白,置于-80℃备用。
1.5 抗PspA抗体的制备 腹腔免疫小鼠。基础免疫:PspA 10g/只加完全弗氏佐剂;加强免疫:PspA 10g/只+不完全弗氏佐剂(每隔2周加强1次,连续2次);对照组只注射佐剂;第3次免疫1周后,眼眶取血行酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)检测免疫效果,用PspA蛋白包被酶标板,加小鼠血清,再加入二抗,显色后读取450 nm波长下各孔的吸光度,以高于阴性对照组2.1倍为阳性。
1.6 外周血中性粒细胞的分离 采集正常志愿者新鲜外周血,全血用没有二价阳离子的Hanks平衡盐缓冲液(Hanks balanced salt mixture,HBSS)稀释后形成连续的梯度分层;在室温下以500×g的速度离心30min后弃上清液,再将细胞置于1.5%右旋糖酐溶液中,200×g离心10min,吸取上清液。连续两次0.5×PBS的低渗裂解30s以去除红细胞;再用同等体积的1.75×PBS恢复等张,中性粒细胞计数。最后,中性粒细胞的形态分析评估其纯度大于98%,台盼蓝染色显示其活细胞所占比例大于96%。分离获得的中性粒细胞用RPMI-1640培养基培养,辅以10%和20mmol/L羟乙基哌嗪乙硫磺酸缓冲液。
1.7 PspA蛋白对中性粒细胞活力影响的噻唑蓝法分析 中性粒细胞(1×105细胞/孔)分别接种到96孔板,用10ng/mL、50ng/mL、100ng/mL、200ng/mL、500ng/mL浓度的 PspA蛋白分别处理中性粒细胞12h和24h,每孔加入10μL噻唑蓝溶液,继续培养4h,小心吸去孔内培养液,每孔加入200μL二甲亚砜,低速振荡10min,使结晶物充分溶解。在550nm处的吸光度测定吸光度,以量化有活性的中性粒细胞。
1.8 CXCL8浓度的测定 中性粒细胞接种于10cm培养皿中(5×106细胞/个),用10ng/mL、50ng/mL、100ng/mL、200 ng/mL浓度的PspA蛋白刺激中性粒细胞8h后提取总RNA,取1μg的总RNA,利用随机引物将其逆转录成cDNA。采用实时定量 PCR 扩增 CXCL8(上游引物:5′-GAC CAC ACT GCG CCA ACA CA-3′;下游引物:reverse,5′-ACC TCT TCA AAA ACT TCT CCC GAC-3′和β-actin(上游引物:5′-AGC GGG AAA TCG TGC GTG-3′;下游引物:5′-CAG GGT ACA TGG TGG TGC C-3′)。同时,用10ng/mL、50ng/mL、100ng/mL、200ng/mL浓度的PspA蛋白分别刺激中性粒细胞12h和24h,然后收集细胞培养上清液,采用ELISA测定CXCL8在无细胞上清液中的浓度。
1.9 实时定量PCR扩增CXCL8 中性粒细胞分两组接种于6孔板中(5×105细胞/个),一组加入PspA蛋白(100ng/mL)和抗PspA抗体(50μg/mL)孵育30min的混合物;另一组只加PspA蛋白(200ng/mL)不加抗体,处理24h后,采用实时定量PCR扩增CXCL8。
1.10 统计学处理 应用SPSS16.0软件进行统计学数据分析,组间比较采用t检验,组间比较采用单因素方差检验,以P<0.05为差异有统计学意义。
2 结 果
BL21/pET-32a(+)-PspA的诱导表达产物可见相对分子质量约70 000的蛋白条带,为PspA(相对分子质量50 000)与Trx-His(相对分子质量20 000)的融合蛋白条带(图1);重组蛋白与组氨酸单克隆抗体反应,在70 000左右处出现特异的反应条带,确证获得了带有6个组氨酸接头的融合蛋白(图2)。透析除去尿素,使融合蛋白复性(图3)。
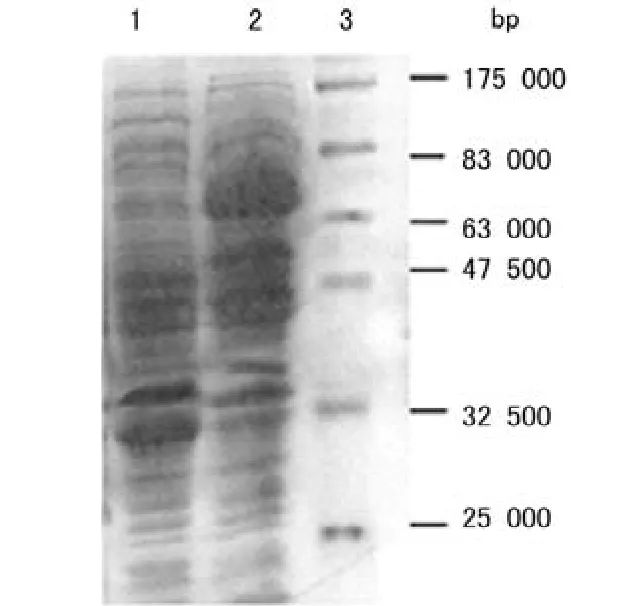
图1 融合蛋白的电泳图

图2 融合蛋白的Western-blot图
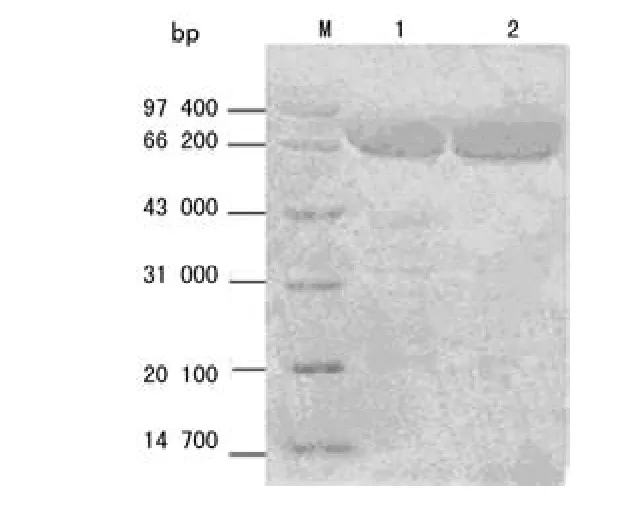
图3 纯化的融合蛋白的电泳图
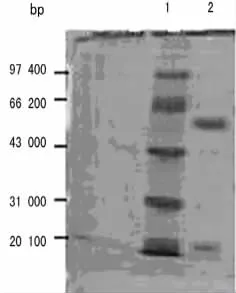
图4 融合蛋白酶切后的电泳图
切除融合蛋白TRx-His标签,获得PspA蛋白(图4)。高浓度的PspA蛋白引起宿主细胞的细胞毒作用是非常有限(图5)。PspA蛋白刺激中性粒细胞后,CXCL8的释放均呈剂量依赖性增强(图6,P<0.05),其中CXCL8水平在24h高于12h,CXCL8的释放在100~200ng/mL浓度时进入了一个平台期(图7)。当PspA蛋白被抗体中和后,CXCL8的释放明显下降(图8,P<0.05)。
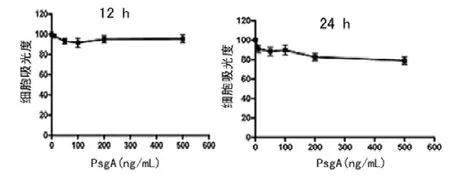
图5 PspA蛋白对中性粒细胞活力影响的线形图
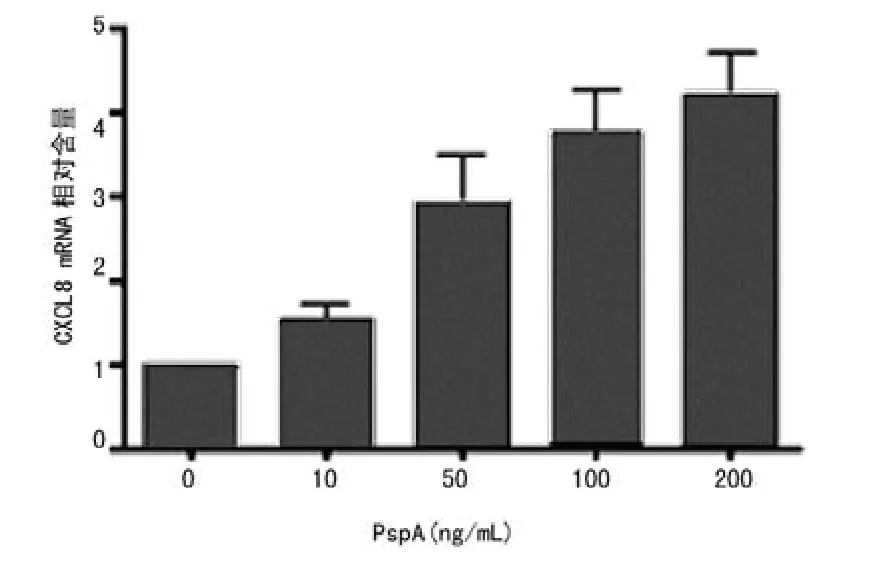
图6 中性粒细胞受PspA蛋白刺激后产生CXCL8的柱状图
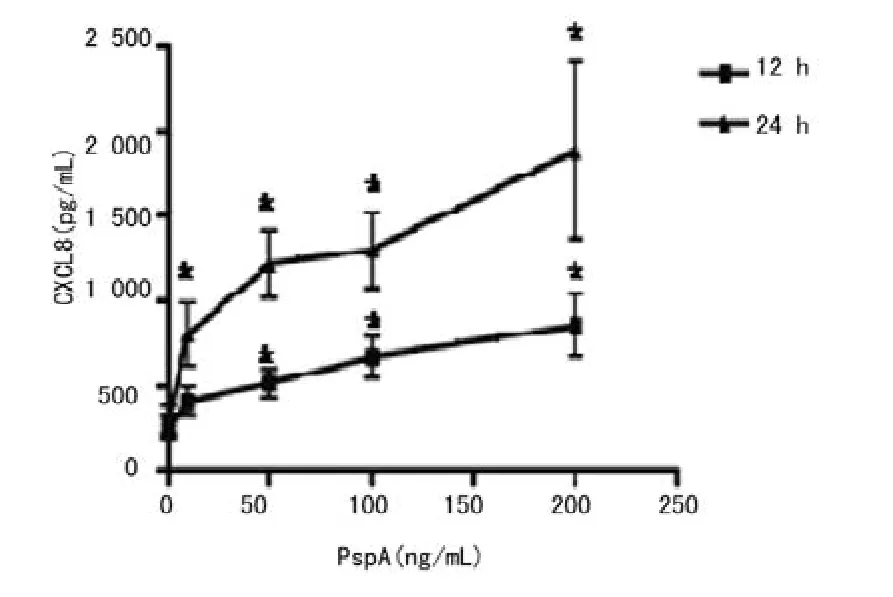
图7 PspA蛋白刺激中性粒细胞释放CXCL8的线形图
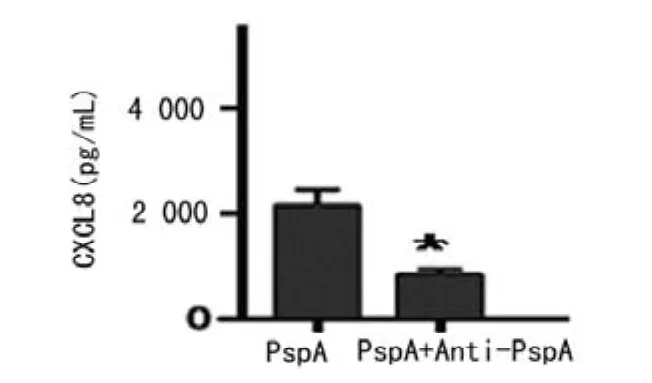
图8 PspA蛋白及其抗体影响CXCL8产生的柱状图
3 讨 论
肺炎链球菌的毒性蛋白,包括PspA已被证明在侵入性肺炎链球菌感染的发病机制中发挥关键作用[2-4]。PspA是肺炎链球菌的细胞表面蛋白,在目前分离出的所有肺炎链球菌菌株中都存在[5]。PspA的疫苗可以预防高危婴儿感染肺炎链球菌[6]。PspA是乳铁蛋白结合蛋白,它可以抑制由肺炎链球菌引起的补体活化[7]。同时,PspA可以保护肺炎链球菌避免受乳铁蛋白的杀伤作用[8]。此外,PspA在流感病毒感染后的继发性肺炎链球菌感染中也起作用[9]。
嗜中性粒细胞是固有免疫系统中主要的效应细胞,同时也参与适应性免疫反应[10]。嗜中性粒细胞是循环体系和组织中最丰富的白细胞,成为清除侵入性肺炎链球菌的主要成分。肺炎链球菌与中性粒细胞的相互作用激活了嗜中性粒细胞,使其吞噬肺炎链球菌并且合成了多种炎症介质,从而诱发炎症反应。这些炎症调节因子包括颗粒酶(如髓过氧化物酶、β-葡萄糖醛酸酶、弹性蛋白酶、明胶酶等)和细胞因子,特别是IL-9、肿瘤坏死因子α(tumor necrosis factorα,TNF-α)和转化生长因子α(transforming growth factorα,TGF-α)[11-12],这可能是嗜中性粒细胞防御侵入性肺炎链球菌感染的机制。由于嗜中性粒细胞是早期免疫应答的重要组成,所以肺炎链球菌如何调节中性粒细胞免疫功能对于解决侵入性肺炎链球菌的感染是非常重要的。嗜中性粒细胞通过一定的趋化因子,尤其是CXCL8[13],被招募到炎症部位。CXCL8是CXC趋化因子家族的成员之一,它可以刺激嗜中性粒细胞的吞噬功能,并上调该细胞表面黏附分子的表达,以及增强嗜中性粒细胞对内皮细胞的黏附。事实证明,侵入性肺炎球菌疾病中炎症部位的CXCL8浓度明显增加[15]。
本研究证明了PspA可以刺激中性粒细胞的CXCL8生产。由于CXCL8是一个强有力的中性粒细胞趋化因子,肺炎球菌毒性蛋白增加CXCL8的释放,招募更多的中性粒细胞在感染组织杀死肺炎链球菌。另一方面,过量生产CXCL8可以招募更多的中性粒细胞以及其他免疫细胞如淋巴细胞和嗜碱性粒细胞在炎症部位,放大炎症反应。事实上,肺炎链球菌引起的体液免疫反应就是细胞炎症因子和抗炎症因子在体内的差异调节[16]。所以,本实验探讨了在炎症反应中肺炎链球菌的这种毒力蛋白和CXCL8的功能联系,为弄清一系列炎症反应中免疫细胞和肺炎球菌致病因素之间的关系,制定新的战略来控制肺炎球菌侵入性疾病做铺垫。
[1]Cripps AW,Leach,AJ,Lehmann D,et al.Pneumococcal vaccination in developing countries[J].Lancet,2006,368(9536):644.
[2]Bogaert D,De Groot R,Hermans PW.Streptococcus pneumoniae colonisation:the key to pneumococcal disease[J].Lancet Infect Dis,2004,4(3):144-154.
[3]Koedel U,Scheld WM,Pfister HW.Pathogenesis and pathophysiology of pneumococcal meningitis[J].Lancet Infect Dis,2002,2(12):721-736.
[4]Farnworth SL,Henderson NC,Mackinnon AC,et al.Galectin-3reduces the severity of pneumococcal pneumonia by augmenting neutrophil function[J].Am J Pathol,2008,172(2):395-405.
[5]Bergmann S,Hammerschmidt S.Versatility of pneumococcal surface proteins[J].Microbiology,2006,152(2):295-303.
[6]Francis JP,Richmond PC,Pomat WS,et al.Maternal antibodies to pneumolysin but not to pneumococcal surface protein A delay early pneumococcal carriage in high-risk papua new guinean infants[J].Clin Vaccine Immunol,2009,16(11):1633-1638.
[7]Hammerschmidt S,Bethe G,Remane PH,et al.Identification of pneumococcal surface protein A as a lactoferrin-binding protein of Streptococcus pneumoniae[J].Infect Immun,1999,67(4):1683-1687.
[8]Shaper M,Hollingshead SK,Benjamin WH,et al.PspA protects Streptococcus pneumoniae from killing by apolactoferrin,and antibody to PspA enhances killing of pneumococci by apolactoferrin[J].Infect Immun,2004,72(9):5031-5040.
[9]King QO,Lei B,Harmsen AG.Pneumococcal surface protein A contributes to secondary Streptococcus pneumoniae infection after influenza virus infection[J].J Infect Dis,2009(4):537-545.
[10]Laskay T,van Zandbergen G,Solbach W.Neutrophil granulocytes as host cells and transport vehicles for intracellular pathogens:apoptosis as infection-promoting factor[J].Immunobiology,2008,213(3/4):183-191.
[11]Navarini AA,Lang KS,Verschoor A,et al.Innate immuneinduced depletion of bone marrow neutrophils aggravates systemic bacterial infections[J].Proc Natl Acad Sci USA,2009,106(17):7107-7112.
[12]Foley SC,Hamid Q.Images in allergy and immunology:neutrophils in asthma[J].J Allergy Clin Immunol,2007,119(5):1282-1286.
[13]Dogan S,Zhang X,Pridmore AC,et al.Pneumolysin-induced CXCL8production by nasopharyngeal epithelial cells is dependent on calcium flux and MAPK activation via Toll-like receptor 4[J].Microbes Infect,2011,13(1):65-75.
[14]Herbold W,Maus R,Hahn I,et al.Importance of CXC chemokine receptor 2in alveolar neutrophil and exudate macrophage recruitment in response to pneumococcal lung infection[J].Infect Immun,2010,78(6):2620-2630.
[15]Koedel U,Scheld WM,Pfister HW.Pathogenesis and pathophysiology of pneumococcal meningitis[J].Lancet Infect Dis,2002,2(12):721-736.
[16]Khan AQ,Shen Y,Wu ZQ,et al.Endogenous pro-and anti-inflammatory cytokines differentially regulate an in vivo humoral response to streptococcus pneumoniae[J].Infect Immun,2002,70(2):749-761.
Influence of pneumococcal surface protein A on human neutrophils releasing CXCL8
XuLei1,ChenDan2,GanPing3,CaoJu4
(1.DepartmentofPathobiology,ChongqingMedicalUniversity,Chongqing400016,China;2.Departmentof Pharmacy,ChongqingJiansheHospital,Chongqing400050,China;3.DepartmentofInternalMedicine,Children′sBranchHospital,ChongqingSanxiaCentralHospital,Chongqing404000,China;4.Departmentof Laboratory,FirstAffiliateHospital,ChongqingMedicalUniversity,Chongqing400016,China)
ObjectiveTo investigate the influence of prokaryotic express pneumococcal surface protein A(PspA)on CXCL8releasing from human neutrophils.MethodsThe recombinant plasmid pET-32a(+)/PspA was transformed into E.coli BL21(DE3).The fusion protein TRx-His-PspA was expressed and digested by enterokinase after purification,in order to get protein PspA.Then mice were immunized with protein PspA to get the anti-PspA antibodies.Protein PspA single or mixed with anti-PspA antibodies was added in the medium of human neutrophils for coincubation.Later the CXCL8producing and releasing from neutrophils were detected.ResultsThe fusion protein TRx-His-PspA was expressed and purified successfully.The protein PspA was obtained after digested by enterokinase.The anti-PspA antibodies with high titer were gotten from the immunized mice.After the protein PspA adding in the medium of human neutrophils,the neutrophils were detected to produce and release more CXCL8by real-time quantitative polymerase chain reaction and enzyme-linked immunosorbent assay(P<0.05).On the other side,the anti-PspA antibodies could reduce the ability of protein PspA to stimulate the CXCL8producing and releasing.ConclusionThe protein PspA could induce human neutrophil synthesizing and releasing chemokine CXCL8,which reveals the relationship between neutrophils and Streptococcus pneumoniae.
streptococcus pneumoniae;membrane proteins;neutrophils;CXCL8
10.3969/j.issn.1671-8348.2012.14.020
A
1671-8348(2012)14-1397-03
2011-12-25
2012-02-05)

