论无创血糖监测的红外光谱方法( 特邀)
陈星旦 ,高 静,丁海泉
(1.中国科学院 长春光学精密机械与物理研究所 应用光学国家重点实验室,吉林 长春130033;2.中国科学院 研究生院,北京100049)
1 引 言
提高人民健康水平是21 世纪我国面临的巨大挑战,重大疾病的防治成为我国乃至国际医疗卫生事业的主要问题。《国家中长期科学技术和发展规划纲要( 2006 ~2020) 》提出: 重大疾病防治要战略前移,要重点研究开发早期预警和诊断等关键技术,尽量做到早预防、早发现、早治疗。
糖尿病是一种常见的慢性代谢疾病,与心血管病、癌症并称为人类健康的三大杀手,严重威胁着人类的健康。根据国际糖尿病联合会( IDF) 的最新数据,全球约有3.66 亿人患有糖尿病,每年有460 万人死于糖尿病,预计到2030 年,全球糖尿病人数将达到5.5 亿。我国是糖尿病患病率增长速度最快的国家之一,糖尿病患病率高达10%。此外,我国另有16%的人已处在糖尿病患病前期。糖尿病人自身缺乏对血糖的调节能力,体内的葡萄糖水平易处于正常范围之外,这会导致心脑血管病变、肾衰竭、失明等并发症。
另外,在临床上,重症病人不论是否糖尿病患者,也不论是外科还是内科患者,也常出现高血糖。即使既往没有糖代谢紊乱的基础病史,应激性高血糖亦非常普遍。高血糖会降低人机体的免疫功能,如T 淋巴细胞水平改变,吞噬细胞的吞噬杀伤功能下降等。此外,微生物在高糖环境下生长繁殖迅速,将导致许多严重并发症的发生,因此在重症监护病房( ICU) 也应对患者进行严格的血糖控制。
2001 年,比利时Van Den Berghe 等人在《新英格兰医学杂志》首次提出“严格血糖控制( Tight G1ycemoc Control,TGC) ”治疗概念[1],即通过强化胰岛素治疗( Intensive Insulin Therapy,IIT) ,将危重患者的血糖控制在正常范围内,可大幅度降低危重患者院内病死率和多种并发症的发生率。控制血糖低于7.8 mmol/L(140 mg/dL) 可使住院死亡率下降29.3%,新发的肾功能衰竭降低75%,在ICU 的住院天数下降10.8%[2]。
目前,糖尿病的治疗尚无有效手段,只能通过改善血糖水平,降低或延缓并发症的发病率。这需要患者尽可能多次地对血糖水平进行测量,以便根据血糖水平的实际情况,及时地调整治疗方案。重症病人亦需要通过血糖监测,研究制定出更加科学的TGC 治疗方案来有效地降低ICU 患者死亡率和并发症的发病率。
常规的血糖测量手段需要从静脉( 抽血) 或者从毛细管( 通过针刺患者手指指尖处) 取血后,再用血糖分析仪进行测定。这种常规的方法会给病人带来疼痛且存在感染的危险,还需要试剂或试纸等消耗品,不适合频繁进行,因此直接影响给药剂量及服用时机的精确性。
按照世界卫生组织( WHO) 要求,糖尿病患者的血糖水平每天至少需要检测4 次,目前大多糖尿病患者每日实际测量次数达不到要求。人们企盼一种准确、无创、简便、快速的方法实现血糖水平的测量,以克服常规测量方法存在的不足[3]。无创血糖测量技术有望从根本上改善全球数亿糖尿病患者的生活质量,有效降低日常血糖测量所带来的经济负担,是指导糖尿病治疗、重症病人监护以及反映人体糖代谢能力的有效手段,具有非常重要的社会和现实意义。
2 无创血糖监测的光学方法
近些年,无创血糖监测成为国内外相关领域研究的热点。其中,光学方法具有快速、无创伤、信息多维化等特点,是目前无创伤血糖监测的主要研究领域。从已经报导的结果来看,所使用的光学方法主要有旋光法、光学相干断层成像法、拉曼光谱法、红外光谱法等。
光学方法是将光作为信息的载体,当光经过人体组织并与其相互作用后,出射光的性质发生了变化,最终反映在携带了相关生化成分信息的光信号中。然后,通过数学方法从光信号里提取出与待测成分有关的信息,建立光信号与生化成分信息之间的关系模型,进而实现人体组织中葡萄糖含量的测量。
2.1 旋光法
手性分子对左、右旋偏振光的折射率不同,通过测量经过样品后偏振光的偏振方向变化,可以间接测量待测物的浓度。旋光度可以由下式来表达:

式中:aλ为波长为λ 下的旋光系数,单位为dm-1( g/L)-1;l为光程,单位为dm;c为溶液的浓度,单位为g/L。通过检测特定波长偏振光经人体组织后的旋光度,可以计算组织中葡萄糖的含量。
1982 年,美国俄克拉荷马大学的March 和Rabinovitch 等人[4]首次提出通过测量眼球前房水的旋光来间接估计血糖水平。2005 年,美国德州A&M 大学的Gerard L.Coté 等人[5]用双波长偏振光测量人眼部位的血糖浓度。2006 年,台湾清华大学的Chien-ming Wu 等人[6]使用外差旋光仪测量旋光活性介质,定量分析的标准差( Standard Error of Calibration,SEC) 为1.4 mmol/L。
目前,旋光法的研究大多采用灵敏度高的外差法,但外差法对相位变化信息较为敏感,需频繁校准。同时,该方法的准确度、重复性还不能达到血糖测量的临床要求。
2.2 光学相干断层成像法
光学相干断层成像( Optical Coherence Tomography,OCT) 技术自第一次被用于眼睛断层成像以来,在生物诊断领域得到了迅速发展。该技术采用低相干光源,人体组织反向散射的光和从干涉仪参考臂返回的光混合,形成相干光,且只有在它们之间的光程差小于相干长度时才会出现。通过测量采样臂散射反射光和参考臂反射光的干涉图像,可以实现深度鉴别[7]。同时,分析物的散射系数会随待分析成分的浓度变化而改变,可以用来测量浓度信息。
德州大学医学科加尔维斯顿分校的Esenaliev R.O.等人[8]结合口服葡萄糖耐量实验( Oral Glucose Tolerance Test,OGTT) ,通过测量皮肤的OCT信号,发现OCT 信号与血糖浓度的相关性较好(0.8≤r≤0.95) 。
OCT 测量血糖的干扰源与其它散射技术一样,主要来自于人为移动、组织的不均匀性等[9]。
2.3 拉曼光谱法
拉曼光谱( Raman Spectra,RS) 分析是基于印度科学家C.V. Raman 发现的拉曼散射效应的一种分析方法,通过测量入射光频率与散射光频率的差异也就是拉曼位移来分析分子的振动、转动等信息。拉曼光谱线比较尖锐,特异性较好,是分析生物分子与组织变化的强有力工具。
利用拉曼光谱高精度定量分析葡萄糖时,不得不考虑拉曼光谱的重叠问题[10];该方法的主要的局限性是拉曼光谱信号非常微弱,易受到干扰。近几年,有研究者利用拉曼共聚焦显微技术分析眼睛前房水中葡萄糖浓度[11],获得了较好的精度,但临床应用的安全性及眼房水中葡萄糖对血糖的可替代性仍需进行评估。
2.4 红外光谱法
红外光谱法通过测量生物组织的吸收光谱,提取出反映葡萄糖分子的结构和状态信息,实现血糖的定量分析。根据工作波段,该方法又分为近红外光谱法和中红外光谱法。
近红外光谱( Near Infrared Spectroscopy,NIRS) 区域是指波长在780 ~2 500 nm 的电磁波,主要反映了C—H、N—H、O—H 等含氢基团振动的合频及倍频吸收信息。在此波段,不同成分的吸收峰重叠严重,是一度被人们忽视的区域。但随着化学计量学、计算机、高性能的光学材料及光电子器件等各种先进技术的发展,利用这一波段进行光谱分析的优势逐渐展现出来。
近红外光在生物组织中的穿透深度能达到数毫米,能够到达含有血液的组织部位,光谱信息较为丰富,非常适合用于分析生物组织内部的物理及化学参数。在无创血糖测量领域,近红外光谱被众多研究团队关注,并投入了巨大的精力。其基本原理是通过测量人体某部位的近红外吸收光谱,然后利用化学计量学方法,从人体近红外光谱中提取出与葡萄糖相关的吸收信息。
与近红外光谱相比,中红外光谱( Mid-infrared Spectroscopy,MIR) 主要反映分子振动的基频吸收。不同分子之间的吸收相对独立,较容易提取待分析物的吸收信息;同时,由于人体生物组织对中红外光的吸收较强,光谱对物质浓度变化的响应较灵敏。
3 红外无创血糖监测的主要问题分析
美国的Norris 在1991 年的第4 届国际近红外光谱学会议上发表了“近红外在医学上的可能应用”[12],激发了近红外光谱工作者研究无创伤血糖监测技术的热情。上世纪90 年代以来,发表了大量的论文和专利。
利用近红外进行无创血糖监测研究时,可以用透射方式,也可以用反射方式进行测量,测量部位也比较灵活,有关耳垂、口腔黏膜、指尖、前额、嘴唇、舌头、手臂、脸等部位的研究均有报导。
德国H.M.Heise 等人[13]对人口腔黏膜处在1 111 ~1 835 nm 的近红外漫反射谱进行了研究,结合单一个体的OGTT,建立了分析血糖定标模型预测标准差( Standard Error of Prediction,SEP)为2.4 mmol/L。美国爱荷华大学Arnold[14]小组针对葡萄糖、三乙酰甘油酯、尿素、抗坏血酸盐、乳酸盐、丙氨酸等成分组成的模拟溶液,通过测量其光谱( 见图1) ,计算了这些生化成分在一级倍频波段( 1 550 ~1 850 nm) 与合频波段( 2000 ~2 500 nm) 的摩尔吸收系数;并分别利用这两个谱区的光谱数据建模。结果认为,利用近红外光谱技术分析某些生化指标是可行的,且合频波段光谱比一级倍频波段光谱更适合生化成分的检测。德国的K.Danzer 等人[15]利用光纤探头测量了手指在800 ~1 350 nm 的漫反射谱,结合单一个体的数据,所得定标模型的SEP 为2.0 mmol/L。陈文亮等人[16]设计并搭建了基于声光可调滤波器的近红外无创血糖测量系统,并在OGTT 过程中,单体建模得到了较好的结果。美国的S. F. Malin等人[17]在35 天内,针对7 名糖尿病人,随机采集其手臂处在1 050 ~2 450 nm 的近红外光谱,选出其中3 人的数据用于建立定标模型,得到的SEP为1.41 mmol/L。A.Sämann等人[18]研究了近红外无创血糖方法中定标模型的长期稳定性。
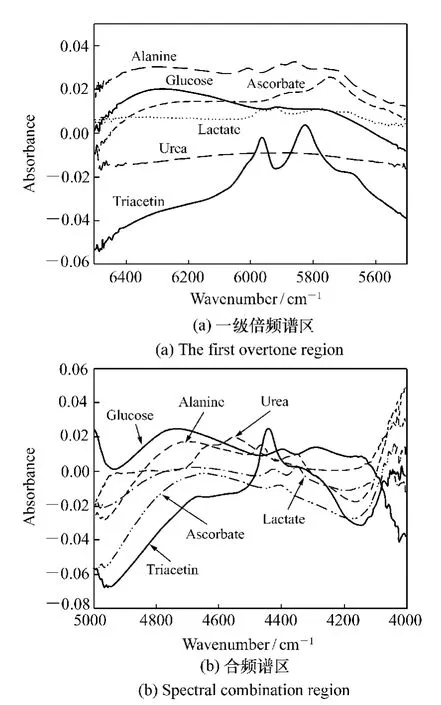
图1 在第一倍频和合频谱区,葡萄糖、乳酸、丙氨酸、抗坏血酸盐、甘油醋酸酯和尿素的吸收光谱图Fig.1 Absorbance spectra of glucose,lactate,alanine,ascorbate,triacetin,and urea over the first overtone and spectral combination regions
上述近红外无创血糖监测方法都是直接从获取的人体近红外光谱中提取血糖的吸收信息,取得了一些初步的研究成果。具体来讲,利用单一个体的OGTT 数据能获得不错的分析结果; 但针对多人或单人长期的数据来说,结果还不够理想。近红外无创血糖监测面临的主要困难[19]可以归纳如下:
(1) 葡萄糖吸收信号非常微弱,且与人体中其它生化成分的吸收相互重叠、相互干扰。人体近红外光谱中,水、脂肪、皮肤、肌肉、以及骨骼等人体组织背景吸收贡献很大,这些因素不但会影响仪器的噪声、光谱的散射及基线漂移性质,还会产生不同程度的吸收干扰,导致微弱的葡萄糖吸收信息很难被提取出来。
(2) 组织背景吸收具有复杂、时变、存在部位差异的特点,给近红外化学计量学定标模型的长期稳定性带来了困难。
对于中红外光谱,葡萄糖分子的基频吸收主要在1 200 ~900 cm-1( 约8 ~11 μm) 之间。上世纪80 年代,德国的N. Kaiser 首次提出结合二氧化碳激光器与衰减全反射( Attenuated Total Reflection,ATR) 来实现血液中葡萄糖测量的方法[20]。20 年来,出现了大量利用中红外测量全血、血清及血浆中葡萄糖含量的报导。
美国伍斯特理工学院的Y. Mendelson 等人[21]利用在9.2 ~10.8 μm 波长可调的二氧化碳激光器,结合ATR 测量方式搭建了一套用于分析血液中葡萄糖含量的测试系统,并利用该系统对98 个血糖值分布在2.67 ~15 mmol/L 的猪血样品中的葡萄糖进行了分析,测量值与真实值之间相关系数达到0.969。德国的H.M.Heise等人[22]利用全血的衰减全反射傅里叶变换光谱( ATR-FTIR) ,结合偏最小二乘回归法( PLSR) 分析了全血中葡萄糖的含量,SEP 为1.1 mmol/L,在用ATR方式进行测量时,蛋白质不容易从ATR 晶体表面上清除,会对其它样品的光谱产生影响,进而影响分析结果的精度。奥地利维也纳科技大学R.Vonach 等人[23]利用全血样品的中红外透射谱( 见图2) ,结合PLSR 建立了分析血糖的定标模型,其SEP 为0.83 mmol/L。美国新墨西哥大学医学院K.J.Ward 等人[24]利用全血的ATR-FTIR光谱,研究了6 个志愿者的餐后血糖,所建立PLSR 校正模型的校准精度为 0.61 ~0.72 mmol/L。韩国的Y. J. Kim 等人[25]通过测量全血的ATR-FTIR 光谱,分析了血红蛋白对分析全血样品中葡萄糖含量的影响,所建模型的相对分析精度为5.9%。英国剑桥大学Y. C. Shen等人[26]研究了28 个病人的全血样品,利用PSLR结合950 ~1 200 cm-1的数据建立了分析葡萄糖的定标模型,并用独立的数据集进行预测,SEP 为10.6 mg/dL(0.59 mmol/dL) ; 只考虑单独一个人血浆样品的光谱时,其二阶导数谱在1 082 cm-1或1 093 cm-1处的强度与葡萄糖含量之间存在较好 的 相 关 性, SEP 为 17.1 mg/dL(0.95 mmol/dL) 。捷克的G.Budinova 等人[27]首先把一批全血和血清样品涂在不同聚乙烯载片上,待样品干燥后,测量其中红外光谱,结合PLSR建立了分析样品中葡萄糖含量的定标模型,所得预测残差平方和的均值为1.24 mmol/L,与用ATR 方式所得结果相当。加拿大国家研究院R.A.Shaw等人[28]对血清样品中的葡萄糖进行了分析,SEP 为0.41 mmol/L。
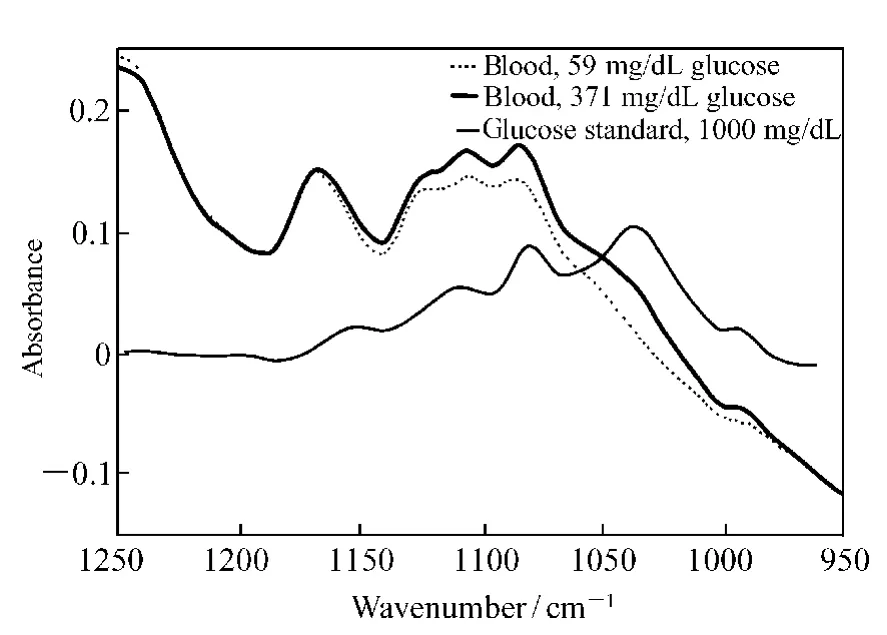
图2 在葡萄糖吸收光谱基频区,血液中葡萄糖含量分别为59 mg/dL、371 mg/dL 以及葡萄糖标准溶液为1 000 mg/dL 时的光谱图Fig.2 Spectra of blood(59 mg/dL) ,blood added with glucose(371 mg/dL) ,and glucose standard solution(1 000 mg/dL) in the absorptive spectral range of the glucose
中红外光谱分析技术在无创血糖测量领域的研究,也有近20 年的历史。日本熊本大学的K.Kajiwara 等人[29]利用ATR 技术获取了口腔黏膜的中红外光谱,发现二阶导数谱在1 033 cm-1处的强度值与血糖值存在相关,并分析了以基线漂移为特征的人体背景干扰问题。德国的H. Von Lilienfeld-Toal 等人[30]用两个输出波长为1 080和1 066 cm-1的激光器作光源,测量前臂处皮肤的光声信号,发现信号强度与血糖值之间的有一定的相关性。
为了提高人体皮肤的ATR-FTIR 光谱与血糖水平之间的相关性,日本信州大学H.Ishizawa 等人[31]用角鲨烷涂抹在测量部位后,再进行光谱采集。一方面角鲨烷可以用作内标物以校正光谱;另一方面,角鲨烷被皮肤吸收的同时,皮肤也会吸收水分。皮肤角质层中水分的增加会削弱角质层的屏障功能,使皮肤分泌物更容易到达皮肤表面,从而增强了ATR-FTIR 光谱中与待分析物吸收有关的信息,有利于提高分析精度,但没有获得突破性的结果。
中红外光谱无创血糖测量方法也同样面临巨大困难,面临的问题可归纳为以下两个方面:
(1) 利用ATR 技术只能识别皮肤表层不超过5 μm 厚度的光谱,这个厚度与表皮角质层的厚度相当,而角质层内是不含葡萄糖的。因此,利用ATR 技术进行无创血糖测量,必须破坏角质层的结构。
(2) 人体皮肤的中红外光谱中由葡萄糖产生的吸收信号非常微弱,从测量信号中提取出与血糖相关的信息非常困难;组织背景的干扰复杂、多变。近红外光谱方法存在的问题在中红外光谱方法中也同时存在。
4 红外无创血糖监测的最新进展
考虑到人体组织背景的干扰问题,研究者们试图把组织背景的吸收信息单独剥离出去,以避免或抑制人体背景吸收的干扰。本文作者曾提出一种基于血流容积变化的光谱相减法[32-34]。该方法认为: 短时间内,人体背景的物理、化学参数不会改变,而血流的容积一直在变。对于短时间内获取的不同血流容积下的人体近红外光谱,通过相减,得到引起容积差异的那部分血液的近红外光谱,可以消除人体背景带来的干扰。这一方法要求光谱测试仪器要有足够高的信噪比,以保证从得到的纯血液光谱中提取出葡萄糖的吸收信息。日本金沢大学的Y. Yamakoshi 等人[35]基于脉搏变化设计并搭建了一套近红外光谱无创血糖测量系统,利用该测量系统,取得了初步的实验结果。基于血管中血流量呈周期性变化的事实,天津大学的李刚等人[36]提出“动态光谱”理论,提取出相应脉动动脉血液的吸光度,为无创血液生化成分检测的临床应用提供了条件。天津大学的徐可欣等人[37]提出浮动基准法,该方法选择吸光度变化量与待测对象的浓度变化无关的“浮动基准”,该基准处的吸光度变化反映了各种干扰因素对光谱的影响,因此可以通过内部参考对光谱进行修正。该方法的难点在于如何寻找有一定适应性的“浮动基准”位置。美国爱荷华大学的M.A.Arnold 等人[38]利用净信息分析结合实验设计对非葡萄糖成分吸收的干扰信息进行消除,并且从动物的近红外光谱中提取出了类似葡萄糖吸收的光谱特性,但该方法对人为移动、接触压力变化等因素的干扰比较敏感。
还有一种观点认为,用近红外光谱进行无创血糖测量时,作为分析目标的葡萄糖来自于毛细管血,而被近红外光“看见”的葡萄糖来源还包括组织间液( ISF) 。如果ISF 中与毛细管血中的葡萄糖浓度存在差异,则仅用毛细管血中的葡萄糖浓度作为参考值进行定标,势必会影响分析结果的精度。因此,研究血液与ISF 中葡萄糖含量之间的关系,有助于减小分析误差。瑞典P.Lönnroth 等人[39]利用微透析技术,收集了健康人的皮下ISF,发现在血糖水平不变的条件下,血浆与ISF 中的葡萄糖浓度高度一致。瑞典哥德堡大学P.A.Jansson 等人[40]用同样的技术,研究了在OGTT 及高血糖症条件下,血浆与ISF 中葡萄糖浓度之间的关系,发现在ISF 与血浆中的葡萄糖浓度之间存在时间延迟,延迟量取决于葡萄糖的注入速度。美国明尼苏达大学的J. P. Bantle 等人[41]利用微针技术获取了I 型糖尿病人餐前与餐后5 h 内皮肤真皮层中的ISF,发现其中的葡萄糖浓度与血浆中的没有明显的差异。美国的S.N.Thennadil 等人[42]同样利用抽吸起泡技术获取了真皮层中ISF,没有发现其中葡萄糖浓度与毛细管血中的存在差别。
由于葡萄糖从血液渗透到ISF 中需要时间,当血液中葡萄糖浓度变化较快( 如OGTT 实验)时,血液中的葡萄糖浓度与ISF 中的会存在差异。但普遍认为,ISF 可以代替血液用于血糖水平的测量。
5 结束语
无创血糖监测的红外光谱方法研究,至今已经历了20 多年。最初几年,由于当时近红外光谱分析在农业、食品等领域取得了成功的应用;而无创血糖监测又具有重要的科学意义和社会需求,加之可预期的巨大市场,所以许多公司纷纷介入。他们热衷于申请专利,开发样机,一时报纸杂志争相报道,似乎已经在市场上可以买到这种仪器了。但没过多久,这股热潮慢慢冷却,这主要是因为大家对分析对象的复杂性认识不足,研制的仪器所测得的光谱与血糖浓度变化的相关性很差。因此,随后的十多年,许多大学的科研小组深入进行了一些基础性研究。如人体组织光学参数的测量,光在组织中传播行为的描述,各种模拟溶液及人体血液、血清等样品葡萄糖浓度的定量分析以及定标模型研究等。而这些工作,大多是在实验室利用已有的仪器进行的。真正意义上的无创测量,只有少数人利用经过简单改装的仪器,做了一些工作。到目前为止,这些工作获得的葡萄糖含量SEP 平均值为: 血清0.5 mmol/L,全血1.5 mmol/L,无创3 mmol/L。
许多研究者总结无创血糖监测面临的难题认为:首先是被测对象为复杂的人体,光在人体组织中的传播以及组织中血糖浓度的分布与变化规律尚未完全把握;其次是血糖浓度变化引起的光谱信号起伏极其微弱且其特异性差; 人体组织作为光谱测量的背景,既强且多变而又无力控制,导致测量条件难以再现,无法实现背景扣除。
展望下一步工作,无论是基础研究还是测量方法、技术与仪器的研究,都还有很长一段路程要走。大体上要从以下几个方面进行更深入的研究。
(1) 人体组织是一个对光高散射、高吸收的物理介质,这个介质的光学参数在较长的光学波段,特别是葡萄糖分子振动的基频区和合频区,还没有可靠的实验数据。当这个波段的光入射到人体组织时,漫反射出来带有吸收信息的光子,主要分布在与入射位置非常靠近的区域,这些光子的光学性质、传输路径、光程分布等都需要有进一步理论与实验的精确描述。
(2) 在红外区,光对组织的穿透深度很浅,在葡萄糖分子吸收的基频波段,穿透深度大约数十微米量级,合频波段数百微米量级,第一倍频波段1 mm 量级。这些深度表明,光只进入人体皮肤的表皮和真皮层。而表皮层不含有血液,只含有组织液;真皮层的下部含有毛细血管,此处血液和组织液共存。近期发表的资料[43]显示,表皮与真皮中的组织液含量分别为15% ~35%,35% ~45%;血浆含量分别为0,0.7% ~9%。对血液和组织液中葡萄糖浓度的分析表明: 后者能获得较高的精度,因此利用合频和基频波段,使光与组织的作用局限在皮肤的表皮内或表皮与真皮的浅层,能获得较好的结果。
(3) 角质层是人体皮肤的最外层,厚度为微米量级,它对表皮中的组织液起对外渗出的屏蔽作用。因此,应该研究如何提高角质层对表皮中组织液的通透性。利用无创伤方法,对角质层结构进行破坏,以形成组织液向外渗透的通道[44]。
(4) 血糖变化引起光谱信号的起伏极其微弱,因此光谱分析仪器的信噪比至关重要。提高仪器信噪比的一个主要途径是提高入射光源的亮度和分光系统的效率,而最有效的办法是光源采用可调谐半导体激光器,目前可调谐量子级联半导体激光器用于中红外血糖监则已初见端倪。采用可调谐半导体激光器以后,由于光谱宽度只有几十纳米( 合频) 或几十波数( 基频) ,建立某个葡萄糖吸收带的定标模型,将有利于抑制背景的干扰。
[1] BERGHE G V D,WOUTERS P,WEEKERS F,et al.. Intensive insulin therapy in critically ill patients[J].N. Engl. J Med.,2001,345(19) :1359-1367.
[2] KRINSLEY J S. Effect of an intensive glucose management protocol on the mortality of critically ill adult patients[J].Mayo. Clin. Proc.,2004,79(8) :992-1000.
[3] JONES M,HARRISON J M. The future of diabetes technologies and therapeutics[J].Diabetes Technol. Ther.,2002,4(3) :351-359.
[4] RABINOVITCH B,MARCH W F,ADAMS R L. Noninvasive glucose monitoring of the aqueous humor of the eye:part I.measurement of very small optical rotations[J].Diabetes Care,1982,5(3) :254-258.
[5] WAN Q,DIXON J B,COTÉ G L. Dual-wavelength polarimetry for monitoring glucose in the presence of varying birefringence[J].J. Biomedical Optics,2005,10(2) :024029-1-024029-8.
[6] WU C M,TSAI Y C. Angular displacement-enhanced heterodyne polarimeter for the measurement of optically active media[J].Sensors and Actuators B,2006,120:324-328.
[7] LARIN K V,MOTAMEDI M,ASHITKOV T V,et al.. Specificity of noninvasive blood glucose sensing using optical coherence tomography technique:a pilot study[J].Phys. Med. Biol.,2003,48:1371-1390.
[8] ESENALIEV R O,LARIN K V,LARINA I V,et al.. Noninvasive monitoring of glucose concentration with optical coherence tomography[J].Opt. Lett.,2001,26(13) :992-994.
[9] SAPOZHNIKOVA V V,PROUGH D,KURANOV R V,et al.. Influence of osmolytes on in vivo glucose monitoring using optical coherence tomography[J].Exp. Biol. Med.,2006,231:1323-1332.
[10] YONZON C R,HAYNES C L,ZHANG X,et al.. A glucose biosensor based on surface-enhanced Raman scattering:improved partition layer,temporal stability,reversibility,and resistance to serum protein interference[J].Anal. Chem.,2004,76(1) :78-85.
[11] CASPERS P J,LUCASSEN G W,PUPPELS G J. Combined in vivo confocal Raman spectroscopy and confocal microscopy of human skin[J].Biophys. J.,2003,85(1) :572-580.
[12] NORRIS K. Possible Medical Applications of NIR[C]. Aberdeen,1992,Making light work: advances in near infrared spectroscopy UK,1992:596-602.
[13] HEISE H M,MARBACH R. Effect of data pretreatment on the noninvasive blood glucose measurement by diffuse reflectance NIR spectroscopy[J].SPIE,1994,2089:114-115.
[14] CHEN J,ARNOLD M A,SMALL G W. Comparison of combination and first overtone spectral regions for near-infrared calibration models for glucose and other biomolecules in aqueous solutions[J].Anal. Chem.,2004,76(18) :5405-5413.
[15] DANZER K,FISCHBACHER C H,JAGEMANN K U,et al.. Near-infrared diffuse reflection spectroscopy for non-invasive blood-glucose monitoring[J].LEOS Newslett,1998,12:9-11.
[16] 陈文亮,等.1100 ~1700 nm 近红外光谱无创血糖测量的OGTT 实验研究[J].生物医学工程学杂志,2004,21(5) :824-827.CHEN W L,et al.. Experimental research on OGTT for noninvarisve blood glucose detection through near-infrared spectroscopy ranging from 1100 nm to 1700 nm[J].J. Biomed. Eng.,2004,21(5) :824-827.( in Chinese)
[17] MALIN S F,RUCHTI T L,BLANK T B,et al.. Noninvasive prediction of glucose by near-infrared diffuse reflectance spectroscopy[J].Clinical Chemistry,1999,45(9) :1651-1658.
[18] SÄMANN A. Non-invasive blood glucose monitoring by means of near infrared spectroscopy:investigation of long-term accuracy and stability[J].Exp. Clin. Endocrinol. Diabetes,2000,108(6) :406-413.
[19] 丁海泉,卢启鹏,彭忠琦,等. 近红外光谱技术用于无创生化检验研究的进展[J]. 光谱学与光谱分析,2010,30(8) :2107-2110.DING H Q,LU Q P,PENG Z Q,et al.. Progress in noninvasive biochemical examination by near infrared spectroscopy[J].Spectroscopy and Spectral Analysis,2010,30(8) :2107-2110.( in Chinese)
[20] KAISER N. Laser absorption spectroscopy with an ATR prism[J].IEEE Trans. Biomed Eng.,1979,26(10) :597-600.
[21] MENDELSON Y,CLERMONT A C,PEURA R A,et al.. Blood glucose measurement by multiple attenuated total reflection and infrared absorption spectroscopy[J].Biomedical Engineering,1990,37(5) :458-465.
[22] HEISE H M,MARBACH R,JANATSCH G,et al.. Multivariate determination of glucose in whole blood by attenuated total reflection infrared spectroscopy[J].Anal. Chem.,1989,61(18) :2009-2015.
[23] VONACH R,BUSCHMANN J,FALKOWSKI R,et al.. Application of mid-infrared transmission spectrometry to the direct determination of glucose in whole blood[J].Appl. Spectroscopy,1998,52(6) :820-822.
[24] WARD K J,HAALAND D M,ROBINSON M R,et al.. Post-prandial blood glucose determination by quantitative mid-infrared spectroscopy[J].Appl. Spectroscopy,1992,46(6) :959-965.
[25] KIM Y J,HAHN S,YOON G.. Determination of glucose in whole blood samples by mid-infrared spectroscopy[J].Appl.Opt.,42(4) :745-749.
[26] SHEN Y C,DAVIES A G,LINFLELD E H,et al.. The use of fourier-transform infrared spectroscopy for the quantitative determination of glucose concentration in whole blood[J].Physics in Medicine and Biology,2003,48(13) :2023-2032.
[27] BUDÍNOVÁ G,SALVA J,VOLKA K. Application of molecular spectroscopy in the mid-infrared region to the determination of glucose and cholesterol in whole blood and in blood serum[J].Appl. Spectroscopy,1997,51(5) :631-635.
[28] SHAW R A,KOTOWICH S,LEROUXAND M,et al.. Multianalyte serum analysis using mid-infrared spectroscopy[J].Ann. Clin. Biochem.,1998,35:624-632.
[29] KAJIWARA K,UEMURA T,KISHIKAWA H,et al.. Noninvasive measurement of blood glucose concentrations by analyzing fourier transform infra-red absorbance spectra through oral mucosa[J].Med.&Biol. Eng. Comput,1993,31:S17-S22.
[30] LILIENFELD-TOAL H V,WEIDENM LLE M,XHELAJ A,et al.. A novel approach to non-invasive glucose measurement by mid-infrared spectroscopy:the combination of quantum cascade lasers( QCL) and photoacoustic detection[J].Vibrational Spectroscopy,2005,38:209-215.
[31] ISHIZAWA H,MURO A,TAKANO T,et al.. Non-invasive blood glucose measurement based on ATR infrared spectroscopy[C]//SICE Annual Conference,2008,Tokyo,Japan,20-22 Aug,2008:321-324.
[32] 陈星旦.近红外光谱无创生化检验的可能性[J].光学 精密工程,2008,16(5) :759-763.CHEN X D. Possibility of noninvasive clinical biochemical examination by near infrared spectroscopy[J].Opt. Precision Eng.,2008,16(5) :759-763.( in Chinese)
[33] 丁海泉,卢启鹏,王动民,等.近红外光谱无创血糖检测中有效信号提取方法的研究[J].光谱学与光谱分析,2010,30(1) :50-53.DING H Q,LU Q P,WANG D M,et al.. Research on the effective signal extraction in the noninvasive blood glucose sensing by near infrared spectroscopy[J].Spectroscopy and Spectral Analysis,2010,30(1) :50-53.( in Chinese)
[34] 丁海泉.无创血糖检测中的近红外血流容积光谱基本问题研究[D].长春:中国科学院长春光学精密机械与物理研究所,2010.DING H Q. Basic research of the near-infrared blood volume spectroscopy in non-invasive glucose testing[D]. Changchun:Changchun Insititute of Optics,Fine Mechanics and Physics,Chinese Academy of Sciences,2010.( in Chinese)
[35] YAMAKOSHI K,YAMAKOSHI Y. Pulse glucometry: a new approach for noninvasive blood glucose measurement using instantaneous differential near-infrared spectrophotometry[J].J. Biomedical Optics,2006,11(5) :054028-1-054028-9.
[36] 李刚,王焱,李秋霞,等.动态光谱法对提高近红外无创血液成份检测精度的理论分析[J]. 红外与毫米波学报,2006,25(5) :345-348.LI G,WANG Y,LI Q X,et al.. Theoretic study on improving noninvasive measurement accuracy of blood component by dynamic spectrum method[J].J. Infrared Millim. Waves,2006,25(5) :345-348.( in Chinese)
[37] 陈韵.近红外无创血糖测量—基准波长浮动基准法的研究[D].天津:天津大学,2010.CHEN Y. Study on reference wavelength method for non-invasive blood glucose sensing with near infrared spectroscopy[D]. Tianjin:Tianjin University,2010.( in Chinese)
[38] OLESBERG J T,LIU L Z,ZEE V V,et al.. In vivo near-infrared spectroscopy of rat skin tissue with varying blood glucose levels[J].SPIE,2004,5325:11-20.
[39] LÖNNROTH P,JANSSON P A,SMITH U. A microdialysis method allowing characterization of intercellular waterspace in humans[J].Am J Physiol Endocrinol Metab,1987,253:E228-E231.
[40] JANSSON P A,FOWELIN J,SMITH U,et al.. Characterization by microdialysis of intercellular glucose level in subcutaneous tissue in humans[J].Am J Physiol Endocrinol Metab,1988,255:E218-E220.
[41] BANTLE J P,THOMAS W. Glucose measurement in patients with diabetes mellitus with dermal interstitial fluid[J].J.Lab. Clin. Methods,1997,130(4) :436-441.
[42] THENNADIL S N,RENNERT J L,WENZEL B J,et al. Comparison of glucose concentration in interstitial fluid,and capillary and venous blood during rapid changes in blood glucose levels[J].Diabetes Technology&Therapeutics,2001,3(3) :357-365.
[43] GROENENDAAL W,et al.. Quantifying the composition of human skin for glucose sensor development[J].J. Diabetes Science and Technology,2010,4(5) :1032-1040.
[44] 陈星旦,王动民,卢启鹏,等.中红外无创血糖研究进展并论角质层影响[J]. 光学学报,2011,31( 9) :0900105-1-0900105-6.CHEN X D,WANG D M,LU Q P,et al.. Progress of MIR non-invasive blood glucose determination and effect of stratum corneum[J].Acta Optica Sinica,2011,31(9) :0900105-1-0900105-6.( in Chinese)

