海参肠乙酰胆碱酯酶亲和层析洗脱条件的优化
杜 英,朱蓓薇,吴海涛*
(大连工业大学食品学院,辽宁 大连 116034)
海参肠乙酰胆碱酯酶亲和层析洗脱条件的优化
杜 英,朱蓓薇,吴海涛*
(大连工业大学食品学院,辽宁 大连 116034)
以3-羧基苯基-乙基二甲基铵为配基,与溴化氰活化琼脂糖凝胶交联制备亲和层析柱,分离海参肠中乙酰胆碱酯酶(acetylcholinesterase,AChE),对其洗脱条件进行优化。结果显示:其适宜平衡体系为含0.3mol/L NaCl的PBS(0.05mol/L,pH7.4)缓冲溶液,适宜洗脱体系为含0.2mol/L四乙基碘化铵的PBS(0.05mol/L,pH7.4)缓冲溶液。此条件下,海参肠AChE可得到较好的吸附和分离,初步纯化后的AChE经Native-PAGE电泳分离出3条具有酶活性的条带,说明AChE在海参肠内可能以多种形式存在,呈现多态性。
海参;乙酰胆碱酯酶;亲和层析;洗脱条件
海参作为一种重要的海洋棘皮类动物,营养价值及保健功能兼具。但是,海参的自溶现象却给海参加工、贮藏及运输带来诸多难题。研究发现,在海参的自溶过程中,表皮部位细胞出现细胞核浓缩、染色质聚集化以及边缘化现象[1]。因此,海参自溶过程可能伴随有细胞凋亡、神经信号传导及神经损伤等现象。乙酰胆碱酯酶(acetylcholinesterase,AChE)作为生物神经传导中的关键酶,极有可能参与此过程。对海参AChE进行分离纯化,将为进一步研究其酶学特性、丰富海参酶学理论及阐明海参自溶现象奠定研究基础。
亲和层析是有效的生物活性物质分离纯化方法之一,在亲和层析出现以前,人们一般采用多步的常规层析方法对AChE进行分离纯化,但这种方法操作繁琐,比较耗时。Berman等[2]应用亲和层析技术对电鳗和牛红血球乙酰胆碱酯酶进行了分离纯化。此后,人们应用此技术相继从棉蚜虫[3]、真宽水蚤[4]、果蝇[5]、日本鹌鹑脑[6]、猪脑尾状核[7]、人脑[8-9]、眼镜蛇毒[10]、中国丁氏双鳍电鳐[11]、紫贻贝血淋巴液[12]、鲅鱼脑[13]、黄鱼脑[14]、黄姑鱼[15]和大黄鱼肌肉[16]等动物组织中分离并提纯出AChE。然而,国内外尚未见海参AChE分离纯化的报道。本实验参考Massoulie等[17]的方法,以3-羧基苯基-乙基二甲基铵(3-carboxyphenyl ethyldimethyl ammonium,CEA)为配基制备亲和柱,对其分离洗脱AChE条件进行优化,为进一步纯化海参AChE奠定研究基础。
1 材料与方法
1.1 材料与试剂
新鲜刺参肠,产于秋季(9~11月),购于大连长兴水产市场;DEAE纤维素DE52、溴化氰活化琼脂糖凝胶4B(CNBr-Sepharose-4B) 瑞典Pharmacia公司;碘化硫代乙酰胆碱(Acetylthiocholine iodide,AcSChI) 美国Fluka公司;1-cyclohexyl-3-(2-morpholinoethyl)earbodiimide metho-p-toluene sulfonata 美国 Sigma公司;其他化学试剂均为国产分析纯。
1.2 仪器与设备
UV-2100型分光光度计 尤尼柯(上海)仪器有限公司;Z323K型冷冻离心机 德国Hermie(哈默)公司;JJ 200Y型精密电子天平 美国双杰兄弟(集团)有限公司;Infinite M 200型酶标定量测定仪 瑞士帝肯(Tecan)集团公司;DHL-A电脑恒流泵、DBS-100电脑全自动部分收集器 上海沪西分析仪器厂有限公司;垂直板电泳槽、DYY-10C电泳仪 北京市六一仪器厂。
1.3 方法
1.3.1 AChE的提取
分别称取新鲜海参肠适量,与经预冷的含0.1% Triton X-100的PBS缓冲液(0.1mol/L,pH7.4)按1:2(g/mL)低温匀浆,4℃搅拌提取12h,12000r/min冷冻离心15min,上清液4℃超滤浓缩,分装,-80℃保存备用。
1.3.2 AChE活性的测定
参考Gorun等[18]改进的Ellman法,稍作修改测定酶活,将AcSChI配制成10mmol/L的底物溶液,测定时取待测酶液100μL,加入100μL底物,混匀,30℃孵育15min,加入990μL终止液(含0.125mmol/L DTNB,45%乙醇)终止反应并显色,混匀后取200μL加入96孔板,用酶标仪在412nm处测光密度。酶活力单位(U)定义为每分钟催化分解底物1nmol为1个活力单位,按下列公式计算。

式中:ε为消光系数取值13.6;L为光程0.5cm;V为反应体系的总体积;t为反应时间。
1.3.3 DEAE-52阴离子交换层析
将海参肠粗酶液2mL上样于用PBS(0.05mol/L,pH7.4)平衡好的DEAE-52阴离子交换柱(2cm×20cm),用溶于PBS(0.05mol/L,pH7.4)的NaCl溶液进行梯度洗脱,采用0、0.4、0.75mol/L三个梯度,每个梯度洗脱两个柱体积,洗脱流速为0.5mL/min。分管收集,每管5mL,整个分离纯化过程均在4℃下进行,分别测定各管洗脱液蛋白质含量(以OD280表示)及乙酰胆碱酯酶活力,绘制酶活力和蛋白质含量曲线。合并酶活力较高的洗脱液,超滤浓缩后,用于下一步分离。
1.3.4 亲和层析
1.3.4.1 CEA亲和柱的制备
以3-羧基苯基-乙基二甲基铵(CEA)为配基,按照Massoulie等[17]的方法制备CEA亲和柱。
配基的合成:称5g 3-二甲基氨基苯甲酸和50mL丙酮于250mL锥形瓶中,加入10mL乙基碘溶解,混合物在60℃条件下搅拌回流24h。白色粉末烧结瓶过滤,丙酮冲洗晾干,得到5g CEA。
手臂的偶联:5g CNBr-Sepharose-4B溶胀于30mL 1mmol/L的HCl溶液中,置于烧结玻璃瓶内,用至少lL相同溶液在水抽吸泵下冲洗。然后,凝胶重新悬浮在30mL偶联缓冲液中(10.9g碳酸钠,碳酸氢钠8.4g/L,pH10),加过量已溶1,6-己二胺10mL,用浓盐酸调pH10,在室温搅拌过夜(勿用磁力搅拌器),用乙醇胺5mL(1mol/L,pH8.0)温育以封闭残余的活性基团,搅匀后在室温静置12h,用蒸馏水洗3~5遍。
配基与手臂偶联:0.5g CEA溶解于8mol/L NaOH溶液,加到30mL上述处理过的CNBr-Sepharose 4B中,用浓盐酸调pH4,然后加入0.25g 1-cyclohexyl-3-(2-morpholinoethyl)earbodiimide metho-p-toluenesulfonata。偶联反应在室温过夜完成,加1mL乙酸酐进行乙酰化,降低自由氨基之间的离子交换作用,用8mol/L NaOH溶液将pH值保持在4~6之间,最后凝胶依次用过量的蒸馏水,lmol/L NaCl溶液和蒸馏水冲洗,即为亲和凝胶。
1.3.4.2 海参肠AChE亲和层析洗脱条件的优化
(1)离子强度对吸附效果的影响
将制备的亲和凝胶装柱(1.2cm×10cm),通过改变NaCl浓度改变洗脱液的离子强度,分别以含浓度为0、0.3、0.5mol/L NaCl的 PBS(0.05mol/L,pH7.4)溶液平衡亲和柱,取经DEAE-52阴离子交换层析收集浓缩后的酶液1mL上样,并分别用平衡缓冲液洗脱4~6个柱体积,再用含2mol/L NaCl的PBS缓冲液洗脱,以洗下吸附的AChE和其他蛋白质。洗脱速度稳定为1mL/3min,分管收集,每管3 mL。
(2)洗脱液的选择对分离效果的影响
将制备的亲和凝胶装柱(1.2cm×10cm),以确定的最佳平衡体系平衡亲和柱,取经DEAE-52阴离子交换层析收集浓缩后的酶液1mL上样,用该平衡缓冲液洗脱4~6个柱体积,以最大程度地吸附AChE并洗去大部分杂蛋白,然后分别选择含0.0 1 m o l/L四乙基碘化铵(tetraethylammonium iodide,TEA)的PBS(0.05mol/L,pH7.4)、含0.2mol/L TEA的PBS(0.05mol/L,pH7.4)、含0.75mol/L NaCl的PBS(0.05mol/L,pH7.4)缓冲液洗脱2个柱体积,以洗下绝大部分吸附的AChE,最后用含2mol/L NaCl的PBS缓冲液洗脱,以除去残留的AChE和其他蛋白质。洗脱速度稳定为1mL/3min,分管收集,每管3mL。
(3)样品纯度对分离效果的影响
用(1)确定的最佳平衡缓冲液平衡后的亲和凝胶柱(1.2×10cm),取粗酶液1mL上样,并用该缓冲液洗脱4~6个柱体积,再用(2)确定的洗脱缓冲液洗脱2个柱体积,最后用含2mol/L NaCl的PBS缓冲液冲洗柱子。洗脱速度稳定为1mL/3min,分管收集,每管3mL。
1.3.5 电泳分析
参照Laemmli[19]的方法,采用非连续SDS-PAGE电泳对DE-2和粗酶经亲和层析分离后的酶液进行纯度检测,浓缩胶5%、分离胶12%。DE-2经亲和层析分离后的酶液进行Native-PAGE电泳,浓缩胶5%、分离胶8%,然后按照张翰等[20]的方法进行活性染色。
2 结果与分析
2.1 海参肠AChE DEAE-52阴离子交换层析
海参肠AChE粗酶样品按照1.3.3节方法进行DEAE-52阴离子交换层析,结果如图1所示。分别采用0、0.4、0.75mol/L三个浓度梯度的NaCl溶液进行洗脱,分别得到3个蛋白峰,其中第2个和第3个蛋白峰有较高的乙酰胆碱酯酶比活力,分别命名为DE-2和DE-3。其中,DE-2具有较高的酶活力,收集该活性峰,用于下一步的CEA亲和柱分离,进行洗脱条件的优化。

图1 海参肠AChE的DEAE-52阴离子交换层析Fig.1 Anion exchange chromatography of AChE from the gut of sea cucumber on DEAE-52
2.2 海参肠AChE亲和层析洗脱条件的优化
2.2.1 离子强度对吸附效果的影响

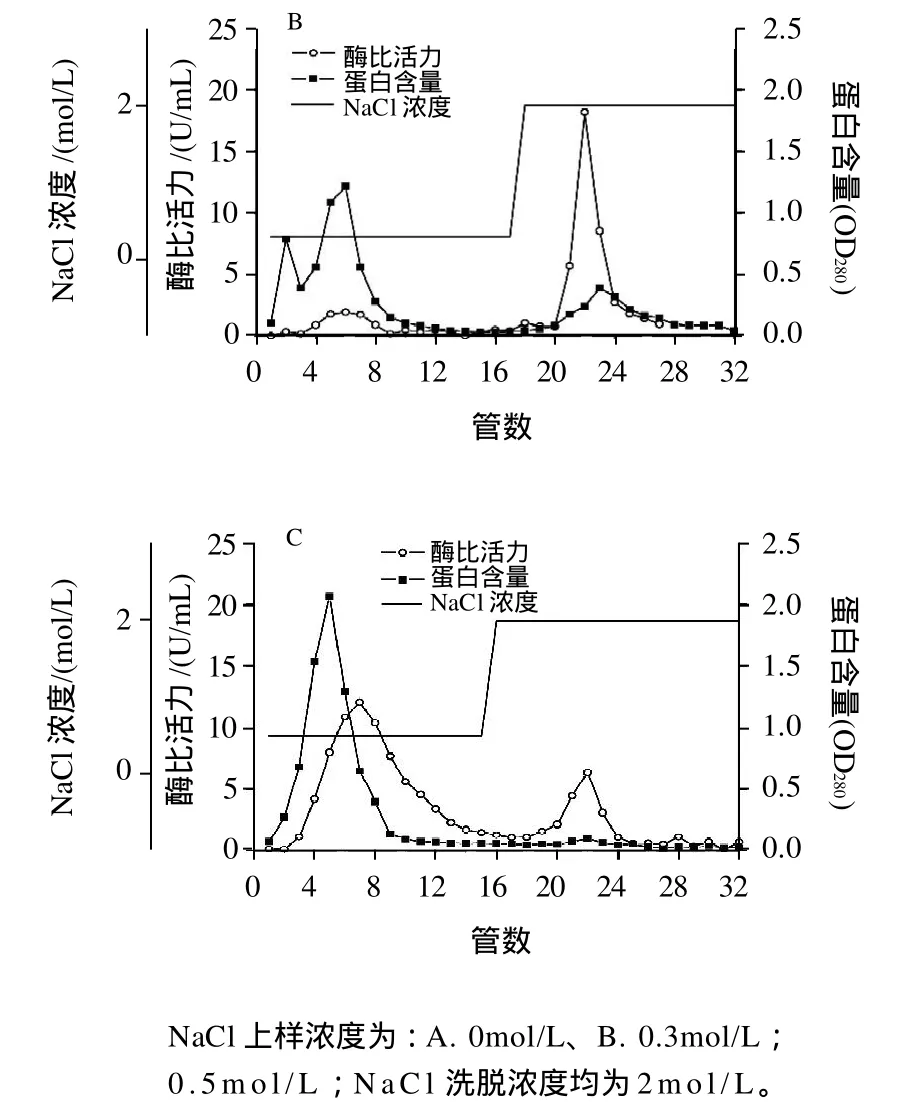
图2 离子强度对海参肠AChE吸附效果的影响Fig.2 Effect of ionic strength on the adsorption of AChE from the gut of sea cucumber
按照1.3.4.2节的方法,样品上柱后,分别以含有0、0.3、0.5mol/L NaCl的PBS(0.05mol/L,pH7.4)缓冲溶液洗脱,然后用含2mol/L NaCl的PBS将结合到柱上的所有蛋白洗涤下来,对层析柱进行再生,并验证前一阶段柱子对蛋白的吸附情况,结果见图2。
结果显示,随着NaCl浓度的增加,配基与酶的结合力逐渐减弱,对杂蛋白的洗脱能力也逐渐增强。PBS缓冲液中不含NaCl时,海参肠AChE几乎全部吸附到配基上,洗脱液中酶活力仅为0.90U/mL,有少部分杂蛋白被洗脱下来,以含2mol/L NaCl的PBS洗脱时,AChE随大部分的杂蛋白一起被洗脱下来(图2A)。以含有0.3mol/L NaCl的PBS平衡并洗脱时,少部分AChE未吸附至亲和柱上,洗脱液中酶活力达到1.92U/mL,大部分杂蛋白被洗脱下来,以含有2mol/L NaCl的PBS洗脱时,AChE随部分杂蛋白一起被洗脱下来(图2B)。以含0.5mol/L NaCl的PBS平衡并洗脱时,只有少部分AChE吸附在配基上,大部分连同杂蛋白被连续不断地洗涤下来,在以含2mol/L NaCl的PBS进一步洗脱时,少部分吸附的AChE被洗涤下来(图2C)。综合来看,0.3mol/L NaCl既不影响AChE的吸附,又可防止杂蛋白的吸附,有利于提高酶的纯度,故选择含0.3mol/L NaCl的PBS作为平衡缓冲液,并在上样后洗去未吸附的杂蛋白。
2.2.2 洗脱液的选择对分离效果的影响
亲和层析的洗脱方法可以分为两种:特异性洗脱和非特异性洗脱。非特异洗脱是通过改变洗脱液的p H值、离子强度、离子种类或温度等理化性质使固定化配基和生物高分子之间的亲和力降低,以至解开生物高分子和亲和吸附剂之间的结合。特异洗脱的方法,利用含有与亲和配基或目标产物具有亲和作用的小分子化合物溶液为洗脱剂,通过与亲和配基或目标产物的竞争性结合,脱附目标产物。其优点是特异性强,可以进一步消除非特异性吸附的影响,从而得到较高的分辨率。本实验对两种洗脱方式进行了对比,其中特异性洗脱中选用乙酰胆碱酯酶的可逆性抑制剂TEA作为竞争物对酶进行洗脱,并对比了两种不同浓度竞争物的洗脱效果。
采用1.3.4.2节方法,对吸附在柱上的海参肠AChE进行洗脱,结果如图3所示。
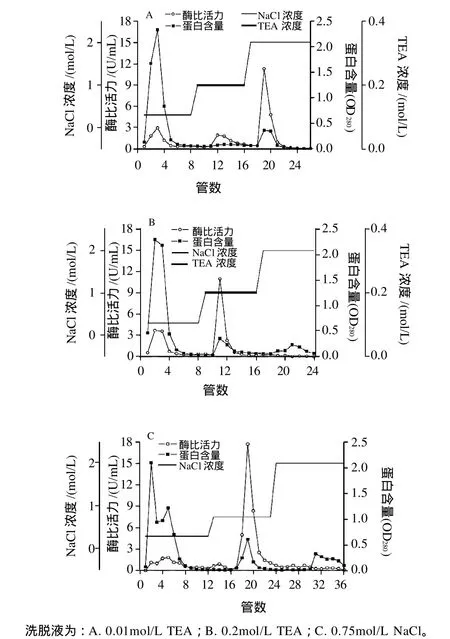
图3 洗脱液对海参肠AChE分离效果的影响Fig.3 Effect of eluent type on the separation of AChE from the gut of sea cucumber
如图3A所示,以含0.01mol/L TEA的PBS(0.05mol/L,pH7.4)的缓冲液洗脱时,被洗脱下来的海参肠AChE形成一个范围较宽酶活较低的活力峰,继续用含2mol/L NaCl的PBS洗脱时,收集的蛋白峰有较大的酶活力,表明0.01mol/L TEA不能将结合的全部AChE洗脱下来,需加大洗脱液中竞争物的浓度。图3B、3C显示,用含2mol/L NaCl的PBS洗脱时只有杂蛋白峰没有AChE酶活峰,表明0.2mol/L TEA和0.75mol/L NaCl均可将海参肠AChE全部洗脱下来。相比而言,0.75mol/L NaCl洗脱得到的峰蛋白含量和酶活力均相对较高,说明随目的蛋白洗脱出的组分中含有较多的杂蛋白。所以,0.2mol/L TEA进行特异性洗脱效果较好,得到的蛋白纯度较高,但是在洗脱过程中酶活受到竞争物的抑制,可通过透析或超滤等方法去除抑制剂。
2.2.3 样品纯度对分离效果的影响
亲和层析属吸附层析,样品纯度是影响层析效果的重要因素之一。采用含0.3mol/L NaCl的PBS洗脱,直至OD280<0.05,然后用含0.2mol/L TEA的PBS(0.05mol/L,pH7.4)洗脱,对海参肠粗AChE进行分离,结果见图4。

图4 海参肠AChE粗酶的亲和层析洗脱图Fig.4 Elution profile of crude AChE from the gut of sea cucumber on affinity chromatography column
海参肠AChE粗酶液上样后,在目的蛋白结合阶段杂蛋白随流出液中大部分被去除,在洗脱后期有严重的拖尾现象,使洗脱体积增大。这可能是因为AChE粗酶液中杂蛋白含量多,通过非特异性吸附结合于亲和柱上。在洗脱时,这些杂蛋白慢慢地、不断地解吸下来,造成洗脱体积增大,洗脱时间时间延长。
2.3 电泳分析
采用1.3.5节方法分别对海参肠AChE粗酶、DE-2以及二者经亲和层析后得到的组分进行SDS-PAGE电泳纯度鉴定,结果如图5 A所示。
由图5A的电泳结果看出,海参肠AChE粗酶和DE-2经电泳分离后显示若干条带,经亲和层析分离后,AChE粗酶分离组分呈现三条蛋白带,DE-2分离组分呈现两条蛋白带。表明亲和层析对AChE粗酶和DE-2有较好的分离效果,但是尚未达到电泳纯,需进行进一步的纯化。
从各种组织和器官中分离纯化的AChE具有多种分子型,它们在亚基组成、分子质量、斯托克斯(stokes)半径、沉降系数、糖蛋白组成、等电点、水解特性及酶转换数上有差异的一组酶,称为AChE的同工酶。DE-2经亲和层析分离后的组分经Native-PAGE电泳分离后进行酶活力染色,结果如图5B所示。亲和层析后的样品经Native-PAGE分离出3条具有酶活性的条带,说明乙酰胆碱酯酶在海参肠内可能以多种形式存在,呈现多态性,它们可能具有不同的分子量和带电荷,导致其电泳行为存在差异。不少动物组织中都有AChE的同工酶的报道,在凝胶电泳中,猪脑尾状核AChE有四条同工酶带[7],人脑AChE显示四条酶活力带,分别为AChE的二、四、六及八聚体[8],紫贻贝血淋巴液中AChE的酶活力区带数量则随季节变化有明显差异[12],至于不同形式的AChE的结构和功能的关系尚待进一步的研究。
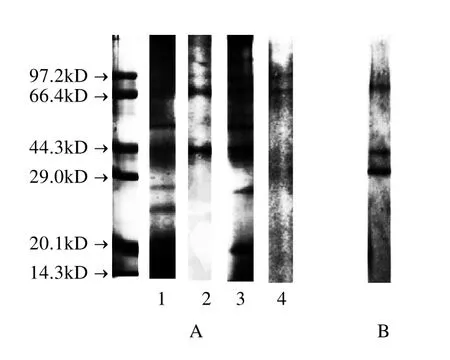
图5 海参肠AChE的电泳图Fig.5 Electropherosis of AChE from the gut of sea cucumber
3 结 论
采用CEA亲和柱对海参肠AChE进行分离过程中,适宜平衡体系为含0.3mol/L NaCl的PBS(0.05mol/L,pH7.4)缓冲溶液,适宜洗脱体系为含0.2mol/L 四乙基碘化铵(TEA)的PBS(0.05mol/L,pH7.4)缓冲溶液。
海参肠AChE经Native-PAGE分离出三条具有酶活性的条带,说明乙酰胆碱酯酶在海参肠内可能以多种形式存在,呈现多态性。
[1] ZHU Beiwei, ZHENG Jie, ZHANG Zongshen, et al. Autophagy plays a potential role in the process of sea cucumber body wall “melting” induced by UV irradiation[J]. Wuhan University Journal of Natural Sciences,2008, 13(2): 232-238.
[2] BERMAN J D, YOUNG M. Rapid and complete purification of acetylcholinesterases of electric eel and erythrocyte by affinity chromatography[J]. Proc Natl Acad Sci USA, 1971, 68(2): 395-398.
[3] LI Fei, HAN Zhaojun. Purification and characterization of acetylcholinesterase from cotton aphid (Aphis gossypii Glover)[J]. Arch Insect Biochem Physiol, 2002, 51(1): 37-45.
[4] FORGET J, LIVET S, LEBOULENGER F. Partial purification and characterization of acetylcholinesterase (AChE) from the estuarine copepod Eurytemora affinis (Poppe)[J]. Comp Biochem Physiol C Toxicol Pharmacol, 2002, 132(1): 85-92.
[5] HSIAO Y M, LAI J Y, LIAO H Y, et al. Purification and characterization of acetylcholinesterase from oriental fruit fly [Bactrocera dorsalis (Hendel)](Diptera: Tephritidae)[J]. J Agric Food Chem, 2004, 52(17): 5340-5346.
[6] SON J Y, SHIN S, CHOI K H, et al. Purification of soluble acetylcholinesterase from Japanese quail brain by affinity chromatography[J]. Int J Biochem Cell Biol, 2002, 34(2): 204-210.
[7] 张振凡, 张祖传, 杨建中, 等. 亲和层析纯化猪脑尾状核乙酰胆硷酯酶[J]. Acta Biochimica et Biophysica Sinica, 1980, 12(3): 257-262.
[8] 朱美财, 辛颜彬, 孙曼霁, 等. 人脑乙酰胆碱酯酶的分离纯化及特性[J]. 中国科学: B辑, 1992, 22(8): 835-841.
[9] 张兴梅, 石玉生, 张翰. 应用亲和层析分离纯化人小脑乙酰胆碱酯酶的初步研究[J]. 第一军医大学学报, 1999, 19(2): 166-167.
[10] 佘微明, 屈贤铭, 邱雪贞. 浙江产眼镜蛇毒胆碱酯酶的研究: Ⅰ. 酶的纯化[J]. Acta Biochimica et Biophysica Sinica, 1981, 13(1): 45-54.
[11] 孙曼霁, 高天栋, 邢志勇, 等. 中国丁氏双鳍电鳐乙酰胆碱酯酶的制备亲和层析[J]. 生物化学杂志, 1985, 1(2): 47-55.
[12] 曹蕙婷, 张振凡, 张祖传, 等. 紫贻贝(Mytilus edulis)血淋巴液乙酰胆碱酯酶的性质研究[J]. Acta Biochimica et BiophysicaSinica, 1983, 15(3): 249-255.
[13] 朱小山, 孟范平, 何东海. 鲅鱼脑组织AChE的分离纯化及某些生化性质[J]. 青岛大学学报: 工程技术版, 2006, 21(2): 35-41.
[14] 朱小山, 孟范平, 何东海. 黄鱼(Hexagrammosotakii)脑组织AChE的亲和层析[J]. 中国海洋大学学报: 自然科学版, 2004, 34(2): 231-237.
[15] 施善平, 张景园. 黄姑鱼肌肉胆碱酯酶的纯化及其某些性质[J]. Acta Biochimica et Biophysica Sinica, 1981(1): 9-16.
[16] 董之海. 大黄鱼肌肉胆碱酯酶的纯化[J]. 生物化学杂志, 1995, 11(4):487-489.
[17] MASSOULIE J, BON S. Affinity chromatography of acetylcholinesterase:the importance of hydrophobic interactions[J]. Eur Biochem, 1976, 68(2): 531-539.
[18] GORUN V, PROINOV I, LTESCU V, et al. Modified Ellman procedure for assay of cholinesterases in crude enzymatic preparations[J]. Anal Biochem, 1978, 86(1): 324-326.
[19] LAEMMLI U K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J]. Nature, 1970, 227: 680-685.
[20] 张翰, 邢志勇, 孙曼霁. 乙酰胆碱酯酶的聚丙烯酰胺凝胶电泳[J]. 军事医学科学院院刊, 1983, 19(6): 689-692.
Optimization of Elution Conditions for Affinity Chromatography of Acetylcholinesterase from the Gut of Sea Cucumber (Stichopus japonicus)
DU Ying,ZHU Bei-wei,WU Hai-tao*
(School of Food Science and Technology, Dalian Polytechnic University, Dalian 116034, China)
An affinity chromatography column was prepared by cross-linking of 3-carboxyphenyl ethyldimethyl ammonium(CEA) as a ligand with CNBr-Sepharose-4B and used for an investigation into the optimization of elution conditions for affinity chromatography of acetylcholinesterase (AChE) from the gut of sea cucumber (Stichopus japonica). The appropriate balance system was PBS (0.05 mol/L, pH 7.4) containing 0.3 mol/L NaCl, and the appropriate elution system was PBS (0.05 mol/L, pH 7.4) containing 0.2 mol/L tetraethyl ammonium iodide. Under these conditions, AChE was well adsorbed and separated. Three active bands were separated in the native-PAGE pattern of Preliminarily purified AChE, AChE in the gut of sea cucumber may have different forms and display polymorphism.
sea cucumber;acetylcholinesterase;affinity chromatography;elution conditions
Q556
A
1002-6630(2012)08-0006-05
2011-03-14
国家自然科学基金青年科学基金项目(31000754);辽宁省博士科研启动基金项目(20101004)
杜英(1985—),女,硕士研究生,研究方向为水产品加工理论与技术。E-mail:duying1985@126.com
*通信作者:吴海涛(1980—),女,讲师,博士,研究方向为水产品深加工。E-mail:wht205@hotmail.com

