HPLC-ESI-MS/MS检测河豚鱼中5种抗生素残留的方法
田 丰,王 飞,吕 鹏,闫树峰,廉 力
(1.黑河出入境检验检疫局,黑龙江 黑河 164300;2.秦皇岛出入境检验检疫局,河北 秦皇岛 066004)
HPLC-ESI-MS/MS检测河豚鱼中5种抗生素残留的方法
田 丰1,王 飞2,吕 鹏1,闫树峰1,廉 力1
(1.黑河出入境检验检疫局,黑龙江 黑河 164300;2.秦皇岛出入境检验检疫局,河北 秦皇岛 066004)
建立一种同时测定河豚鱼中林可霉素、竹桃霉素、红霉素、替米考星和泰乐菌素5种大环内酯类抗生素残留的方法。试样中残留的抗生素用Tris缓冲溶液提取,经Oasis HLB固相萃取柱净化后,用液相色谱-质谱/质谱仪检测和确证,内标法定量。结果表明:5种大环内酯类抗生素在0.002~0.050μg/mL范围内均呈线性关系,相关系数r为0.9977~1.0000;在0.002~0.010mg/kg范围内,样品平均加标回收率在78.9%~109.0%之间,重复性相对标准偏差在1.3%~5.3%之间,再现性相对标准偏差在5.2%~14.5%之间,5种大环内酯类抗生素定量限均为2.0μg/kg。
液相色谱-质谱/质谱;固相萃取;大环内酯抗生素;河豚鱼
河豚鱼营养丰富、肉质鲜美,被誉为“鱼中之王”。我国河豚鱼产品主要销往日、韩等国际市场。我国的河豚鱼以养殖为主,而在养殖过程中不可避免地使用抗生素类药物。其中主要为大环内酯类的林可霉素、竹桃霉素、红霉素、替米考星和泰乐菌素等。该类抗生素以一个大环内酯通过羟基以苷键与1~3个去氧氨基糖或二甲氨基糖缩合成碱性苷,有较强的抗菌活性[1],曾广泛地应用于食用动物作为预防和治疗用药,通常采用饲料或者注射方式,易在食用肉中残留,并通过食物链进入人体。该类药物对人体的不良反应主要是导致茶碱血浓度升高而致中毒、对前庭和耳蜗神经的损害,严重者造成肝肾损害,甚至死亡。因此,各国对大环内酯类抗生素药物残留均有严格的限量要求,欧盟已禁用,我国也有相应的要求[2-3]。近年来,日韩等国针对该类药物残留相继建立贸易技术壁垒,限制和排斥中国河豚鱼出口。因此,建立一种高灵敏度的测定河豚鱼中大环内酯类抗生素的检测方法,对于攻破贸易技术壁垒,是十分必要和紧迫的。
测定大环内酯类抗生素主要分析方法有微生物法[4-5]、荧光光度法[6]、紫外分光光度法[7-8]、薄层色谱法[9-10]、高效液相色谱法[11-12]、毛细管电泳法[13](capillary electro phoresis,CE)和液相色谱-质谱(liquid chromatographymass spectrometry,LC-MS)联用法[14-16]等。在近期的文献报道中,测定大环内酯类残留,样品前处理大多采用缓冲溶液提取[17-18]结合固相萃取技术分析技术[19-21],检测主要采用液相色谱-串联质谱方法,该方法灵敏度高、选择性和特异性好,能够对低浓度的样品进行很好的定性确认。文献报道的测定大环内酯类分析方法多应用于食品[16-18,22-23]和动物产品[24],未见与河豚鱼相关的检测研究。
本方法在参考以上文献的基础上,拟建立用Tris缓冲溶液提取残留物,固相萃取(solid phase extraction,SPE)萃取、净化,内标法液相色谱-质谱/质谱(high performance liquid chromatography,HPLC-MS/MS)检测河豚鱼中5种大环内酯类抗生素残留的新方法,填补河豚鱼进出口检测要求的空白。
1 材料与方法
1.1 材料与试剂
甲醇、乙腈均为色谱纯;乙酸铵、盐酸、三羟甲基氨基甲烷、氯化钙均为分析纯;水为GB/T 6682—2008《分析实验室用水规格和试验方法》规定的一级水;标准物质(纯度≥95%):林可霉素(lincomycin,CAS号:7179-49-9)、竹桃霉素(oleandomycin,CAS号:7060-74-4)、红霉素(erythromycin,CAS号:59319-72-1)、替米考星(tilmicosin,CAS号:108050-54-0)、泰乐菌素(tylosin、CAS号:74610-55-2)、内标物质罗红霉素(roxithromycin,CAS号:80214-83-1);0.2μm滤膜;Oasis HLB固相萃取柱(500mg,6mL。使用前依次用10mL甲醇和10mL水活化)。
Tris溶液:依次称取12.0g三羟甲基氨基甲烷和7.35g CaCl2·2H2O溶解于1000mL水中,用盐酸调节pH值为9,定容至1000mL。
大环内酯类抗生素标准储备溶液:精确称取适量大环内酯类抗生素标准品和内标物质罗红霉素,用乙腈溶解并定容至100mL棕色容量瓶中,得质量浓度为100μg/mL的标准储备溶液。
混合标准中间溶液:精确吸取大环内酯类抗生素的标准储备溶液各1.0mL于10mL容量瓶中,用乙腈稀释成质量浓度为10.0μg/mL的混合标准中间溶液。
混合标准工作溶液:根据需要使用前用空白样品基质配成罗红霉素质量浓度200ng/mL,林可霉素、竹桃霉素、红霉素、替米考星和泰乐菌素分别为2.0、4.0、10.0、50.0ng/mL的4个质量浓度水平的系列基质标准混合工作溶液。
1.2 仪器与设备
AB 3200 Q TRAP液相色谱-质谱/质谱仪[配有电子电离(electron ionization,EI)源] 美国Waters公司;旋涡混合器;氮吹仪;高速离心机(12000r/min);pH计;振荡器。
1.3 分析条件
气相色谱操作条件:色谱柱:Atlantis C18(150mm× 2.1mm,3μm)。流动相A为乙腈,流动相B为0.1% (V/V)甲酸溶液,流动相C为甲醇;流速为0.2mL/min;柱温30℃;进样量20μL。梯度洗脱条件见表1。

表1 HPLC分析梯度洗脱条件Table 1 Gradient elution conditions
质谱扫描参考条件:离子源为电喷雾离子源;扫描方式为正离子扫描;检测方式为多反应监测;电喷雾电压5500V;雾化气压力0.24MPa;辅助气流速0.4L/ min;离子源温度550℃;碰撞室出口电压2.0V;定性离子对、定量离子对、碰撞气能量和去簇电压条件见表2。
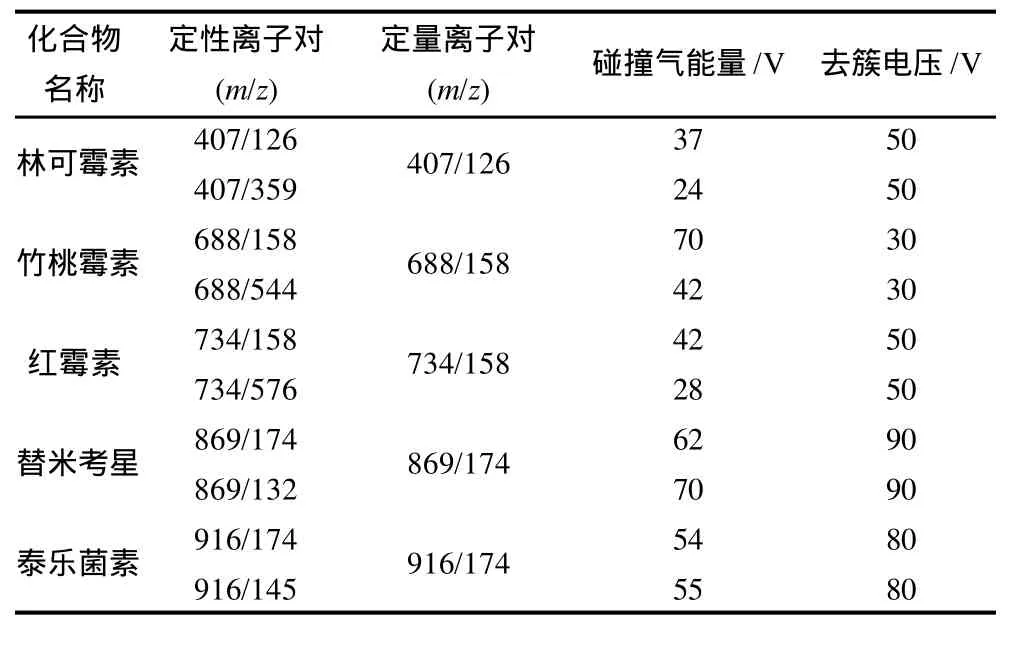
表2林可霉素、竹桃霉素、红霉素、替米考星和泰乐菌素定性离子对、定量离子对、碰撞能量和去簇电压Table 2 Qualitative ions, quantitative ions, collision energy and cluster voltages for lincomycin, oleandomycin, erythromycin, tilmicosin and tylosin
1.4 实验方法
待检成分提取:称取5g(精确至0.01g)试样,置于50mL离心管中,加入20.0μL质量浓度为10ng/mL的内标工作溶液和10.0mL Tris溶液,于振荡器上剧烈振荡10min。以12000r/min转速离心10min,取上清液以小于1.0mL/min的流速通过已活化的Oasis HLB固相萃取柱;再加入10.0mL Tris溶液,于振荡器上按前述步骤重复萃取1次,取上清液相同条件过萃取柱。
待检成分纯化:待样液全部流出后,先后用10mL水和10mL甲醇溶液(2:3,V/V)洗柱,弃去全部流出液,将固相萃取柱用真空泵抽干。然后用10mL甲醇洗脱于15mL离心管中,用氮气浓缩仪于50℃水浴中吹干,准确加入1.0mL 0.01mol/L乙酸铵溶液-乙腈(17:3,V/V)溶液溶解并定容,于超声波仪中超声波助溶约1min。溶液过0.2μm滤膜后,供液相色谱-串联质谱仪测定。
2 结果与分析
2.1 提取溶液的选择
根据相关文献资料,从动物组织中提取大环内酯类药物的主要提取溶液有磷酸盐缓冲溶液、0.3%偏磷酸-甲醇溶液、乙腈、Tris溶液和乙酸盐溶液,本实验对此进行对比实验,结果见表3。

表3 不同提取溶液的提取效果Table 3 Comparison of the extraction efficiency of five marcolide antibiotics with different extraction solvents
从表3可以看出,当用0.1mol/L磷酸盐缓冲溶液作为提取液时,5种大环内酯类抗生素的回收率为0.0%~153.0%;当用0.3%偏磷酸-甲醇溶液(7:3,V/V)作为提取液时,林可霉素的回收率为1.8%,红霉素的回收率非常不稳定(30.0%~106.0%),其他大环内酯类抗生素的回收率回收率为72.0%~106.0%;当用乙腈作为提取液时,除竹桃霉素、泰乐菌素的回收率大于7 0%外,其他大环内酯类抗生素的回收率均小于31.4%;当用0.1mol/L乙酸盐溶液作为提取液时,替米考星的回收率小于7 0%,其他大环内酯类抗生素的回收率均大于70%;当用Tris溶液作为提取液时,5种大环内酯类抗生素的回收率在78.4%~99.1%范围。所以本方法采用Tris溶液作为提取液。
2.2 不同固相萃取柱对回收率的影响
在选定条件下,对Varian C18、Oasis HLB(500g)、Oasis HLB(200g)、MCX和Bakerbond spe C18五种固相萃取柱的效率进行比较,结果见表4。
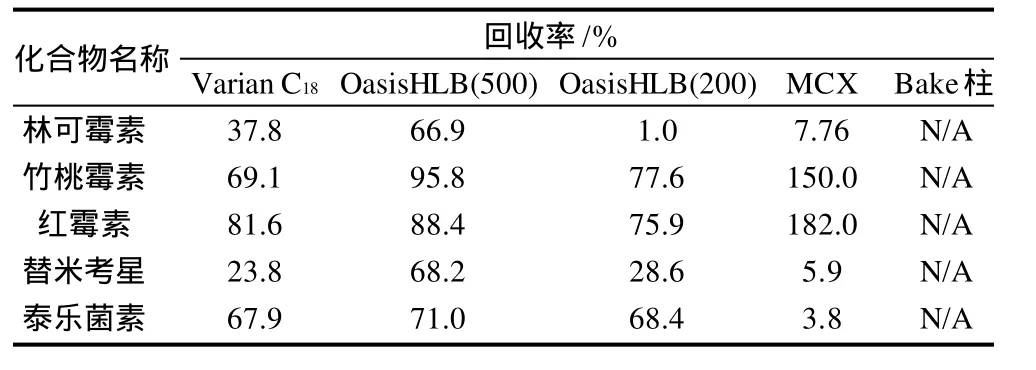
表4 不同固相萃取柱对回收率的影响Table 4 Effects of different solid phase columns on recovery rate
结果表明,Oasis HLB(500g)固相萃取柱的效果最理想。因此,本方法选择Oasis HLB(500g)固相萃取柱为净化柱。
2.3 内标的选择
根据相关文献资料记载,大环内酯测定的内标物选择主要有罗红霉素和林可霉素,对比实验结果见表5。

表5 不同内标物的选择Table 5 Selection of optimal internal standard
从表5可以看出,当用林可霉素为内标时,只有替米考星的回收率在94.2%,其余的回收率在94.2%~277.0%之间;当用罗红霉素为内标时,5种大环内酯类抗生素的回收率在76.5%~117.0%范围。所以本方法采用罗红霉素作为内标。
2.4 参考保留时间
用系列基质混合标准工作溶液,分别进样。在仪器最佳工作条件下,以基质混合标准工作溶液浓度为横坐标、峰面积为纵坐标,绘制标准工作曲线,用标准工作曲线对样品进行定量。样品溶液中,5种大环内酯类抗生素的响应值均应在仪器测定的线性范围内。在上述色谱条件和质谱条件下,林可霉素、竹桃霉素、红霉素、替米考星和泰乐菌素的参考保留时间分别为6.96、7.36、8.06、8.36、8.48min。
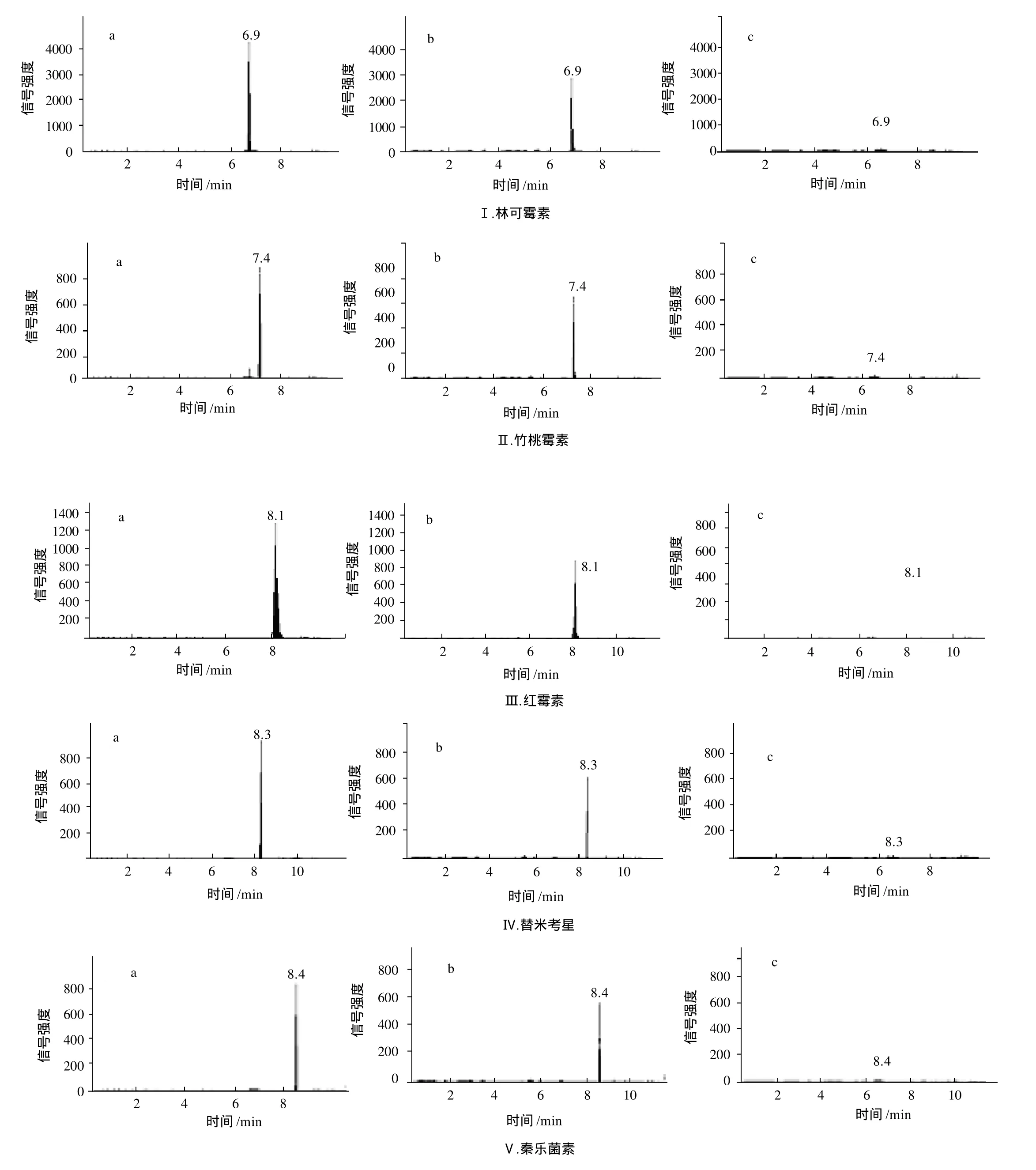
图1 5种抗生素的基质标准定量限(a)、定量限添加(b)和空白样品(c)的MRM图Fig.1 Multiple reaction monitoring chromatogram of 5 antibiotics in matrix standard at the level of LOQ(a), spiked samples at the level of LOQ (b) and blank samples (c)
2.5 线性范围和定量限
配制2.0、4.0、10.0、50.0ng/mL四个质量浓度水平的系列基质标准混合工作溶液,在选定的条件下进行测定,进样量为20μL,用峰高对标准溶液中各被测组分的质量浓度做图。林可霉素、竹桃霉素、红霉素、替米考星和泰乐菌素的绝对量在0.04~1.0ng范围内均呈线性关系,其线性方程和相关系数见表6。

表6 5种大环内酯类抗生素线性方程和相关系数Table 6 Linear equations and correlation coefficients of 5 macrolide antibiotics
5种大环内酯类抗生素在添加水平2.0~50μg/kg范围时,响应值在仪器线性范围之内,信噪比RSN大于5。林可霉素、竹桃霉素、红霉素、替米考星和泰乐菌素的基质标准定量限(limit of quantity,LOQ)、定量限添加和空白样品检测的多反应检测(multiple reaction monitoring,MRM)图见图1。
根据最终样液所代表的试样量、定容体积、进样量和进行测定时所受的干扰情况,确定本方法测定河豚鱼中的林可霉素、竹桃霉素、红霉素、替米考星和泰乐菌素的定量限为2.0μg/kg。
2.6 方法的回收率和精密度
用不含该5种大环内酯类抗生素的河豚鱼样品进行添加回收和精密度实验,样品中添加2.0、4.0、8.0、10.0μg/kg四个不同水平标准后,摇匀,然后按本方法进行提取、净化、测定。5种大环内酯类抗生素的回收率数据全部在78.9%~109.0%之间,4个水平相对标准偏差小于等于14.17%,说明方法的回收率和精密度良好。5种大环内酯类抗生素出峰区域未见干扰峰,空白样品实验也表明,对于河豚鱼样品,本方法的适用性良好。
2.7 方法的实验室验证
本方法经8个实验室进行重复性和再现性验证。用不含5种大环内酯类抗生素的河豚鱼样品分别做2.0、4.0、8.0、20.0μg/kg四个不同水平的添加回收实验,5种大环内酯类抗生素重复性相对标准偏差在1.3%~5.3%之间,再现性相对标准偏差在5.2%~14.5%之间,均符合国际上通用的AOAC标准分析方法对国际协同研究实验室内与实验室间重复性相对标准偏差和再现性相对标准偏差之要求。
3 结 论
本实验建立了HPLC-ESI-MS/MS同时测定河豚鱼中林可霉素、竹桃霉素、红霉素、替米考星和泰乐菌素残留量的检测方法,方法的重复性相对标准偏差、再现性相对标准偏差均符合国际上通用的AOAC标准分析方法要求,操作简单、回收率稳定、灵敏度高、选择性好、定量同时可以定性。河豚鱼中的5种大环内酯类抗生素定量限达到2.0ΜG/KG,达到实验设计目的,完全满足世界各国对该类药物残留限量的检测要求,可以应用在进出口河豚鱼检测中。
[1] 李岩, 邵兵, 徐锁洪. 动物性食品中大环内酯类抗生素残留分析[J].中国卫生检验杂志, 2005, 10(15): 1273-1277.
[2] 王炼, 杨元, 高玲, 等. 动物性食品中11种兽药残留的高效液相色谱(HPLC)法测定[J]. 中国卫生检验杂志, 2004, 14(3): 276-2781.
[3] 农业部. 农牧发(1999)第17号 关于发布《动物性食品中兽药最高残留限量》的通知[B]. 1997-09-01.
[4] 王实, 夏书月, 王鲁宁, 等. 阿奇霉素在肺炎患者支气管灌洗液中的浓度测定[J]. 中国医院药学杂志, 1999, 19(8): 457-458.
[5] 姜敏, 戴群, 傅颖君, 等. 国产阿奇霉素人体药代动力学及生物等效性研究[J]. 江西医学院学报, 1999, 39(3): 25-28.
[6] 李平. 硫酸呈色-分光光度法测定红霉素片的溶出度[J]. 齐齐哈尔医学院学报, 2002, 23(9): 1068-1069.
[7] 汤玖安, 刘兴兰. 乙酰吉他霉素含片含量均匀度方法研究[J]. 药物分析杂志, 1999, 19(5): 342-343.
[8] 晏敏红, 俞丽君, 周建忠. 紫外分光光度法测定琥乙红霉素颗粒剂的含量[J]. 中国药业, 2003, 12(1): 42.
[9] 魏振平, 毕殿洲. 比色法、薄层色谱法及高效液相色谱法在罗红霉素溶液稳定性研究中的比较[J]. 中国药学, 2000, 9(4): 202-207.
[10] 周志凌, 冷智生, 金建平, 等. 十四元环大环内酯类抗生素薄层鉴别方法研究[J]. 中国药事, 2004, 18(7): 437-438.
[11] 史岑, 董家文. 体内大环内酯类抗生素的药物分析方法[J]. 中国医院药学杂志, 2001, 21(3): 169-171.
[12] 夏敏. 液相色谱-质谱法同时检测畜禽肉中5种大环内酯抗生素[J].分析测试学报, 2004, 23(1): 217-2191.
[13] 胡昌勤, 尹利辉. 毛细管电泳及其在抗生素分析中的应用[J]. 国外医药: 抗生素分册, 2000, 9(21): 193-197.
[14] 史向国, 钟大放. 液相色谱-质谱联用法鉴定必特螺旋霉素中多组分[J]. 质谱学报, 2003, 4(24): 460-463.
[15] 田蕾, 钟大放. HPLC-ECD与HPLC-MS联用测定人尿样中的罗红霉素及其代谢物[J]. 中国药学杂志, 1999, 34(5): 318-321.
[16] DUBOIS M, FLUCHARD D, SIOR E, et al. Identification and quantification of five macrolide antibiotics in several tissues, eggs and milk by liquid chromatography electrospray tandem mass spectrometry[J]. Jorunal of Chromatography B, 2001, 753(2): 189-202.
[17] JUHEL-GAUGAIN M, ANGER B, LAURENTIE M. Multiresidue chromatographic method for the determination of macrolide residues in muscle by high-performance liquid chromatography with UV detection[J]. J AOAC Int, 1999, 82(5): 1046-1053.
[18] DUBOIS M, FLUCHARD D, SIOR E, et al. Determination of macrolide antibiotics by liquid chromatography[J]. J Chromatogr A, 2001, 910(2): 285-290.
[19] HORIE M, TAKEGAMI H, TOYA K, et al. Determination of macrolide antibiotics in meat and fish by liquid chromatography-electrospray mass spectrometry[J]. Anal Chim Acta, 2003, 492(1/2): 187-197.
[20] HORIE M, SAITO K, ISHII R, et al. Simultaneous determination of five macrolide antibiotics in meat by high-performance liquid chromatography[J]. J Chromatogr A, 1998, 812(1/2): 295-302.
[21] KANEKO S, KOIZUMI I, ASIDA K, et al. An analytical study of antibacterial residues in meat: the simultaneous determination of 23 antibiotics and 13 drugs using gas chromatography[J]. Vet Hum Toxicol, 1992, 34(5): 393-397.
[22] PRATS C, FRANCESCH R, ARBOIX M, et al. Determination of tylosin residues in different animal tissues by high performance liquid chromatography[J]. J Chromatogr B, 2001, 766(1): 57-65.
[23] MORAN J W, TURNER J M, COLEMAN M R. Determination of tilmicosin in bovine and porcine sera by liquid chromatography[J]. J AOAC Int, 1997, 80(6): 1183-1189.
[24] 国家质量监督检验检疫总局. GB/T 20762—2006 畜禽肉中林可霉素、竹桃霉素、红霉素、替米考星、泰乐菌素、克林霉素、螺旋霉素、吉它霉素、交沙霉素残留量的测定方法: 液相色谱-串联质谱[M]. 北京: 中国标准出版社, 2006.
Determination of 5 Macrolide Antibiotics in Pufferfish Meat by HPLC-ESI-MS/MS
TIAN Feng1,WANG Fei2,LU Peng1,YAN Shu-feng1,LIAN Li1
(1. Heihe Entry-Exit Inspection and Quarantine Bureau, Heihe 164300, China;2. Qinhuangdao Entry-Exit Inspection and Quarantine Bureau, Qinhuangdao 066004, China)
A method has been developed for the simultaneous determination of five marcolide antibiotic residues including lincomycin, oleandomycin, erythromycin, tilmicosin and tylosin in pufferfish meat. Five antibiotic residues in samples were extracted into Tris buffer. The extract was cleaned up on an Oasis HLB column. The antibiotic residues were determined and confirmed by LC-MS/MS and quantified by an internal standard method. The calibration curves of 5 antibiotics exhibited good linearity in the concentration range of 0.002-0.050μg/mL with a correlation coefficient range of 0.9977-1.0000. The average recovery rates of the marcolide antibiotics from pufferfish samples at spike levels of 0.002-0.010 mg/kg was 78.9%-109.0% with a relative standard deviation of 1.3%-5.3% for repeatability and with a relative standard deviation of 5.2%-14.5% for reproducibility. The detection limit was 2.0μg/kg for these 5 antibiotics.
high performance liquid chromatography-tandem mass spectrometry (HPLC-MS/MS);solid phase extraction (SPE);macrolide antibiotics;pufferfish
TS207.3;O657.63
A
1002-6630(2012)18-0206-05
2011-07-28
田丰(1 97 0—),女,高级工程师,学士,主要从事食品、农副产品中农、兽药残留检测研究。E-mail:tfhh-8999@163.com

