RNAi沉默核因子-B亚单位p65表达抑制胃癌细胞侵袭
朱祥 朱灵 范钰
RNAi沉默核因子-B亚单位p65表达抑制胃癌细胞侵袭
朱祥 朱灵 范钰
目的 采用RNA干扰(RNA interference,RNAi)技术敲除胃癌细胞核因子-kappa B(nuclear factor-B,NF-B)亚单位p65后,观察其对细胞增殖和侵袭力的影响。方法 采用p65小干扰RNA (small interfering RNA,siRNA)转染胃癌细胞后,采用Western Blot检测细胞p65蛋白,分别采用软琼脂集落培养试验和Ttanswell检测癌细胞增殖和侵袭能力。结果 siRNA转染组细胞p65蛋白明显被抑制,且呈浓度依赖性。与对照组比较,转染组细胞所形成的软琼脂集落数和穿膜细胞数明显减少,且呈时间和浓度依赖性。结论 针对NF-B重要亚单位的p65 siRNA可抑制胃癌细胞侵袭。研究发现,NF-B途径的激活是胃癌等肿瘤细胞生存的重要机制之一。
胃肿瘤;核因子;p65;侵袭
核因子-kapp B(nuclear factor-B,NF-B)是一个关键的基因表达调控子。是与细胞增殖、凋亡等有关[1]。NF-B由许多同型二聚体组成,包括p50,p52,p65(RelA),RelB和c-Rel亚单位[2]。一般情况下,NF-B在大多数细胞静息不活动,当遇到一些刺激因子时,易位到核内而发挥作用[3]。有学者发现,胃癌组织中NF-B激活,并与肿瘤侵袭、淋巴结转移、侵润深度、腹膜转移正相关[4]。但在胃癌细胞中NF-B可能的侵袭作用尚不清楚。
本研究采用RNA干扰(RNA interference,RNAi)技术,以针对NF-B亚单位p65的小干扰RNA(small interfering RNA,siRNA)转染人胃癌细胞AGS,观察了对胃癌细胞侵袭的影响。
1 方法
1.1 细胞培养及转染处理 人胃癌AGS细胞在含10%胎牛牛血清的RPMI-1640培养液,37℃、5%CO2、饱和湿度环境的条件下连续培养。转染前1 d,将浓度为1.0×105/ml的细胞接种于24或6孔培养板,培养过夜。次日进行转染。细胞分组:①空白对照组。②脂质体对照组。③浓度为(6.25、12.5和25 nM)的siRNA转染组。
1.2 Western Blot检测p65蛋白 收集各组细胞,提取蛋白后,测定蛋白浓度。取p65蛋白20 μg上样。采用常规wetern blot方法检测各蛋白水平。anti-p65和anti-β-actin抗体浓度为1∶1000。最后进行蛋白条带显色。
1.3 软琼脂集落形成试验 常规进行软琼脂集落培养试验,试验方法参照文献[5]进行。
1.4 体外侵袭试验 采用Transwell方法检测癌细胞侵袭能力,试验方法参照文献[5]进行,计算各组穿过滤膜的癌细胞数目。
1.5 统计学方法 采用SPSS 17.0进行数据处理。P<0.05为差异有统计学意义。
2 结果
2.1 siRNA对胃癌细胞p65蛋白和NF-B活性的影响 结果显示,65 siRNA转染组p65蛋白水平和NF-κB活性明显被抑制,且呈浓度依赖性(P<0.05)。
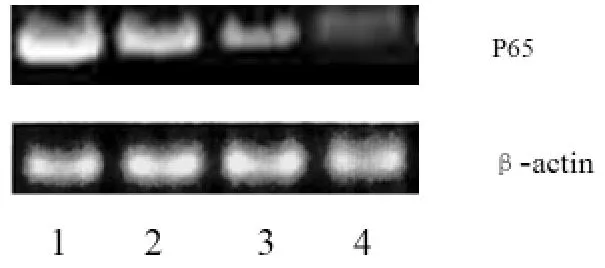
图1 胃癌细胞p65蛋白水平(48 h)
2.2 软琼脂集落形成试验 结果显示,胃癌AGS细胞在体外半固体培养体系中可以自发地形成集落,而经p65 siRNA转染的细胞集落生长呈剂量依赖性减少(P<0.05)。见图2。
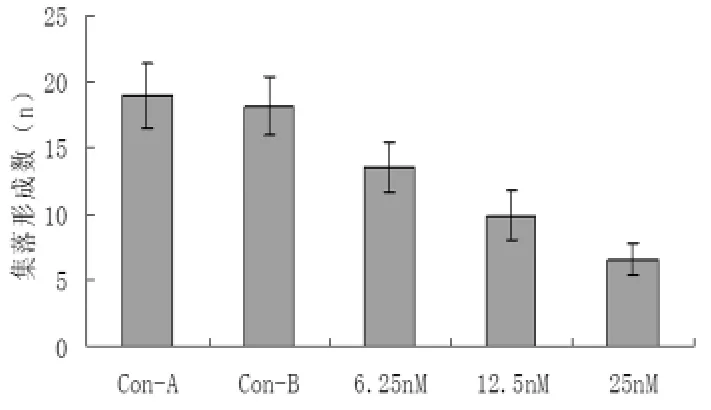
图2 p65 siRNA转染对胃癌细胞锚着不依赖性增殖的影响
2.3 p65 siRNA对胃癌细胞侵袭的影响 结果显示,与空白对照组和脂质体对照组比较,siRNA组穿过滤膜的细胞数明显下降,且与浓度相关(P<0.05)。
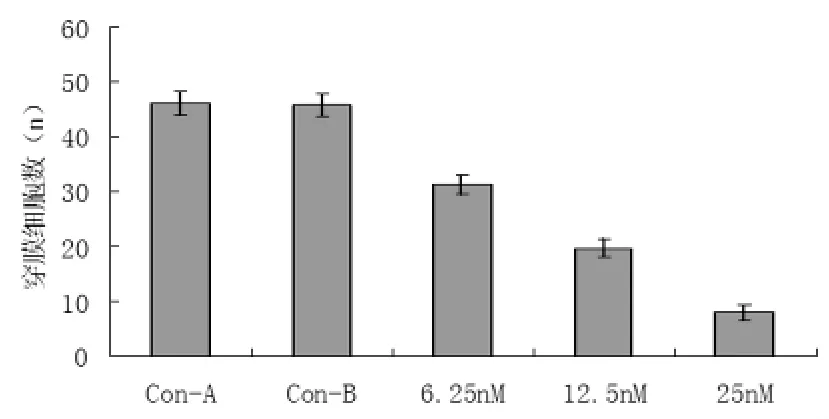
图3 p65 siRNA转染对胃癌细胞侵袭的影响
3 讨论
本研究针对p65基因特点,设计合成siRNA,转染了胃癌AGS细胞,采用Western Blot检测了胃癌细胞p65蛋白水平,发现转染组p65蛋白水平明显受到抑制,且呈浓度依赖性。说明采用siRNA下调p65蛋白水平可抑制胃癌细胞NF-κB活性。也说明该siRNA可作为研究p65在胃癌侵袭作用中的有力工具。
肿瘤细胞可以锚着不依赖性生长。肿瘤细胞在软琼脂形成集落的多少可反映肿瘤细胞锚着依赖性的特性,且与其恶性程度呈正相关。本研究发现,经不同浓度的p65 siRNA转染处理后,癌细胞软琼脂形成集落数明显减少,且呈剂量依赖性。Boyden小室模型检测发现,经siRNA转染处理后的胃癌细胞穿膜细胞数显著减少,且呈浓度依赖性。说明,敲除p65基因表达可在一定程度上抑制胃癌细胞的增殖和侵袭能力。
综上所述,采用RNAi技术敲除NF-B重压亚单位p65表达,可抑制胃癌细胞增殖和恶性侵袭能力。
[1] Ghosh S,May MJ,Kopp EB.NF-kappa B and Rel proteins:evolutionarily conserved mediators of immune responses.Annu Rev Immunol,1998,16:225-260.
[2] Thanos D,Maniatis T.Virus induction of human IFN beta gene expression requires the assembly of an enhanceosome.Cell,1995,83 (7):1091-1100.
[3] Ghosh S,Karin M.Missing pieces in the NF-kappaB puzzle.Cell,2002,109(Suppl):S81-96.
[4] Sasaki N,Morisaki T,Hashizume K,et al.Nuclear factor-kappaB p65(RelA)transcription factor is constitutively activated in human gastric carcinoma tissue.ClinCancerRes,2001,7(12): 4136-4142.
[5] Fan Y,Zhang YL,Wu Y,et al.Inhibition of signal transducer and activator of transcription 3 expression by RNA interference suppresses invasion through inducing anoikis in human colon cancer cells.World J Gastroenterol,2008,14(3):428-434.
Inhibition of RNA interference against p65 subunit of the nuclear factor-κB on invasion of gastric cancer cell
ZHU Xiang,ZHU Ling,FAN Yu.Cancer Institute,Affiliated People's Hospital of Jiangsu University,Zhen-jiang 212002,China
ObjectiveTo study the effects of siRNA against the p65 subunit of nuclear factor-B(NFB)on invasion and anchorage-independent growth of gastric cancer cell line AGS.MethodsGastric cancer cell line AGS were transfected with different dose of p65 siRNA by use of oligofecamine.The expression of p65 protein and NF-B activity were detected by western blot.The anchorage-independent growth of cancer cells were determined by colony formation in soft agar.The invasion ability of gastric cancer cells were evaluated using Transwell.ResultsThe expression of p65 protein of tranfected cell inhibited significantly in a dose-dependent manner.Compared with control group,both colony formation in soft agar and cells traversed membrane of transfected cells reduced significantly in a dose-dependent manner,rescpectively.ConclusionThese data here indicated knock-downing p65 expression might inhibit invasion ability of gastric cancer cell.
Gastric carcinoma;Nuclear factor-B;p65;Invasion
镇江市科技计划项目(项目编号:SH2009014)
212002镇江,江苏大学附属人民医院肿瘤研究所
范钰

