蛋白质氧化及其对机体氧化还原状态的影响
顾书媛,余 静,莫 玲,徐晶冰,陈 颖,施用晖,2,*
(1.江南大学食品学院食品营养与功能因子研究中心,江苏无锡 214122;2.江南大学食品科学与技术国家重点实验室,江苏无锡 214122)
蛋白质氧化及其对机体氧化还原状态的影响
顾书媛1,余 静1,莫 玲1,徐晶冰1,陈 颖1,施用晖1,2,*
(1.江南大学食品学院食品营养与功能因子研究中心,江苏无锡 214122;2.江南大学食品科学与技术国家重点实验室,江苏无锡 214122)
蛋白质的氧化会造成其结构、理化性质、功能性质发生变化。食物蛋白质氧化在加工贮藏过程中普遍存在,其对机体氧化还原状态造成的影响引起越来越多的关注。本文就蛋白质的氧化机制、氧化后发生的主要转变及食物蛋白质氧化对生物体细胞、体内外消化、体内氧化还原状态的研究进行阐述,旨在进一步探究氧化蛋白质的吸收机理及其对生物体的作用和影响。
蛋白质氧化,羰基,酪氨酸,细胞,氧化还原状态
蛋白质是生命的物质基础,是构成组织细胞一些酶类、激素类、抗体及免疫类物质的重要成分,在生命活动中承担催化、调节、运输、运动等重要功能。机体内蛋白质氧化与许多疾病如阿尔兹海默氏症[1],癫痫[2],Ⅱ型糖尿病[3]关系密切。过去的几十年,食物中脂质的氧化已经被深入的研究[4-6],蛋白质和脂类的氧化都被证实是由自由基引发产生。已有研究证明,在食品加工过程中,脂类氧化产生的自由基会引发蛋白质自由基的产生,导致蛋白质的进一步氧化。另外,脂质过氧化的二级产物MDA可直接氧化大豆蛋白、酪蛋白,使其交联生成聚合物。尽管食物蛋白质氧化也普遍存在,但食物蛋白质氧化对健康的影响研究由于缺少合适而准确的方法进展缓慢,直到这几年才逐渐得到重视[7-8]。近年,越来越多的学者开始关注蛋白质氧化后对机体氧化还原状态造成的影响[9-11]。本文主要讨论蛋白质的氧化损伤的机理及变化,及其氧化蛋白质产物对生物体内的作用与影响,为进一步揭示氧化蛋白质与机体健康之间的关系提供依据。
1 蛋白质氧化的机理
1.1 ROS介导的蛋白质氧化机制
无论在食物的加工过程中还是在体内代谢中,蛋白质的氧化都会产生。机体内的蛋白质氧化是指血浆或组织细胞的蛋白质在自由基及其相关氧化物的作用下,某些特定的氨基酸残基发生反应,导致蛋白质功能与结构上的变化,对氧化物的亲和力增强,易于水解、聚合、交联作用而导致细胞功能性异常[12]。
不管是在体内或者在体外,蛋白质的氧化很多都在自由基及其相关氧化产物的作用下造成的。细胞在代谢过程中会产生一系列活性氧(reactive oxygen species,ROS),包括羟自由基(·OH)、过氧化物自由基(ROO·)、超氧自由基阴离子(·)、次氯酸(HCLO)、过氧化氢等(H2O2)和活性氮(reactive nitrogen species,RNS)如 NO、ONOO-及 ONOOH[12]。这些自由基对蛋白质都有一定的攻击能力。蛋白质和脂类的氧化都被证实是由自由基链反应引起的,包括起始、传递、终止3个阶段[13]。脂类氧化产生的自由基引发蛋白质产生自由基、形成聚合物和蛋白质-脂类复合物的一些可能作用机制如下所示。
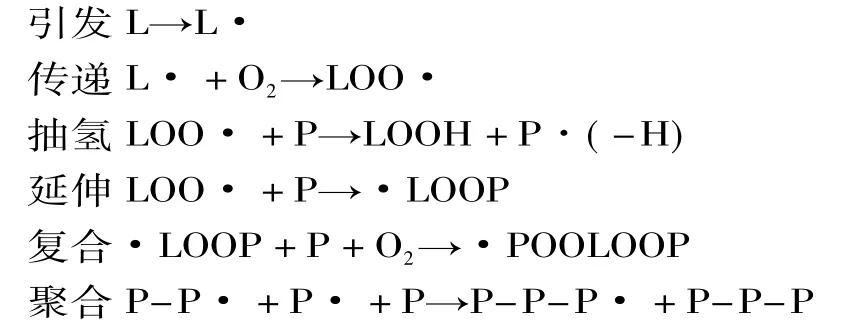
根据氧化的方式不同,活性氧能与蛋白质直接反应,也可以先与糖及脂质反应,其氧化产物再修饰蛋白质,蛋白质的肽和侧链都可以被氧化修饰[15]。
1.2 蛋白质在氧化过程中的改变
1.2.1 羰基的形成 蛋白质羰基含量是迄今蛋白质氧化最通用的指标和最常用的生物标记物[11,16]。并且在一些疾病中(包括AD,IBD,关节炎等)发现了羰基化合物的积累[11]。Stadtman[17]认为,蛋白质氨基酸分子中的游离氨基或亚氨基受活性氧攻击后,经一系列反应生成NH3和相应羰基衍生物。氨基酸侧链的直接氧化会形成羰基,如赖氨酸残基氧化产生的α-氨基己二酰基半醛,精氨酸残基氧化产生的谷氨酸半醛等[14];活性氧致肽链骨架的断裂也会形成羰基[14]。活性羰基类物质(reactive carbonyl species,RCS)包括:脂质过氧化过程中产生的RCS(如二醛、酮醛等)和非酶糖基化过程中产生的RCS(如乙二醛、酮胺、酮醛等)会与蛋白质初级氨基酸残基发生羰-氨交联,诱导蛋白质发生羰基化修饰[15]。其中,有金属离子参与的蛋白质羰基衍生物的形成是活性氧作用的一种重要形式,如图1所示。
1.2.2 肽链中氨基酸残基的改变 蛋白质残基中的氨基酸残基是活性氧的主要攻击对象。几乎所有的氨基酸都可以被自由基攻击,但不同的氨基酸对自由基的敏感程度不同。在众多的氨基酸残基中,半胱氨酸Cys可能是最敏感的氨基酸残基,通常第一个被氧化,这可能是由于其包含硫元素的活性中心具有高度的敏感性。侧链含有巯基、硫醚、氨基、咪唑环、吲哚环的氨基酸残基的氧化易受一些脂类氧化的引发[14]。表1列出了一些氨基酸残基经过氧化修饰后的改变。
从表中可以看出有些氨基酸的氧化产物有多种,可能是由于氧化终产物的具体反应途径和化学性质取决于氧化系统和氧化条件的强度[18]。氨基酸的氧化会进一步改变蛋白质的二级、三级结构,有可能导致蛋白质的变性而失去其生物活性。
1.2.3 巯基的转化 半胱氨酸Cys中的巯基对于氧化十分敏感,特别是在H2O2存在的情况下。氧化修饰使半胱氨酸成为胱氨酸,蛋氨酸成为蛋氨酸亚砜[14];在对肉制品的研究中发现,肉中的蛋白水解酶(以Cys为酶活性中心)由于蛋白质氧化、二硫键形成,而表现出酶活性降低。巯基团的氧化导致了一系列复杂的反应,从而产生了许多氧化产物如次磺酸RSOH,亚磺酸RSOOH和二硫交联物RSSR,如下所示。
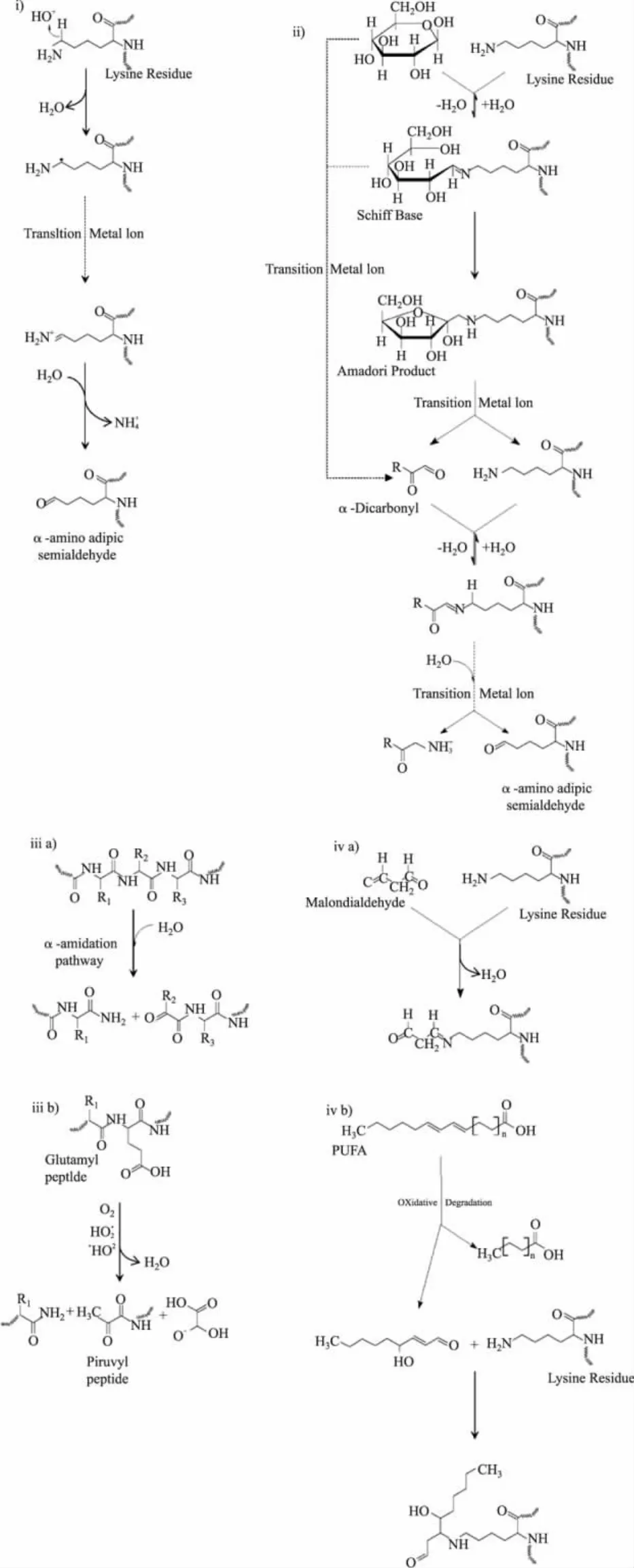
图1 蛋白质羰基化的四个途径[16]Fig.1 Four ways of protein carbonylation[16]
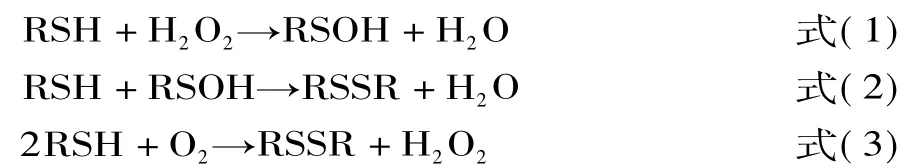
1.2.4 酪氨酸转化为双酪氨酸、硝基酪氨酸、3-氯酪氨酸 羟基自由基(·OH)攻击蛋白质会增加双酪氨酸的形成。·OH的氢抽提作用能使酪氨酸形成酪氨酰基,在酪氨酰基之间及酪氨酰基与酪氨酸之间可发生反应形成稳定的双酪氨酸(如图2所示)。双酪氨酸既可以在分子内也可以在分子间形成,是蛋白质聚合的一个诱因[20]。

表1 氨基酸残基侧链的氧化产物[14]Table 1 Oxidation product of amino acid residues side chain[14]
活性氧与活性氮不仅可以造成蛋白质的氧化损伤,还可以与蛋白质酪氨酸残基或游离酪氨酸发生硝化反应,生成稳定的3-硝基酪氨酸。氨基酸硝化后,体内许多具有重要功能的酶活性下降,因这些酶无法发挥催化作用,间接损伤线粒体及DNA,诱导细胞凋亡和死亡。有研究表明,许多疾病如动脉粥样硬化、高血压、神经系统疾病等与酪氨酸的硝基化有关[21-22]。
细胞代谢过程中能够生成次氯酸,如H2O2在MPO(髓过氧化物酶)存在的情况下,能够氧化氯化物生成次氯酸,中性粒细胞也可以生成次氯酸。次氯酸能够氧化蛋白质中的酪氨酸生成3-氯酪氨酸。有研究发现,3-氯酪氨酸的在体内的含量与多种疾病(如帕金森氏病、哮喘、动脉粥样硬化等)的发生有着密切的关系[22-23]。
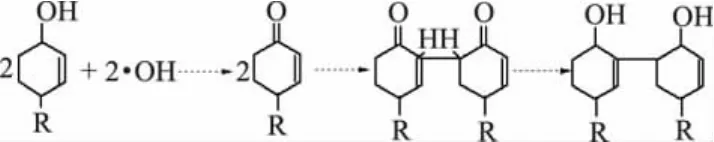
图2 双酪氨酸形成过程[20]Fig.2 Dityrosine forming process[20]
1.2.5 蛋白质的交联与肽链断裂 许多活性氧及其他氧化剂攻击蛋白质后,诱导蛋白质分子中非极性氨基酸残基暴露,改变了蛋白质的疏水性。此外,氨基酸残基受到活性氧的氧化后,与邻近的来自其他氨基酸的残基发生交联,会形成二硫键、双酪氨酸、二醛化合物等,进一步引发了蛋白质-蛋白质交联[14]。这样的交联可能会使蛋白质的活性中心发生变化,进而丧失其功能活性。食品在加工过程中也会产生蛋白质交联。牛血浆清蛋白在110~145℃加热27h,由赖氨酸和谷氨酰胺残基形成ε-N-(γ-谷氨酰)赖氨酰胺[ε-N-(γ-glutamyl)lysyl amide]交联键[24]。对牛奶进行高温瞬时灭菌,奶产品的回流比越大,生成的赖丙氨酸越多[25]。已有研究发现,赖丙氨酸是引起白鼠肾脏病变的物质[26]。
蛋白质间除了可能发生聚合以外,也有可能发生肽的断裂。活性氧导致蛋白质肽链断裂的方式可能不止一种。李培峰[27]等发现,在氨基酸被自由基攻击处容易发生肽链的断裂,特别容易发生在被攻击的脯氨酸处。活性氧攻击脯氨酸使之引入羰基而生成α-吡咯烷酮,经水解与其相邻的氨基酸之间断开,α-吡咯烷酮成为新的N-末端,它可进一步水解生成谷氨酰胺。孙存普[28]等研究发现,·OH能抽取α碳原子上的氢,使其氧化为过氧基,肽键转变成为亚氨基肽的中间产物,在酸性条件下,亚氨基肽水解断裂。
2 氧化蛋白质功能性质的改变
蛋白质经氧化修饰,其二、三级结构均有所改变,进而改变了蛋白质在食品中的功能性质。此处的功能性质主要指食品体系在加工、贮藏、制备和消费期间影响蛋白质在食品体系中性能的那些物理和化学性质,例如蛋白质的溶解度、持水能力、乳化能力、起泡能力、凝胶化作用等。这些性质会对食品的质构、风味和加工性状产生重大影响[29]。吴伟[30]在蛋白质氧化对大豆蛋白功能性质研究中发现,大豆蛋白在加工过程中受到剪切、挤压等外力的作用,细胞被破坏,不饱和脂肪酸氧化产生的自由基进一步诱导了蛋白质的氧化。丙烯醛和高浓度 AAPH、HPODE以及MDA氧化可使得大豆蛋白溶解度出现显著性下降;此外,蛋白质氧化使得大豆蛋白凝胶强度下降,ROO·和MDA氧化大豆蛋白的凝胶强度下降程度最大;大豆蛋白凝胶的硬度随着蛋白质氧化程度的增大而减小。在对乳蛋白的研究中发现,由氧化引起的蛋白质物理化学变化,会增加或降低乳蛋白质凝胶能力,并影响乳蛋白的乳化及持水能力[14]。崔旭海[31]等在对乳清蛋白中的研究发现,乳清蛋白在氧化的情况下溶解性降低超过35%,凝胶强度降低达85%以上。在对肉制品的研究中发现,肉中的肌原纤维蛋白对于氧化修饰十分敏感,而肌原纤维蛋白对肉的功能性质起着主要作用。肌原纤维蛋白经氧化交联对肉制品的持水力及多汁性有负面影响。肉的嫩度也因为蛋白质的氧化而下降[19]。
3 评价蛋白质氧化程度的指标
蛋白质发生氧化后需要对蛋白质氧化程度进行分析。蛋白质中羰基衍生物的含量、游离巯基的含量、蛋白质的表面疏水性以及双酪氨酸含量等通常会被选取作为分析的指标。色氨酸残基在有过渡金属存在时会被即时氧化,这个现象被认定为是蛋白质早期氧化的标志[31-32]。
蛋白质的羰基化是一个非酶促且不可逆的修饰。蛋白质的羰基化是蛋白质氧化损伤的敏感指标。其中在MCO(金属催化氧化)体系中,苏氨酸转化为α-氨基-3酮丁酸,赖氨酸转化为α-氨基己二酸半缩醛(AAS),精氨酸和脯氨酸转化为γ-谷氨酸半缩醛(GGS)。其中AAS和GGS被视为蛋白质氧化损伤的生物标记物[33]。
目前,2,4-二硝基苯肼法(DNPH)是测定羰基含量最常用的方法。羰基可与2,4-二硝基苯肼反应生成2,4-二硝基苯腙,通过对2,4-二硝基苯腙的测定进一步确定羰基的含量。此外还有硼氢化钠法、荧光素肼法、荧光胺法等[20]。
目前公认的巯基含量的测定方法是DNTB比色法,原理是利用 5,5'-二硫代二硝基苯甲酸盐(DNTB)与游离-SH反应,反应产物是一种在412nm处生成有最大吸收峰的黄色物质,采用分光光度计法测定。该法快速、简便,是一种理想的方法[12]。
测定蛋白质表面疏水性的方法主要有两种,一种是测定蛋白质平均疏水值的荧光探针法,另一种是 SDS结合法[12]。耿玮蔚[34]等在实验中比较了这两种方法,结果表明两种方法具有较好的相关性。
双酪酸的测定法方比较多。很多研究是参考Davies[35]文献中描述的方法来测定乳清蛋白中的二聚酪氨酸含量的。采用气相色谱/质谱(HPLC-MS)联用也可以测定酪氨酸残基氧化产物[12]。
4 食物蛋白质氧化对生物学功能的影响
体内细胞蛋白质氧化会导致其氨基酸残基的修饰,例如羰基、二硫键、双酪氨酸的形成,肽链的交联与断裂等,这样的修饰一方面会使得蛋白质的生理活性发生变化,另一方面会对机体的氧化还原状态产生影响。在体外细胞培养研究发现,蛋白质在经过上述修饰变化后,会对细胞功能产生影响。但是,摄食氧化的蛋白质,是否能被消化吸收,是否对体内产生作用,目前研究得非常少。
4.1 蛋白质氧化对细胞的影响
Mark[36]等研究发现,蛋白质与肽的 Tyr,Trp,His残基极易形成其氢过氧化物。当金属离子与氧化的巯基存在时,它们通过非自由基反应进一步促进自由基生成,造成二次损伤;Trp、Tyr衍生肽过氧化物在细胞内存留期长,不容易被胞内保护性酶所清除,并且可钝化巯基依赖的酶,抑制细胞半胱氨酸、天冬氨酸蛋白酶活性,促进细胞凋亡,其细胞毒性是H2O2的30倍,并且会引起免疫细胞炎症及自由基的氧化反应。
Rahmanto[37]等观察到在小鼠巨噬样细胞培养液中,加入氧化处理的牛血清白蛋白及 N-Ac-Trp-OMe氢过氧化物,会导致细胞内巯基依赖酶活性钝化、细胞总巯基及GSH显著降低,抑制溶酶体组织蛋白酶以及细胞凋亡蛋白酶的活性,其毒性是H2O2的100倍。
4.2 蛋白质氧化对消化的影响
氧化蛋白质在人体内的生物学作用,包括其在体内的消化、吸收及其对体内代谢的影响。
食品加工中,含低糖的蛋白质食品如鱼和肉,在湿润或干燥下强烈加热可引起胱氨酸显著破坏,赖氨酸也有所损失,氮消化率及多种氨基酸的利用率下降严重。主要原因是:处理过程中多肽链内部和肽链间产生了许多对抗蛋白酶作用的交联键,它们掩蔽了蛋白酶的作用位置,从而降低了酶水解的程度[24]。
目前,少数体外模拟实验研究了氧化对蛋白质消化率的影响。Zamora R[38]等的研究表明,经脂质的过氧化产物4,5(E)-环氧-2(E)-庚烯醛氧化修饰后的牛血清蛋白对胰凝乳蛋白酶、胰酶、链霉蛋白酶、胰蛋白酶水解易感性下降。H2O2/氯化血红素交联的肌动蛋白酶解易感性下降[39]。肌动蛋白经FeCl3/H2O2/抗坏血酸盐体系氧化后,对胃蛋白酶、胰蛋白酶和胰凝乳蛋白酶的水解易感性增加[40]。Santé-Lhoutellier[41]等在通过研究被羟基自由基氧化的猪肉肌原纤维蛋白后发现,消化道中酶对经氧化的肌原纤维蛋白的消化能力下降,经羟基自由基氧化损伤的蛋白质与蛋白质消化率的减少有直接且定量的关系。暗示适度的蛋白质氧化可能有助于蛋白质消化率的提高,但经历过度氧化,蛋白质消化率会降低。
4.3 食物蛋白质氧化对体内氧化还原状态的影响
介于蛋白质和氨基酸间的肽类,许多具有抗氧化活性。在大豆蛋白源抗氧化肽的研究中,A Moure[42]等研究了大豆蛋白浓缩物经超滤酶解后所得的片段具有抗氧化性能,发现相对分子质量小于10的肽片断抗氧化活性最强。荣建华[43]等以大豆分离蛋白为原料制备出相对分子质量小于10000的大豆肽,发现大豆肽的抗氧化能力随其浓度的增加而增强,在一定浓度范围内,大豆肽清除·OH效果较强。王建化[44]通过油脂的抗氧化实验,证明花生抗氧化活性肽具有明显的抗氧化活性,5%的花生抗氧化活性肽抗氧化效果与3%的维生素E抗氧化效果相当。
JL Cup[45]等研究了小鼠对蛋氨酸和16种蛋氨酸氧化衍生物的利用与生长的影响,发现小鼠对L-蛋氨酸的衍生物的生物学利用效率普遍降低。可能是氨基酸氧化之后被机体吸收,氧化修饰的氨基酸残基会存在于消化液中,肠道需要提供更多的还原力将其还原,这对肠道的氧化还原的微环境产生很大影响。
氧化的肽被吸收,可能对我们的肠道环境产生负面作用,其自身的一些活性也会丧失。从小麦蛋白酶解产物中提取的小麦肽具有抗氧化的作用[46]。唐雪[47]等研究以100℃加热及脂质氧化(MDA氧化)两种方式处理对小麦肽的性质和生物活性的影响后发现,小麦肽经加热氧化后,其DPPH自由基清除率较原肽显著降低,加热时间越长,自由基清除率降低越多;经MDA氧化的小麦肽对·OH、DPPH自由基清除率较原肽也下降明显。HPLC分析显示,MDA氧化引起分子发生大量聚集,大分子蛋白、肽含量显著增加。通过对小鼠短期灌胃观察到,小麦肽加热0,60,90,120min,加热时间越长,动物血液自由基的水平越高。显示小麦肽经氧化后抗氧化能力下降,无法正常的清除体内的自由基。
含有酪氨酸的肽,如Aβ淀粉样肽可以在低浓度Cu2+等二价离子的诱导产生自由基,形成肽的氢过氧化物,自身进一步产生高聚合度的分子,加速自由基的生成,成为氧化应激的递呈物,引起细胞内蛋白质羰基化修饰、双酪氨酸、晚期氧化蛋白、羰基化蛋白增多[48]。
吴秋萍[10]等人用加热、MDA(丙二醛-脂质过氧化反应产物)氧化修饰大豆蛋白对小鼠进行6周饲喂,观察到摄入氧化大豆蛋白组小鼠全血、胰腺、肝脏、十二指肠、空肠自由基水平相比于对照组显著提高(p<0.01),其中MDA氧化组自由基水平最高;氧化组(加热和MDA氧化)肝脏、十二指肠、空肠SOD、T-AOC活力显著降低。此外,结果显示氧化大豆蛋白膳食能显著提高小鼠血浆、胰腺、肝脏、十二指肠、空肠中MDA的含量。
吴伶艳[49]等人对小鼠进行短期灌胃,比较加热90min酪蛋白、MDA酪蛋白灌胃后血液中的自由基含量的动力学,观察到加热及MDA氧化酪蛋白小鼠血液自由基含量显著高于生理盐水和正常酪蛋白组。测定了灌胃酪蛋白2h后肝脏、空肠、十二指肠组织丙二醛(MDA)、还原性谷胱甘肽(GSH)、总抗氧化能力(T-AOC)后观察到,组织中的 GSH、T-AOC均比正常酪蛋白组显著下降,而MDA呈显著上升趋势。进一步HPLC-MS分析MDA氧化酪蛋白组的小鼠小肠食糜、门静脉、外周血中肽的组成,出现了对照组中没有的含羰基类物质,暗示氧化的蛋白消化产物吸收进入循环。
机体氧化还原状态失衡是造成组织细胞物质能量代谢异常的重要诱因,Kara[50]等给小鼠注入天然淀粉样肽聚合物后出现类似阿尔茨海默氏病的记忆丧失现象。
食糜的氧化蛋白进入体内的变化,它们的吸收机理、可能对体内产生的氧化作用、以及是否会对机体健康产生影响,这些问题都值得我们进一步探究。蛋白质的氧化是一个很活跃的领域,也日益受到重视,进一步探明氧化蛋白质对蛋白质自身、对机体的作用与影响以及它与疾病的关系有很大意义。
[1]Danielle G Smith,Roberto Cappai,Kevin J Barnham.The redox chemistry of the Alzheimer’s disease amyloid β- peptide[J].Biochomica et Biophysica Acta,2007,1768(8):1976-1990.
[2]Maged Abdelrahim,Elena Morris.Liquid chromatographic assay of dityrosine in human cerebrospinal fluid[J].Journal of chromatography,1997,696:175-182.
[3]Altomare E,Grattagliano I,Vendemaile G,et al.Oxidative protein damage in human diabetic eye:evidence of a retinal participation[J].Eur J Clin Invest,1997,27(2):141-147.
[4]Wood J D,R I Richardson,G R Nute,et al.Effects of fatty acids on meat quality:a review[J].Meat Science,2004,66(1):21-32.
[5]Edwin N Frankel.Recent advances in lipid oxidation[J].Journal of the Science of Food and Agriculture,1990,54(4):495-511.
[6]Mcclements D J,E A Decker.Lipid oxidation in oil-in-water emulsions:impact of molecular environment on chemical reactions in heterogeneous food systems[J].Journal of Food Science,2000,65(8):1270-1282.
[7]吴志贤,蛋白质氧化的研究进展[J].临床检验杂志,2007,25(6):476-477.
[8]Rodney L Levine,Earl R Stadtman.Oxidative modification of proteins during aging[J].Experimental Gerontology,2001,36(9):1495-1502.
[9]吴伶艳.氧化酪蛋白对小鼠氧化还原状态及记忆能力的影响[D].无锡:江南大学,2011.
[10]吴秋萍,王姣,乐国伟,等.加热或丙二醛氧化大豆蛋白对小鼠体内自由基水平及抗氧化能力的影响[J].营养学报,2011,33(1):14-18.
[11]Flint Beal M.Oxidatively modified proteins in aging and disease[J].Free Radical Biology and Medicine,2002,32(9):797-803.
[12]朱卫星,王远亮,李宗军.蛋白质氧化机制及其技术评价研究进展[J].食品工业科技,2011,32(11):483-486.
[13]Schaicha K M,William A Pryorb.Free radical initiation in proteins and amino acids by ionizing and ultraviolet radiations and lipid oxidation-part III:Free radical transfer from oxidizing lipids[J].Food Science and Nutrition,1980,13(3):189-244.
[14]崔旭海,孔保华.蛋白质氧化及其对乳蛋白结构与功能性的影响[J].中国乳品工业,2008,36(1):44-47.
[15]李国林,印大中.蛋白质羰基化与衰老[J].中国老年学杂志,2008,28(20):2070-2073.
[16]Chevion M,Berenshtein E,Stadtman E R.Human studies related to protein oxidation:protein carbonyl content as a marker of damage[J].Free Radical Research,2000,33:99-108.
[17]Stadtam E R.Free radical[J].Biol Med,1990(9):315-325.
[18]Davies M J.The oxidative environment and protein damage[J].Biochimica et Biophysica Acta,2005,1703:93-109.
[19]Marianne N Lund,Marina Heinonen,Caroline P Baron,et al.Protein oxidation in muscle foods:A review[J].Molecular Nutrition & Food Research,2011,55(1):83-95.
[20]文镜,张春华,董雨,等.蛋白质羰基含量与蛋白质氧化损伤[J].食品科学,2003,24(10):153-157.
[21]吴琼,景亮.酪氨酸硝基化引起细胞功能损伤的机制及防治措施[J].国外医学麻醉学与复苏分册,2005,26(1):30-32.
[22]陈刚领,刘俊,卞卡.蛋白质特殊氧化与疾病关系的研究进展[J].中国药理学通报,2009,25(5):561-565.
[23] Mu H,Wang X,Lin P H,etal.Chlorotyrosine promoteshuman aortic smoothmuscle cellmigration through increasing superoxide anion production and ERK1/2 activation[J].Atherosclerosis,2008,201(1):67-75.
[24]刘志皋.食品营养学(第二版)[M].北京:中国轻工业出版社,2011:92-94.
[25]董攀,赵燕,杨有仙,等.蛋白质加工过程中有害物质—赖丙氨酸研究进展[J].食品科学,2011,32(15):312-316.
[26]Woodard J C,D D Short.Renal toxicity of nε-(DL-2-amino-2-carboxyethyl)-l-lysine(lysinoalanine)in rats[J].Food and Cosmetics Toxicology,1977,15(2):117-118.
[27]李培峰,方允中.活性氧对蛋白质的损伤作用[J].生命的化学,1994,14(6):1-2.
[28]孙存普,张建中,段绍瑾.自由基生物学导论[M].合肥:中国科学技术大学出版社,1999:19-20,29-30,226.
[29]王盼盼.食品中蛋白质的功能特性综述[J].肉类研究,2010(5):62-70.
[30]吴伟.蛋白质氧化对大豆蛋白结构和凝胶性质的影响[D].无锡:江南大学,2010.
[31]崔旭海,孔保华,熊幼翎.自由基氧化引起乳清蛋白溶解性、凝胶强度和乳化性变化的研究[J].食品工业科技,2009,30(2):145-148.
[32]Varsilal E,E Pesonenl,S Anderssonl.Early protein oxidation in the neonatal lung is related to development of chronic lung disease[J].Acta Paediatrica,2008,84(11):1296-1299.
[33]Akagawa M,Sasaki D,Kurota Y,et al.Formation of α-Aminoadipic and γ-Glutamic Semialdehydes in proteins by the maillard reaction[J].Annals of the New York Academy of Sciences,2005,1043:129-134.
[34]耿玮蔚,杨光,谢欣怡,等.SDS结合法测定蛋白质的疏水性[J].食品科学,2009,30(24):416-418.
[35]Davies K J,M E Delsignore,S W Lin.Protein damage and degradation by oxygen radicals.II.Modification of amino acids[J].Journal of Biological Chemistry,1987,262:9902-9907.
[36]Mark B Hampton,Philip E Morgan,Michael J Davies.Inactivation of cellular caspases by peptide-derived tryptophan and tyrosine peroxides[J].FEBS Letters,2002,527(1):289-292.
[37]Rahmanto A S,Morgan P E,Hawkins C L,et al.Cellular effects of peptide and protein hydroperoxides[J].Free Radical Biology & Medicine,2010,48:1071-1078.
[38]Zamora R,Hidalgo F J.Inhibition of proteolysis in oxidized lipid- damaged proteins[J].Journal of agricultural and food chemistry,2001,49(12):6006-6011.
[39]Kamin-Belsky N,Brillon A A,Arav R,et al.Degradation of myosin by enzymes of the digestive system:Comparison between native and oxidatively cross- linked protein[J].Agricultural and Food Chemistry,1996,44(7):1641-1646.
[40]Liu G,Xiong Y L.Electrophoretic pattern,thermal denaturation,and in vitro digestibility of oxidized myosin[J].Agricultural and Food Chemistry,2000,48(3):624-630.
[41]Santé-Lhoutellier V,Aubry L,Gatellier P.Effect of oxidation on in-vitro digestibility of skeletal muscle myofibrillar proteins[J].Agricultural and Food Chemistry,2007,55(13):5343-5348.
[42]Moure A.Antioxidant properties of ultra-filtration-recovered soy protein fractions from industrial effluents and their hydrolysates[J].Process Biochemistry,2006,41:447-456.
[43]荣建华,李小定,谢笔均.大豆肽体外抗氧化效果的研究[J].食品科学,2002,23(11):118-120.
[44]王建化,熊柳,孙高飞,等.花生抗氧化活性肽制取工艺的研究[J].中国油脂,2008,33(6):15-18.
[45]JL Cuq,P Besancon,L Chartier,et al.Oxidation of methionine residues of food proteins and nutritional availability of methionine sulfoxide[J].Food Chemistry,1978,3(2):85-102.
[46]代卉,施用晖,韩芳,等.小麦肽免疫活性及抗氧化作用的研究[J].天然产物研究与开发,2009,21(3):473-476.
[47]Xue Tang,Qiuping Wu,Guowei Le,et al.Structural and antioxidant modification of wheat peptides modified by the heat and lipid peroxidation product malondialdehyde[J].Journal of Food Science,2012,77(1):16-22.
[48]Chuan- Lin Fang,Wei- Hui Wu,Qian Liu,et al.Dual functions of β-amyloid oligomer and fibril in Cu(II)-induced H2O2production[J].Regulatory Peptides,2010,163:1-6.
[49]吴伶艳,李竹青,吴秋萍,等.氧化酪蛋白对小鼠组织抗氧化能力及血液肽组成的影响[J].世界科技研究与发展,2011,33(3):489-493.
[50]Kara A Kittelberger,Fabrizio Piazza,Giuseppina Tesco,et al.Natural amyloid-beta oligomers acutely impair the formation of a contextual fear memory in mice[J].Plos One,2012,7(1):1-7.
Protein oxidation and its impact on the redox state on body
GU Shu-yuan1,YU Jing1,MO Ling1,XU Jing-bing1,CHEN Ying1,SHI Yong-hui1,2,*
(1.Institute of Food Nutrition and Functional Factor,School of Food Science and Technology,Jiangnan University,Wuxi 214122,China;2.The State Key Laboratory of Food Science and Technology,Jiangnan University,Wuxi 214122,China)
When oxidized,the structure,physical,chemical and functional properties of protein can be changed.Food protein oxidation is common in its processing and storage.The impact of protein oxidation on the redox state of the body has caused more and more attention.The article aim was to discuss the mechanism of protein oxidation,the main changes in proteins after the oxidation and the potential effect of oxidized protein intake on cells,digestion in vivo and vitro and the redox state of the body in order to further the exploration of oxidated protein absorption mechanism and its effect on the organism.
protein oxidation;carbonyl;tyrosine;cells;redox state
TS201.2
A
1002-0306(2012)17-0382-06
2012-03-26 *通讯联系人
顾书媛(1991-),女,本科,研究方向:食品营养与功能因子。
食品科学与技术国家重点实验室资助项目(SKLF-MB-200803);国家自然科学基金(30571347)。

