果糖月桂酸单酯的分离纯化及鉴定
付 敏,赵强忠,仇超颖,刘 宁,赵谋明
(华南理工大学轻工与食品学院,广东广州 510640)
果糖月桂酸单酯的分离纯化及鉴定
付 敏,赵强忠,仇超颖,刘 宁,赵谋明*
(华南理工大学轻工与食品学院,广东广州 510640)
采用硅胶柱层析色谱对叔戊醇中固定化磷脂酶Lecitase®Ultra催化合成的果糖月桂酸单酯进行分离纯化。确定了薄层层析(TLC)条件,并通过反相-高效液相色谱-蒸发光散射检测(RP-HPLC-ELSD)测定柱层析纯化产物的纯度。利用液质联用(HPLC-ESI-MS)、红外光谱(FT-IR)和13C核磁共振(13CNMR)对目标产物进行确认,鉴定目标产物为酯化位点在1位和6位的果糖月桂酸单酯,四种异构体如下:1-月桂酸-β-D-吡喃果糖单酯、1-月桂酸-α-D-吡喃果糖单酯、1-月桂酸-β-D-呋喃果糖单酯和6-月桂酸-β-D-呋喃果糖单酯,且1-月桂酸-β-D-吡喃果糖单酯的比例最高。
果糖月桂酸单酯,固定化磷脂酶Lecitase®Ultra,薄层层析,硅胶柱层析,结构
高级脂肪酸糖酯具有两亲结构,是一类重要的非离子表面活性剂,广泛应用于食品、医药和化工等行业,具有无毒、无臭、无刺激、易生物降解等优点[1]。糖酯的合成方法有化学法和酶法:相对化学法的生产能耗高且产品的酯化位置和酯化度不易控制,酶法合成则具有高效性和特异选择性、反应条件温和、副产物较少等特点。在酶催化合成糖酯的研究中,简捷、方便的分析方法是优化合成工艺,提高转化率的关键。常用糖酯分离纯化的方法如下:TLC是最常用的方法[2],可以方便快速地对待测物质进行定性定量测定;硅胶柱层析色谱分离法,操作简单,是大量制备纯品的良好选择,常用的洗脱剂为氯仿、甲醇、乙酸乙酯等[3];气相色谱和气质联用技术[4]需要对糖酯衍生化,由于衍生化过程较复杂,因此限制了其应用;高效液相色谱(HPLC)[5],分离效果好,测定灵敏度高,但此法分离成本较高,且分离量小,难以大量制备样品。磷脂酶Lecitase®Ultra(E.C.3.1.1.32)是Novozymes公司推出的一种微生物来源的磷脂酶,同时具有较高的脂肪酶活性和磷脂酶活性[6],价格是同类脂肪酶的10%~15%。因此,本实验以叔戊醇为溶剂,利用固定化磷脂酶Lecitase®Ultra催化合成果糖月桂酸单酯,采用硅胶柱层析梯度洗脱对其进行分离纯化,并对纯化产物进行鉴定。本研究可为分离鉴定果糖月桂酸单酯提供比较系统的理论平台,为其进一步的生产和研究提供一定的理论指导。
1 材料与方法
1.1 材料与仪器
磷脂酶Lecitase®Ultra 丹麦诺维信公司;大孔吸附树脂 天津海光化工有限公司;D-果糖 上海伯奥生物科技有限公司;月桂酸 天津市大茂化学试剂厂;硅胶板G 青岛普科分离材料有限公司;柱层析硅胶 80~100目,青岛海洋化工厂分厂;4Å分子筛 天津市福辰化学试剂厂;叔戊醇(AR级) 上海阿拉丁公司;甲醇,氯仿等 均为分析纯。
754分光光度计 上海第三分析仪器厂产品;S20 pH计 瑞士梅特勒-托利多公司;DZF-6000真空干燥箱 上海益恒实验仪器有限公司;THZ-82A恒温振荡器 常州澳华仪器有限公司;Waters 600高效液相色谱仪 美国Waters公司;3300(ELSD 3300)蒸发光散射检测器 美国A lltech公司;Esquire HCT PLUS液相色谱-质谱联用仪、Vector 33傅里叶变换红外谱仪、AVANCE Digital 400MHz超导核磁共振谱仪 德国Bruker公司。
1.2 实验方法
1.2.1 磷脂酶Lecitase®Ultra的固定化[7]室温下,以大孔吸附树脂DA-201为载体,对磷脂酶Lecitase®Ultra进行吸附法固定化:以pH=7.0,0.01mol/L的Tris-HCl缓冲液为媒介,加酶量30mg/g树脂,吸附时间4h;真空干燥后,备用。
1.2.2 固定化磷脂酶Lecitase®Ultra催化合成果糖月桂酸单酯 250m L具塞玻璃瓶中加入2g果糖,7g月桂酸和80m L脱水叔戊醇,置于恒温振荡器中预平衡1h后加入5g 4Å分子筛,1.3g固定化磷脂酶,43℃下,160r/m in反应72h。
1.2.3 反应液TLC分析 取酶促反应液点于薄板的底端,在选用的展开剂中上行展开。显色剂为lg脲溶于4.5m L 85%磷酸和48m L水饱和的正丁醇混合溶液[8],将挥干的硅胶板浸渍于显色剂中2m in,自然晾干,105℃烘5m in,斑点为蓝色。
1.2.4 产物硅胶柱层析分离 将反应液过滤去除分子筛和酶(回收),旋转蒸发去除溶剂,将固体微热溶于氯仿∶甲醇=2∶1(v∶v),再通过硅胶层析柱分离制备。取浓缩液5m L上硅胶层析柱(硅胶80~100目,柱30× 500mm),收集洗出液,并用TLC监测,合并斑点相同的组分。
1.2.5 产物纯度分析 将收集到的目标组分通过RP-HPLC-ELSD进行纯度测定,按峰面积归一化法计算产物纯度。
色谱柱XBridge C18(5μm,4.6×150mm),流动相为甲醇/水=90∶10(v∶v)[9],流速为0.5m L/m in,柱温20℃,进样量10μL,ELSD漂移管温度40℃,载气流速1.5L/m in。
1.2.6 产物HPLC-ESI-MS分析[10]称取5mg收集到的目标组分溶于5m L色谱纯甲醇中,取5μL进行分析。
色谱条件:色谱柱XBridge C18(5μm,4.6×150mm);流动相为甲醇/水=80∶20(v∶v),流速0.6m L/min;检测波长210nm,柱温25℃。
质谱条件(MS):电喷雾(ESI)离子源,正离子模式,毛细管电压为188V,锥孔电压为40V,质荷比的范围m/z为100~600。
1.2.7 产物FT-IR分析 分离纯化的产物用FT-IR通过KBr压片法测定其结构,取约200mg KBr置于玛瑙钵中研碎,红外灯干燥,加5mg左右的样品,研匀、压片,在400~4000cm-1范围内扫描,扫描8次,分辨率4cm-1,得到纯化产物的红外吸收光谱。
1.2.8 产物13C NMR分析 称取收集到的目标组分100mg,以四甲基硅烷为内标,采用超导核磁共振谱仪,以氘代甲醇为溶剂[11],30℃,采用400MHz扫描,碳谱的脉冲宽度为12.75μs,脉冲功率为3.0dB,共振频率为100.62MHz,循环延迟2s,扫描1000次。
2 结果与讨论
2.1 反应液TLC分析
影响TLC对混合物进行分离效果的三个主要因素分别为:被分离物质的极性、吸附剂的活性和展开剂的极性。在本实验中被分离物质的极性和硅胶的活性是恒定的,因此主要通过改变展开剂的极性提高分离效果。
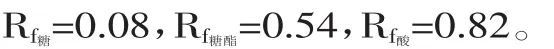
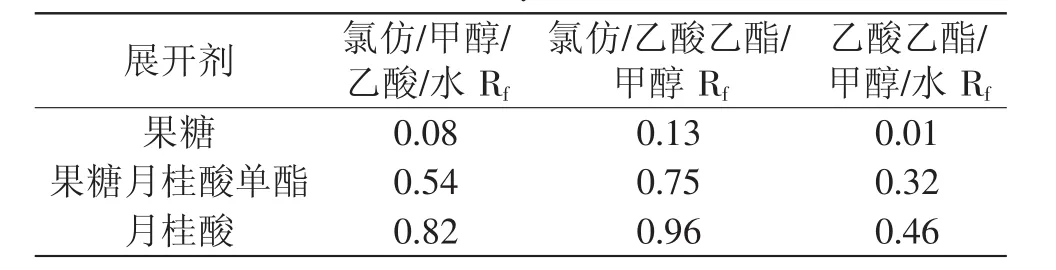
表1 展开剂组成对合成果糖月桂酸单酯的反应液分离效果的影响Table 1 Effectofmobile phase composition on separation of monolauroyl fructose
2.2 产物硅胶柱层析分离
硅胶吸附色谱分离一组极性不同的混合物时,可以通过调节洗脱剂的极性来达到较好的分离效果。果糖为强极性化合物,月桂酸为弱极性化合物,反应生成的果糖月桂酸单酯为中等极性化合物,鉴于极性的差异,可将产物进行有效地分离。Gulten Sekeroglu[12]利用硅胶柱层析对合成的糖酯进行纯化,获得良好的分离效果。
在本实验中,为分离纯化和大量制备果糖月桂酸单酯,将优化的TLC分离条件应用于硅胶柱层析,即选用氯仿∶甲醇作为流动相,再通过对流动相比例、洗脱方式、洗脱速度、进样量各因素进行优化,得出最佳色谱条件:依次采用100%氯仿、氯仿∶甲醇= 93∶7(v∶v)、氯仿∶甲醇=90∶10(v∶v)进行梯度洗脱,1.2m L/min,上样量为25g/g硅胶。产物获得良好的分离效果,结果如图1所示,随着洗脱溶剂极性的增大,月桂酸、果糖月桂酸单酯和果糖依次洗脱下来。
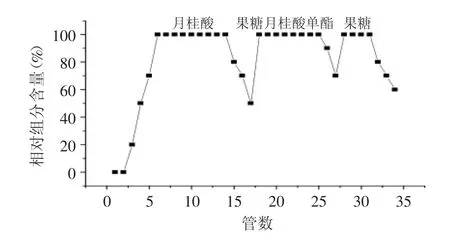
图1 固定化磷脂酶Lecitase®Ultra催化合成的果糖单酯的硅胶柱层析Fig.1 Silica gel column chromatography ofmonolauroyl fructose catalyzed by immobilized Lecitase®Ultra
2.3 产物纯度分析
对硅胶柱层析分离纯化的目标产物果糖月桂酸单酯进行纯度检测。在酯类化合物的研究中大多采用反相HPLC对产物进行分析,常用的紫外检测器(UV)和示差检测器(RID)用于糖酯分析时并不理想,使用蒸发光散射检测器(ELSD),可以取得较好的效果[13]。因此本实验采用RP-HPLC-ELSD对硅胶柱层析纯化后产物进行纯度分析。图2即为硅胶柱层析纯化后的果糖月桂酸单酯HPLC分析图谱,在实验条件下,果糖月桂酸单酯的保留时间为5.402m in。由图2中得知纯化后的果糖月桂酸单酯得到单一色谱峰,根据面积归一化法,果糖月桂酸单酯的纯度大于99%[14]。因此硅胶柱层析能够很好地分离固定化磷脂酶Lecitase®Ultra催化合成的果糖酯产物,可用于纯化产物。
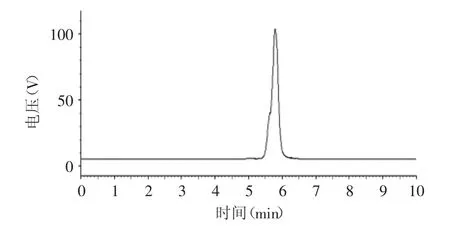
图2 硅胶柱层析纯化的果糖单酯HPLC-ELSD图谱Fig.2 HPLC chromatographic analysis ofmonolauroyl fructose purified by Silica gel column chromatography
2.4 产物HPLC-ESI-MS分析
液质联用结合了液相色谱对微量样品测量的灵敏性和质谱对物质结构信息的测定的准确性,因此是一种有效的分析物质的方法。ESI离子源适用于电离极性大且非挥发性的大分子物质,如天然的表面活性剂对其有较好的响应,且具有极低的检测极限。脂肪酸糖酯是一类非离子表面活性剂,因此运用HPLC-ESI-MS对脂肪酸糖酯进行鉴定具有良好的操作性和高灵敏性。朱金丽等[15]已利用ESI-MS对长链脂肪酸蔗糖酯进行结构鉴定。
本实验通过对上述硅胶柱层析分离纯化的果糖月桂酸单酯进行HPLC-ESI-MS分析,结果如图3所示。谱图中出现[M+Na]、[M-H2O+Na]和[M+2H2O+K]质谱信号峰分别为385.3、367.3、437.3,所对应的M值和果糖月桂酸单酯的分子量362相符合,由此得知,硅胶柱层析分离纯化的果糖酯为果糖月桂酸单酯。
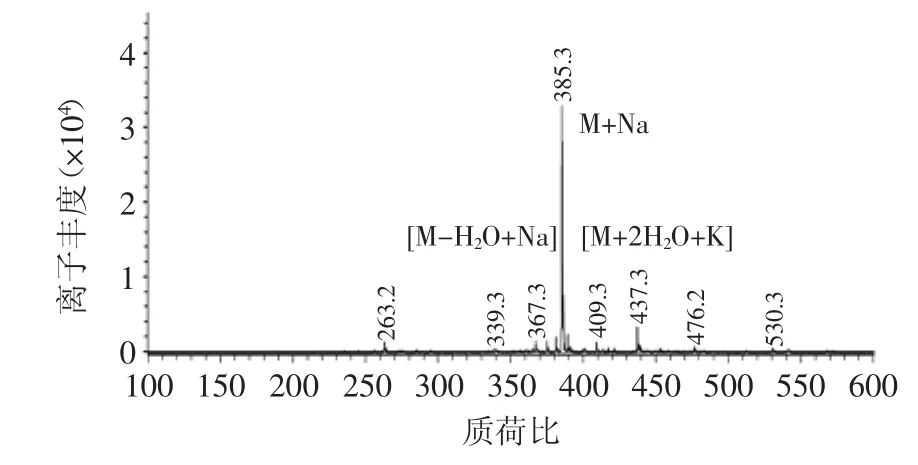
图3 果糖月桂酸单酯HPLC-ESI-MS图谱Fig.3 HPLC-MS chromatographic analysis of monolauroyl fructose
2.5 产物FT-IR分析

图4 果糖月桂酸单酯的FT-IR图谱Fig.4 FT-IR spectrum ofmonolauroyl fructose
FT-IR光谱提供了化合物中特定官能团的结构特征,根据红外吸收光谱图中特征吸收峰的位置、数目、相对强度和形状等参数可判断样品中存在哪些基团,进而对产品进行归类分析。果糖脂肪酸单酯的特征官能团为羟基和酯基。由图4可以看出,3388cm-1宽而钝的峰为缔合的-OH的伸缩振动吸收,1736cm-1的强峰为-C=O的伸缩振动吸收峰,是酯的特征吸收峰。同时从2923、1464cm-1的较强吸收和1379cm-1的较弱吸收可以看出样品-CH2多而-CH3少;在1700cm-1处没有明显的吸收峰,故可判断分离组分不含月桂酸。综上可知,经硅胶柱层析分离纯化的果糖酯为果糖月桂酸单酯。
2.6 产物13C NMR分析
在叔戊醇中,呋喃型果糖和吡喃型果糖同时存在。两种形式的果糖分别存在两种差向异构体,即α型和β型,因此D-果糖在叔戊醇中存在有4种构象,分别是β-D-吡喃果糖、α-D-吡喃果糖、β-D-呋喃果糖和α-D-呋喃果糖。图5即为固定化磷脂酶Lecitase®Ultra在脱水叔戊醇中催化果糖与月桂酸的酯化产物。由于吡喃型的六元环和β构型是优势构象,因此四种构象中以β-D-吡喃果糖占的比例最大,在参与酯化的过程中,其优势构象参与反应的机率更大[16]。
本实验对纯化后的果糖月桂酸单酯进行13C NMR分析,并结合HPLC-MS和FT-IR分析结果,如图6所示,判定产物中共有4种组分[11,17],分别为:(Ⅰ)1-月桂酸-β-D-吡喃果糖单酯(l-lauroyl-β-D-fructopyranose)、(Ⅱ)1-月桂酸-α-D-吡喃果糖单酯(1-lauroyl-α-D-fructopyranose)、(Ⅲ)1-月桂酸-β-D-呋喃果糖单酯(1-lauroyl-β-D-fructofuranose)、(Ⅳ)6-月桂酸-β-D-呋喃果糖单酯(6-lauroyl-β-D-fructofuranose)。从图谱的信号强度可知,四种组分的比例为3∶2∶1.1∶1(Ⅰ∶Ⅳ∶Ⅱ∶Ⅲ),由此可见,酰基化选择性地发生在果糖分子的1位和6位羟基上,并主要以1位羟基为主,与β-D-吡喃果糖为优势构象相符。表2为果糖月桂酸单酯的13C NMR的化学位移数据。
3 结论
3.1 确定了TLC分析条件:展开剂为氯仿/甲醇/乙酸/水(81∶9∶8∶2,v∶v∶v∶v);显色剂为lg脲溶于4.5m L 85%磷酸和48m L水饱和的正丁醇混合溶液,结果得到果糖月桂酸单酯的Rf值为0.54。
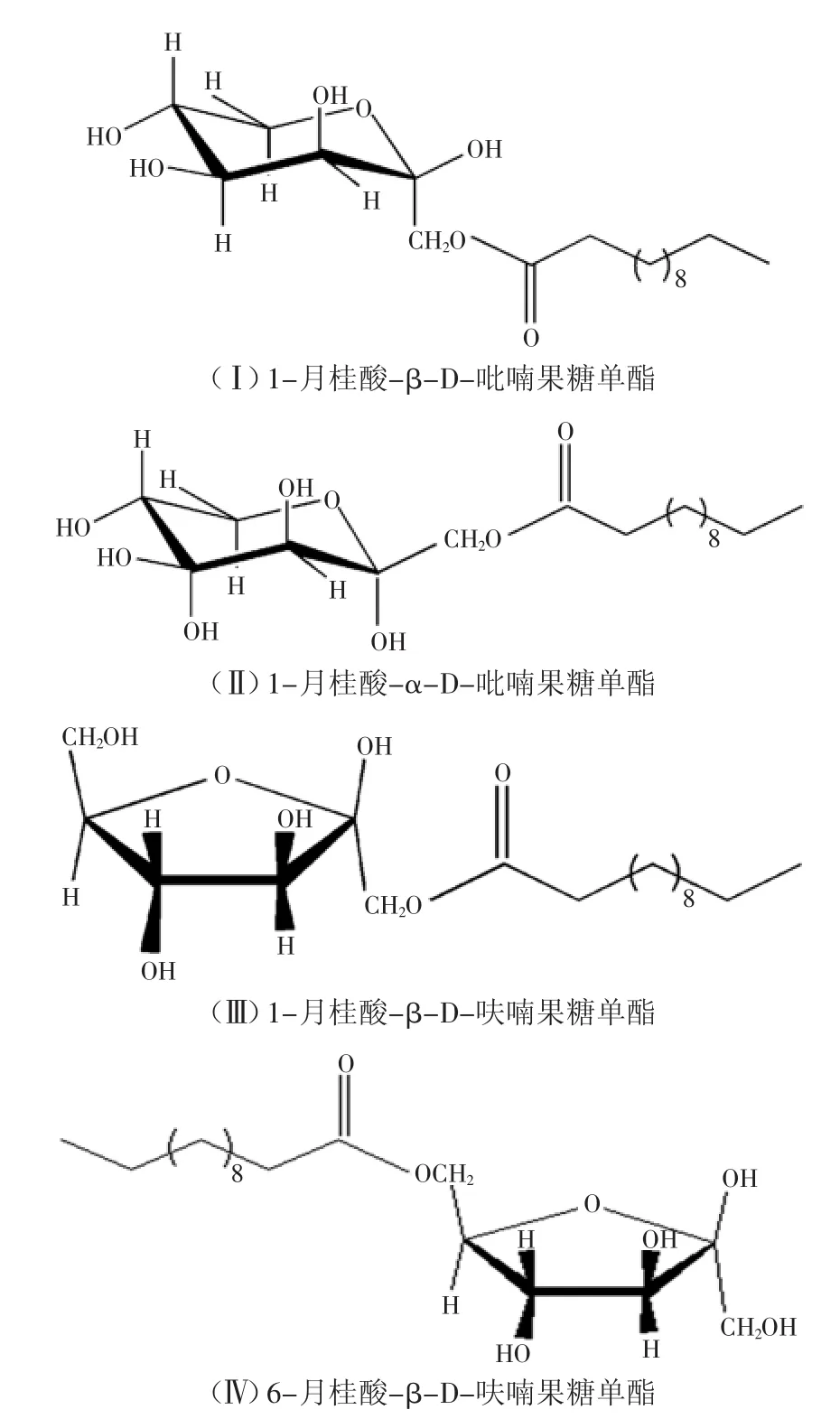
图5 固定化磷脂酶Lecitase®Ultra催化合成的果糖与月桂酸酯化产物Fig.5 Reaction products of the enzymaticmonoacylations of fructose catalyzed by immobilized Lecitase®Ultra
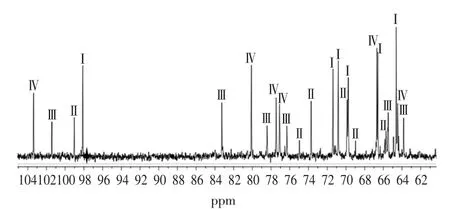
图6 果糖月桂酸单酯在果糖区域段13C-NMR图谱Fig.6 13C-NMR spectrum in the sugar region of monolauroyl fructose
3.2 采用硅胶柱层析对固定化磷脂酶Lecitase®Ultra催化合成的果糖月桂酸单酯进行分离纯化,最佳色谱条件:依次采用100%氯仿、氯仿∶甲醇=93∶7(v∶v)、氯仿∶甲醇=90∶10(v∶v)进行梯度洗脱,1.2m L/m in,上样量为25g/g硅胶。TLC监测并收集洗出液,通过RPHPLC-ELSD鉴定目标产物纯度大于99%。
3.3 对柱层析纯化样品进行系统的分析鉴定,分别采用HPLC-ESI-MS、FT-IR、13C NMR手段鉴定了目标产物为果糖月桂酸单酯,并确定四种单酯异构体:1-月桂酸-β-D-吡喃果糖单酯、1-月桂酸-α-D-吡喃果糖单酯、1-月桂酸-β-D-呋喃果糖单酯和6-月桂酸-β-D-呋喃果糖单酯,其中1-月桂酸-β-D-吡喃果糖单酯的比例最高。

表2 不同果糖月桂酸单酯同分异构体的13CNMR的化学位移数据(δ,ppm)Table 2 13C chemical shifts in CD3OD for the various fructose lauric isomers(δ,ppm)
[1]Maag H.Fatty acid derivatives:important surfactants for household,cosmetic and industrial purposes[J].Journal of the American Oil Chemists Society,1984,61(2):259-267.
[2]Weiss T,Brown Mona,Zeringue H,et al.Quantitative Estimation of Sucrose Esters of Palmitic Acid[J].Journal of the American Oil Chemists’Society,1967,48:145-148.
[3]Benoit Moreau,Georges Lognay,Christophe Blecker,et al. Chromatographic,Spectrometric and NMR Characterization of a New Set of Glucuronic Acid Esters Synthesized by Lipase[J]. Biotechnol Agron Soc Environ,2007,11(1):9-17.
[4]Scottera M J,Castlea L,Roberts D P T.Estimation of sucrose esters(E473)in foodsusinggaschromatography-massspectrometry [J].Food Additives and Contaminants,2006,23(6):539-546.
[5]Hajime S,TsuyoshiU,ToshiyukiN,et al.Enzymatic synthesis of carbohydrate esters of fatty acid(I)esterification of sucrose,glucose,fructose and sorbitol[J].Journal of the American Oil Chemists Society,1984,61(11):761-765.
[6]李脉,杨继国,杨博.磷脂酶A1酶活测定方法的研究[J].现代食品科技,2007,23(8):80-82.
[7]付敏,赵谋明,刘宁,等.吸附-涂层法固定化磷脂酶Lecitase®Ultra研究[J].食品工业科技,2011,32(10):277-280. [8]李延科.糖基表面活性剂蔗糖酯的研究[D].大连:大连理工大学,2004.
[9]Sang Hyun Lee,Hiep Minh Nguyen,Yoon-Mo Koo,et al. Ultrasound-enhanced lipase activity in the synthesis of sugar ester using ionic liquids[J].Process Biochemistry,2008,43(9):1009-1012.
[10]Ignacio,Perez-Victoria,Alberto Zafra,et al.Determination of regioisomeric distribution in carbohydrate fatty acidmonoesters by LC-ESI-MS[J].Carbohydrate Research,2007,342(2):236-242.
[11]Arcos JA,Bernabe M,Cristina O.Quantitative enzymatic production of1,6-diacyl fructofuranoses[J].Enzyme and Microbial Technology,1998,22(1):27-35.
[12]Gulten Sekeroglu,Ibel Fadiloglu,Esra Ibanoglu.Production and characterisation of enzymatically produced lauric acid esters of fructose[J].Journal of the Science of Food and Agriculture,2002,82(13):1516-1522.
[13]Moh M H,Tang T S,Tan G H.Improved separation of sucrose ester isomers using gradient high performance liquid chromatography with evaporative light scattering detection[J]. Food Chemmistry,2000,69(1):105-110.
[14]Moreau B,Lognay G C,Blecker C,et al.Synthesis of novel D-glucuronic acid fatty esters using Candida Antarctica lipase in tert-butanol[J].Biotechnol Lett,2004,26(5):419-424.
[15]ZHU Jinli,TANG Yanfeng,LI Jianhua,et al.Analysis of Sucrose Esters with Long Acyl Chain by Coupling of HPLCELSD with ESI-MS System[J].Chinese Journal of Chemical Engineering,2009,17(6):1032-1037.
[16]高鸿宾.有机化学[M].北京:高等教育出版社,2005.
[17]Schekermann C,Schlotterbeck A,SchmidtM,etal.Enzymatic monoacylation of fructose by two procedures[J].Enzyme and Microbial Technology,1995,17(2):157-162.
Purification and identification ofmonolauroyl fructose
FU M in,ZHAO Qiang-zhong,QIU Chao-ying,LIU Ning,ZHAO M ou-m ing*
(College of Light Industry and Food Science,South China University of Technology,Guangzhou 510640,China)
A novel enzymatic-catalyzing p rocess of monolauroyl fructose was developed.In the p rocess immobilized Lecitase®Ultra was used as biocatalyst in anhyd rous 2-methyl-2-butanol.Silica gel column chromatog raphy was used to separate and purify the fructose ester.The qualitative analysis condition of TLC was confirmed and the purity was identified by RP-HPLC-ELSD.Structure was verified by HPLC-ESI-MS,FTIR,13C NMR.As a result,a m ixture of the C-1 and C-6 monoacylated frutose esters,four isomers ofmonolauroyl fructose were obtained:l-lauroyl-β-D-fructopyranose,1-lauroyl-α-D-fructopyranose,1-lauroyl-β-D-fructofuranose,6-lauroyl-β-D-fructofuranose,and l-lauroyl-β-D-fructopyranose was the highest p roportion.
monolauroyl fructose;immobilized Lecitase®Ultra;TLC;silica gel column chromatography;structure
TS202.3
B
1002-0306(2012)22-0276-05
2012-05-17 *通讯联系人
付敏(1989-),女,硕士研究生,研究方向:食品生物技术。
粤港招标项目(2009A020700003);国家863计划项目(2010AA101505)。

