牛血清蛋白对纤维素酶水解小麦秸秆的影响
王新明,王联结,于 猛
(陕西科技大学生命科学与工程学院,陕西西安 710021)
牛血清蛋白对纤维素酶水解小麦秸秆的影响
王新明,王联结*,于 猛
(陕西科技大学生命科学与工程学院,陕西西安 710021)
在以分别被稀硫酸和氢氧化钠处理的小麦秸秆为底物进行纤维素酶解时添加牛血清蛋白(BSA)来评估BSA对酶解的影响,当接入纤维素酶40U/g秸秆,添加牛血清蛋白0.04g时,反应48h,还原糖得率分别提高30%和22%,添加牛血清蛋白后酸处理的秸秆水解速率更快,酶解液中酶失活趋势减小,以滤纸为底物测定纤维素酶活力时添加牛血清蛋白能将酶活提高1倍以上,从而推断牛血清蛋白可以提高纤维素酶的稳定性并减少酶因吸附木质素而失活,提高酶的水解效率。
牛血清蛋白,纤维素酶,木质纤维素,水解
木质纤维素是世界上最丰富的碳水化合物资源,由纤维素、半纤维素和木质素等组成,将其生物转化可得到葡萄糖、木糖等单糖并可进一步制取乙醇、木糖醇、沼气等食品和化工产品[1-3]。木质纤维素生物转化过程包括:利用有效的预处理方法破坏原料的物理结构并且除去原料中的木质素;酶解纤维素和半纤维素得到还原糖;发酵还原糖得到所需产品等[4],目前转化成本较高主要是由于预处理能耗大和酶解效率低[5]。在酶解过程中,纤维素酶的活性是影响水解反应的关键[6],酶解时添加表面活性剂或聚合物如吐温、PEG6000、鼠李糖等[7-9]能减少纤维素酶的无效吸附,减小纤维素酶变性失活速率,从而大大提高水解效率[10]。牛血清蛋白(BSA)常被作为稳定剂(Blocking reagent)应用于蛋白质印迹中提高限制酶的活性和稳定性[11],并被证实可以提高纤维素酶的酶解效率[12],本研究以小麦秸秆为原料,对其进行一定的预处理,考察经不同预处理后的小麦秸秆在牛血清蛋白存在时的纤维素酶解产糖效率及牛血清蛋白的作用机理。
1 材料与方法
1.1 材料与仪器
小麦秸秆 2010年6月采集于陕西省渭南市,清洗后于60℃烘干,粉碎过60目筛,低温密闭保存;纤维素酶 宁夏和氏璧生物技术有限公司(青霉菌液体发酵);牛血清蛋白 西安百灵克科技有限公司;3.5-二硝基水杨酸 化学纯,上海科丰化学试剂有限公司。
YX-280型电热蒸汽消毒器 江阴溶江医疗设备厂;FW 100型高速万能粉碎机 天津市泰斯特仪器有限公司;HZS-HA水浴振荡器 哈尔滨市东明医疗仪器厂;722E型可见分光光度计 上海光谱仪器有限公司。
1.2 实验方法
1.2.1 原料预处理 碱处理:取粉碎后的秸秆与质量分数为1%的NaOH以固液比(g/m L)1∶15混匀,100℃搅拌处理1h,趁热抽滤并洗涤至中性,将滤渣烘干、粉碎过60目筛备用[13]。酸处理:取粉碎后的秸秆与质量分数1%的硫酸以1∶15的固液比混匀。在蒸汽灭菌锅中120℃处理1h,趁热抽滤并洗涤至中性,将滤渣烘干、粉碎过60目筛备用[14]。
1.2.2 葡萄糖标准曲线的绘制 取干燥恒重的葡萄糖配制成质量浓度为1mg/m L的溶液,分别吸取0、0.2、0.4、0.6、0.8、1.0、1.2m L葡萄糖溶液于20m L具塞试管中,补加蒸馏水至 2m L,再加入 DNS溶液1.5m L,编号1~7。沸水浴10m in,立即冷却,加水定容、摇匀。以1号管作为空白在540nm处进行比色,以葡萄糖质量为横坐标,吸光值为纵坐标,绘制标准曲线。
1.2.3 纤维素酶解条件 取0.5g小麦秸秆粉置于50m L的三角瓶中,加入10m L浓度为0.075mol/L、pH为4.8的柠檬酸-柠檬酸钠缓冲液,再加入20U纤维素酶和一定量的牛血清蛋白,密封后放置于50℃、转速为70 r/m in的水浴振荡器中,定时取样测定酶解液中的还原糖量(以葡萄糖计)和纤维素酶的酶活。每次实验重复三次,取三次实验的平均值。
1.3 测定方法
原料组分测定:范氏洗涤法[15];还原糖测定: 3.5-二硝基水杨酸法(DNS法)[16];酶活测定:国际理论与应用化学协会(IUPAC)的滤纸酶活测定方法,定义50℃时1min水解产生1μmol葡萄糖的酶量为一个酶活单位(U)[17]。
2 结果与讨论
2.1 原料组分测定
用范氏洗涤法分别测定小麦秸秆、1%氢氧化钠处理的秸秆、1%硫酸处理的秸秆的成分,基本成分组成如表1所示。从表1中可以看出小麦秸秆中木质纤维总质量分数达到75%以上,其中以还原糖缩合而成的纤维素和半纤维素质量分数高达60%。秸秆经碱处理溶解了大部分的木质素,而酸处理后半纤维素大多被水解。
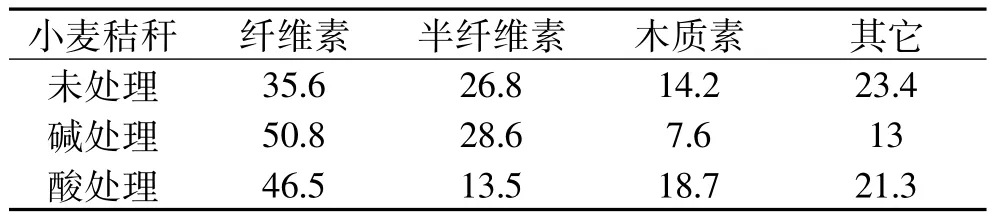
表1 小麦秸秆主要组分(%)Table 1 Themain component ofwheat straw(%)
2.2 葡萄糖标准曲线
葡萄糖标准曲线如图1所示,回归方程为y= 0.6439x-0.0094,R2=0.9995;当所测葡萄糖质量在0~1.2mg时线性关系良好。
2.3 牛血清蛋白对纤维素酶活的影响
测定纤维素酶活力时,向反应液中加入不同量的BSA,测得的酶活结果如图2所示,加入BSA后酶活明显提高,当加入10mg时酶活翻倍,当加入25mg时酶活是最初的2.5倍。纤维素酶是一种复合酶,它由外切葡聚糖酶、内切葡聚糖酶和β-糖苷酶三类酶组成,酶解过程包括吸附-解吸附和酶解两个过程,在三类酶的协同作用下可以将纤维素水解成葡萄糖[18]。牛血清蛋白具有强的疏水性,在溶液中形成的胶束能加速底物、酶和产物的运动,促进酶的解吸附,提高底物和酶的有效吸附,从而使酶活明显提高[11]。在图3中可以看到BSA提高纤维素酶活与缓冲溶液浓度有关,当在反应液中添加5mgBSA时,浓度为0.075mol/L的柠檬酸-柠檬酸钠缓冲液中酶活提高最明显。
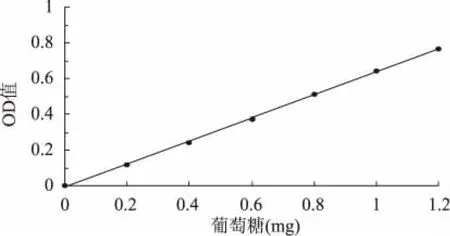
图1 葡萄糖标准曲线Fig.1 Standard curve of glucose
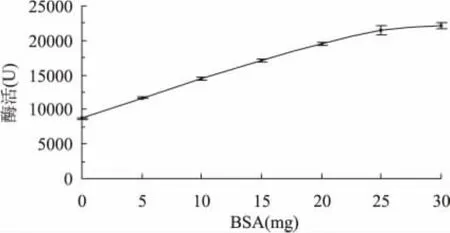
图2 BSA对纤维素酶活的影响Fig.2 Effect of BSA on cellulase activity
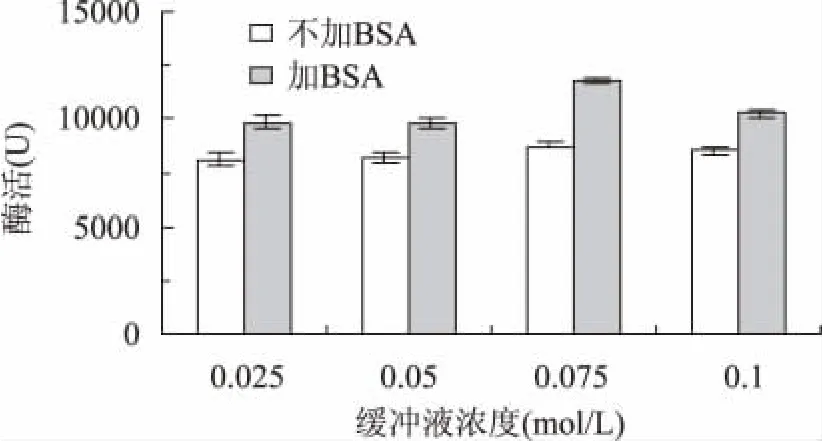
图3 不同缓冲溶液浓度下BSA对纤维素酶活的影响Fig.3 Effect of BSA on cellulase activity in different concentration of buffer
2.4 牛血清蛋白对纤维素酶水解小麦秸秆的影响
分别以酸处理和碱处理后的秸秆为底物,加入不同质量的牛血清蛋白进行纤维素酶解,测定48h后产生还原糖的量如图4所示。当加入0.04gBSA时经碱处理的秸秆还原糖产量由0.123g提高到0.15g,单糖得率提高22%,酸处理的秸秆还原糖产量由0.1g提高到0.13g,单糖得率提高30%,牛血清蛋白能够提高纤维素酶对小麦秸秆的水解率,对经酸处理的秸秆比碱处理的秸秆提高效果更好,当加入的BSA继续增加时还原糖产量提高不明显。
2.5 牛血清蛋白对纤维素酶失活的影响
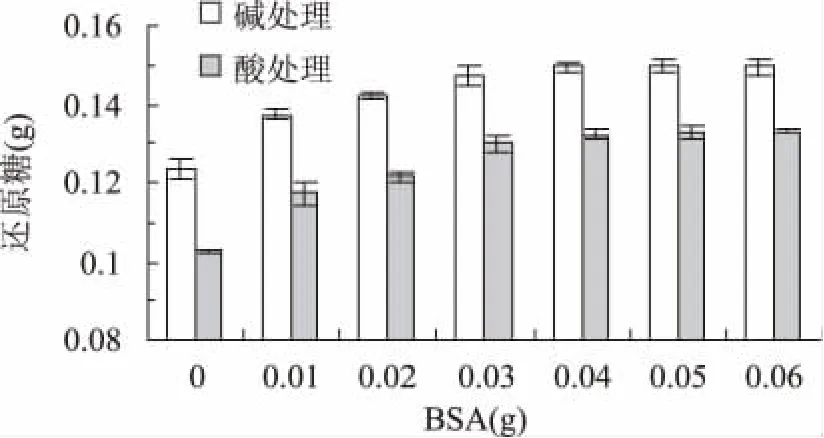
图4 BSA对纤维素酶水解小麦秸秆的影响Fig.4 Effect of BSA on enzymatic hydrolysis of wheat straw
2.5.1 BSA对酶解速率的影响 取1g底物与30m L缓冲溶液混合,接入40U纤维素酶,考察经过不同预处理方法处理的秸秆在添加0.04gBSA后的酶解速率并测定反应液酶活变化。图5中经碱处理和酸处理后的秸秆在添加BSA时酶解得糖速率提高。由2.3知,当有BSA存在时纤维素酶酶活显著提高,从而底物酶解率提高,但经碱处理的秸秆在每个酶解时间段内提高的糖量相当,而经酸处理的秸秆酶解提高的糖量集中在前60h,添加BSA后酸处理的秸秆酶解速率较碱处理的秸秆快,这说明BSA对纤维素酶解效率的提高除了因为能提高酶活外还与底物的性质有关。
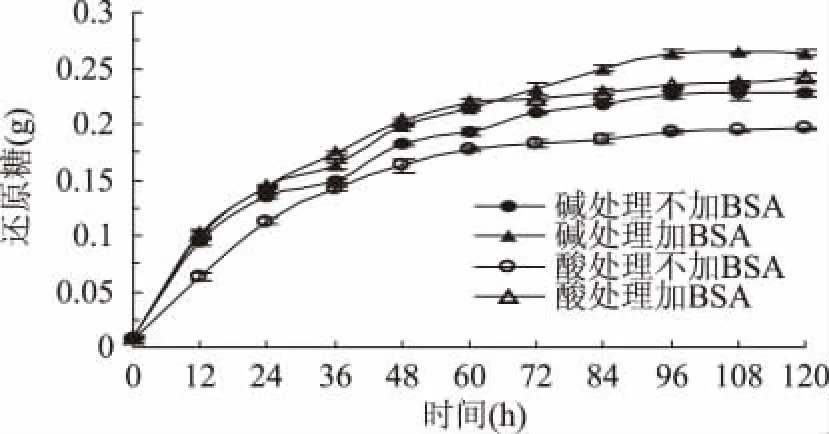
图5 BSA对经不同方法处理的秸秆酶解的影响Fig.5 Effect of BSA on the enzymatic hydrolysis of straw following pretreatment by differentways
2.5.2 BSA对酶解液中酶活的影响 图6中显示的是在不同反应时间测定的是否存在底物(酸处理的秸秆)和是否添加BSA的酶解液中纤维素酶的酶活。当没有底物时,添加BSA后酶活明显较大,而整体酶活都是随时间降低的,在反应液中纤维素酶失活主要因为气液界面失活、产物抑制、机械失活、与底物中木质素无效结合失活等[19-21],一般酶的失活量与底物中的木质素含量呈正比关系[22]。在图中不添加底物的反应液酶活降低趋势大致相同,这说明添加BSA后并没有减少纤维素酶气液界面失活和机械搅拌失活;而有底物存在时,添加了BSA的反应液比没添加BSA的反应液酶活降低趋势明显小,这说明BSA能减少酶与木质素无效结合失活。
由2.1知,经酸处理的原料比经碱处理的原料木质素含量多,酶解时酶与木质素的无效吸附失活更明显,添加BSA既能促进酶与纤维素的吸附和解吸,又能减少酶与木质素的吸附失活,酶解速度和效率比碱处理后的原料提高更明显。
3 结论
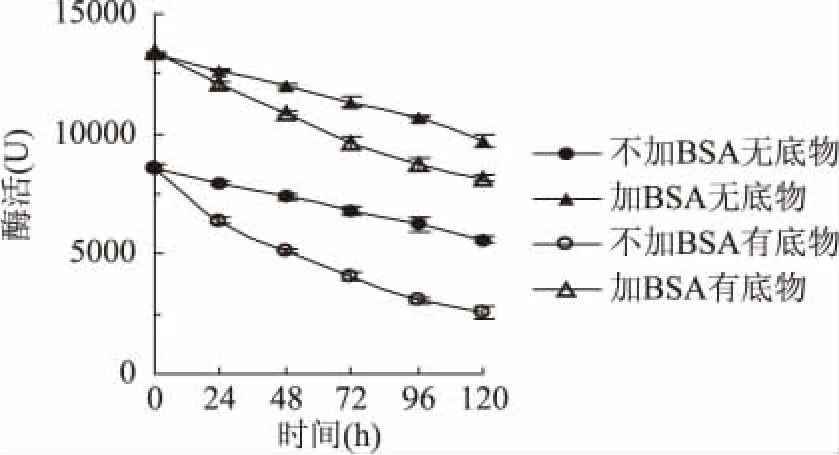
图6 BSA对纤维素酶失活的影响Fig.6 Effect of BSA on deactivation of cellulase
牛血清蛋白能激活和协调纤维素酶体系中的各组分,加速酶在底物上的吸附和解吸咐,使酶活显著提高。经稀硫酸预处理的小麦秸秆半纤维素大多被水解,经氢氧化钠预处理的秸秆木质素被溶解掉,他们进行纤维素酶解时加入牛血清蛋白还原糖得率提高,其中酸处理的秸秆酶解率提高集中在反应前期,反应速率较快,且最终还原糖得率提高更多。分析酶解液中的酶活发现,酸处理的秸秆在牛血清蛋白存在时酶活降低较缓慢,这是因为牛血清蛋白增强了酶的稳定性,减小了纤维素酶在木质素上的吸附失活。
[1]胡徐腾.纤维素乙醇研究开发进展[J].化工进展,2011,30 (1):137-143.
[2]王海洪,孙晓锋,张广成,等.玉米秸秆半纤维素制备木糖醇的研究[J].应用化工,2010,39(2):161-166.
[3]陈小华,朱洪光.农作物秸秆产沼气研究进展与展望[J].农业工程学报,2007,23(3):279-283.
[4]Mosier N,Wyman C,Dale B,et al.Features of promising technologies for pretreatment of lignocellulosic biomass[J]. Bioresour Technol,2005,96:673-686.
[5]Sun Ye.Hydrolysis of lignocellulosic materials for ethanol production:a review[J].Bioresour Technol,2002,83:1-11.
[6]方诩,秦玉琪,李雪芝.纤维素酶与木质纤维素生物降解转化的研究进展[J].生物工程学报,2010,2(7):864-869.
[7]刘伟,庞浩,计红果,等.Tween对玉米秸秆酶水解的影响[J].化工进展,2008,27(增刊):127-129.
[8]Kumar R,Wyman C.Effect of additives on the digestibility of corn stover solids following pretreatment by leading technologies[J].Biotechnol Bioeng,2009,102(6):1544-1557.
[9]Wang H Y,Fan B Q,Li C H.Effects of rhamnolipid on the cellulase and xylanase in hydrolysis of wheat straw[J].Bioresour Technol,2011,102:6515-6521.
[10]Eriksson T,Börjesson J,Tjerneld F.Mechanism of surfactant effect in enzymatic hydrolysis of lignocellulose[J].Enzyme Microb Technol,2002,31:343-364.
[11]Jeyachandran Y L,Mielczarski J A,Mielczarski E,et al. Efficiency of blocking of non-specific interaction of different proteins by BSA adsorbed on hydrophobic and hydrophilic surfaces[J].JColloid Interface Sci,2010,341:136-142.
[12]Brethauer S,Studer M H,Yang B,et al.The effect of bovine serum albumin on batch and continuous enzymatic cellulose hydrolysismixed by stirring or shaking[J].Bioresour Technol,2011,102:6295-6298.
[13]鲁杰,石淑兰,邢效功,等.NaOH预处理对植物纤维素酶解特性的影响[J].纤维素科学与技术,2004,12(1):1-6.
[14]江滔,路鹏,李国学.玉米秸秆稀酸水解糖化法影响因子的研究[J].农业工程学报,2008,24(7):175-179.
[15]Van Soest P J.Development of a comprehensive system of feed analyses and its application to forages[J].JAnim Sci,1967,26:119-128.
[16]Miller G L.Use of dinitrosalicylic acid reagent for determination of reducing sugar[J].Anal Chem,1959,3(3): 426-428.
[17]邹水洋,郭祀远.空白实验及测试条件对纤维素酶活测定的影响[J].食品工业科技,2010,31(6):344-346.
[18]陈洪章.纤维素生物技术[M].北京:北京化工出版社,2005:46-61.
[19]Ximenes E,Kim Y,Mosier N,etal.Inhibition of cellulases by phenols[J].Enzyme Microb Technol,2010,46:170-176.
[20]Seo D J,Fujita H,Sakoda A.Structural changes of lignocelluloses by a nonionic surfactant,Tween 20,and their effects on cellulase adsorption and saccharification[J].Biotechnol Bioeng,2011,102:9605-9612.
[21]Olsen S N,Bohlin C,Murphy L,et al.Effects of non-ionic surfactants on the interactions between cellulases and tannic acid: A model system for cellulose-poly-phenol interactions[J]. Enzyme Microb Technol,2011,49:353-359.
[22]Heiss-Blanquet S,Zheng D,Ferreira N L,et al.Effect of pretreatment and enzymatic hydrolysis of wheat straw on cell wall composition,hydrophobicity and cellulase adsorption[J].Bioresour Technol,2011,102:5938-5946.
Effect of bovine serum album in on cellulase in hydrolysis ofwheat straw
WANG Xin-m ing,WANG Lian-jie*,YU M eng
(College of Life Science and Engineering,Shaanxi University of Science&Technology,Xi’an 710021,China)
Bovine serum album in(BSA)and cellulase were added to wheat straw p retreated by d ilute sulfuric acid and sod ium hyd roxide to assess the effec t of BSA on the enzymatic hyd rolysis.0.04g BSA inc reased reducing sugar yields by 30%and 22%,respectively,ata cellulase loading of40U/g straw for48h.BSA imp roved the rate of enzymatic hyd rolysis and reduced enzyme deactivation of acid p retreated wheat straw.BSA increased cellulase activity by 1 time ormore w ith filter paper as substrate.The results showed that BSA could imp rove the stability of enzyme and reduced deactivation of enzyme due to bind ing w ith lignin.
bovine serum album in;cellulase;lignocellulose;hyd rolysis
Q556.2
A
1002-0306(2012)19-0194-04
2012-03-19 *通讯联系人
王新明(1988-),男,在读硕士研究生,研究方向:生物质开发与利用。

