邻苯二甲醛同步荧光衍生化法测定微量指血中还原型谷胱甘肽
张小勇, 黄成泽, 朱爱花, 崔胜云
(延边大学长白山生物资源与功能分子教育部重点实验室,吉林 延吉133002)
邻苯二甲醛同步荧光衍生化法测定微量指血中还原型谷胱甘肽
张小勇, 黄成泽, 朱爱花, 崔胜云*
(延边大学长白山生物资源与功能分子教育部重点实验室,吉林 延吉133002)
采用微升(μL)级微量指血为检测样品,在未对样品去蛋白的条件下,用邻苯二甲醛(OPA)荧光衍生化法测定了微量静脉血中还原型谷胱甘肽(GSH)的含量.利用标准曲线法和标准加入法进行3次测定的均值分别为4.415μmol/L和5.417 5μmol/L,加标回收率为95.28%~97.18%,检测限为3.6×10-8mol/L,可基本满足微量成分分析所要求的准确度.本研究为灵敏、简便和快速测定微量血样中GSH的含量提供了实验和方法学的依据.
谷胱甘肽;邻苯二甲醛;荧光光度法;衍生化
0 引言
研究发现,氧化应激和亚硝化应激与许多疾病的发生和发展具有密切的关联,氧化应激产生的活性氧和亚硝基化产物对生物大分子的破坏作用是疾病产生的直接原因之一.为了确定生物体内的氧化应激和亚硝化应激状态,通过检测生物标记物质来确定生物体内氧化应激和亚硝化应激的状态具有十分重要的意义.目前,广泛采纳的生物标记物质包括蛋白质的碳酰化产物、脂质过氧化物、亚硝基化的巯基产物、还原型谷胱甘肽等[1-3].还原型谷胱甘肽(GSH)在生物体内广泛分布,是由谷氨酸、半胱氨酸和甘氨酸组成的含硫醇三肽化合物,是指示生物体氧化应激和亚硝化应激的重要生物标记物质[4-6].因此,准确、简便、灵敏地测定生物体内的GSH,对防病、治病具有重要的意义.
血液中的GSH浓度分布是衡量人体氧化应激的重要指标.目前,测定血液中GSH含量的大多数方法通常样品用量较多,给应试者带来不适,同时分析时需要除蛋白等前处理过程,操作较为繁琐.本文采用微量指血为检测样品,在未对样品去蛋白的条件下,利用邻苯二甲醛(OPA)同步衍生化荧光分析法测定了微量静脉血样中GSH的含量,其结果令人满意.
1 实验部分
1.1 仪器和试剂
RF-5301PC荧光分光光度仪(岛津公司),UV-8500紫外分光光度仪(天美公司),UP-400S超声波细胞粉碎机,KQ-500DE数控超声波清洗机,p HS-3C型实验室酸度计;还原型谷胱甘肽(Sigma公司),邻苯二甲醛等其他试剂均为分析纯.
1.2 样品处理
利用微量注射器针刺取静脉指血5μL,然后分别移入含有一定浓度OPA衍生化试剂的PBs缓冲液(p H=8)的离心管A及含一定浓度GSH的标准液B中,进行同步超声破壁衍生化反应.根据A管中样品的荧光强度利用标准曲线法测定GSH的含量.根据B管中样品的荧光强度与加标GSH的浓度,利用标准加入法确定GSH的含量.所有测试过程均在荧光比色皿中完成,流程如图1所示.

图1 指血样品采集流程图
1.3 分析方法
GSH中半胱氨酸的硫醇基和谷氨酸上的氨基可与邻苯二甲醛(OPA)上的2个醛基缩合成可发强荧光的三环共轭结构的衍生化产物,见图2[7].由于衍生化反应速率较快,衍生化产物发射的荧光强度与GSH的浓度呈良好的线性关系,因此可采用校正法测定样品中的GSH含量.
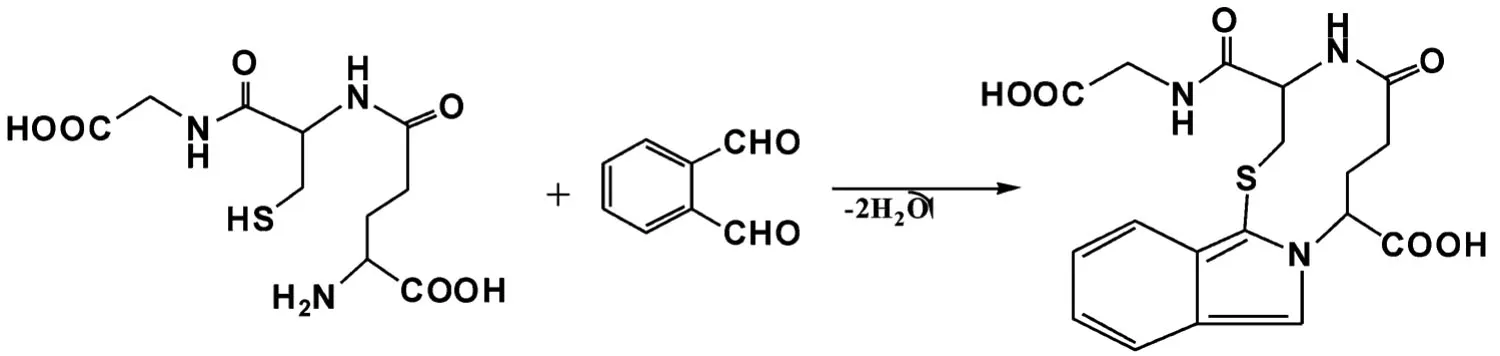
图2 OPA和GSH的衍生化反应
2 结果与讨论
2.1 荧光衍生化反应和测定条件
利用Uv-vis吸收光谱仪,在PBs缓冲溶液中分别测定一定浓度的OPA、GSH及两者混合溶液的吸收光谱(见图3A).如图3A所示,GSH标准溶液和OPA溶液在波长320 nm以上没有吸收值,但两者的混合液在波长340 nm和350 nm处有明显的吸收峰和吸收肩峰,说明两者作用生成共轭度较OPA高的衍生化产物.为了确定GSH和OPA衍生化产物的激发波长和荧光波长,采用上述GSH和OPA混合溶液,利用荧光光谱仪,在200~600 nm范围内,对样品进行激发和发射波长全扫描.结果发现:衍生化产物出现最大吸收肩峰波长处,即λex=350 nm作为激发波长时,在λem=429 nm处得到最灵敏、等强度的激发光谱和发射光谱曲线(见图3B),说明激发波长为350 nm时荧光量子产率最高.因此,本实验选取λex=350 nm为激发波长.
2.2 OPA和GSH选择性衍生化反应
为了探讨GSH和OPA选择性衍生化反应,分别选择血样中可能共存的小分子干扰组分,如半胱氨酸、抗坏血酸、尿酸与OPA的混合溶液等进行衍生化处理,然后利用Uv-vis吸收光谱仪和荧光光谱仪测定其光谱图,并与GSH和OPA混合溶液的光谱图进行比较,结果如图4所示.
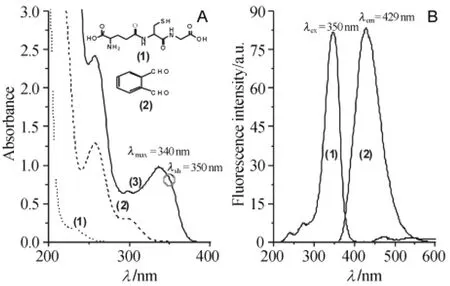
图3 A为GSH[(1),1×10-4 mol/L]、OPA[(2),1×10-3 mol/L]以及混合溶液(3)的Uvvis吸收光谱;B为GSH和OPA混合溶液的荧光光谱图
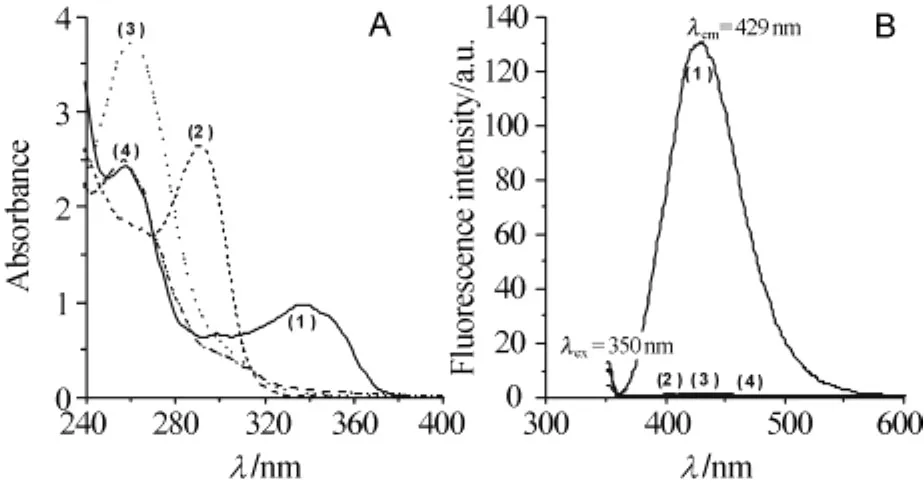
图4 A为OPA(1×10-3 mol/L)与GSH(1×10-4 mol/L)(1)、尿酸(1×10-4 mol/L)(2)、抗坏血酸(1×10-4 mol/L)(3)、半胱氨酸(1×10-4 mol/L)(4)混合溶液的Uv-vis吸收光谱;B为OPA与GSH(1)、尿酸(2)、抗坏血酸(3)、半胱氨酸(4)混合液的荧光光谱图
如图4所示,除GSH之外,尿酸、半胱氨酸、抗坏血酸在吸收波长大于320 nm时,无明显的吸收峰;当激发波长为350 nm时,除GSH外也均无明显的荧光发射.这说明只有GSH和OPA生成荧光衍生化产物,而尿酸、半胱氨酸、抗坏血酸不生成荧光衍生化产物.因此,本实验条件下OPA为GSH的选择性荧光衍生化试剂.
2.3 荧光分光光度法测定GSH
分别在PBs缓冲溶液(p H=8)和过量OPA溶液中配置不同浓度的GSH标准系列溶液,选定激发波长为350 nm记录荧光发射光谱,并用最大发射波长(429 nm)处的荧光发射强度对GSH的浓度做校正曲线,结果见图5.如图5所示,GSH浓度与荧光发射强度呈良好的线性关系,检测限达5×10-8mol/L.标准曲线的回归方程为If=-0.055 06+3.724 1 C,相关系数R=0.999 26.

图5 在1×10-3 mol/L OPA溶液中依次加入不同浓度的GSH时,荧光强度与GSH浓度之间的关系图
图6为采用指血样品,在过量OPA(1×10-3mol/L)溶液中对样品进行衍生化处理,然后依次加入不同浓度的GSH标准溶液后所测得的荧光光谱图和最大发射波长处的荧光发射强度与GSH标准溶液间的线性关系图.如图6A所示,血液样品空白(未加OPA的超声破壁的血样)和OPA溶液在该实验条件下没有明显的荧光发射峰,说明样品中基体成分基本不干扰本测定.但在血样中加入OPA衍生化试剂后,在λem=429 nm处出现灵敏的荧光发射峰,说明样品中含有GSH.当在样品中加入浓度渐增的GSH标准溶液后,λem=429 nm处的发射强度与加入的GSH浓度呈良好的线性关系,其线性回归方程为If=6.310 54+0.584 24 C,相关系数R=0.997 4.
分别利用标准曲线法和标准加入法测定样品中GSH的含量和回收率,并把测定结果与文献[8]的结果(血色素中GSH的含量)进行比较(见表1).表1结果表明,标准加入法所测得的结果高于标准曲线法,这主要是由基体干扰所致.本方法测定的结果虽低于文献[8]的值,但测定结果在同一个数量级上,具有一定的可比性.两种方法测定结果出现差别的原因可能是由于文献[8]测定的血样为动脉血,而本实验测定的血样为静脉血.

图6 在指血样品OPA提取中依次加入不同体积的加标液时,体系中GSH浓度与荧光强度之间的关系图(图A中(1)为OPA空白,(2)为血样空白溶液的荧光光谱图)

表1 标准曲线法与加入法测定指血中GSH含量的结果
3 结论
本文采用微升级的微量静脉指血为检测样品,不经过去蛋白前处理过程,用荧光衍生化法灵敏测定了微量血样中GSH的含量.本方法测定的结果与文献[8]中色谱法敞亮血样测定的结果基本吻合,方法的检测限为5×10-8mol/L.由于采样少,简化了前处理操作,因此本方法是一种简便、实用、经济、灵敏的分析方法,可为血样快速分析提供方法学依据.
[1] Kosower N S,Kosower E M.The glutathione status of cells[J].Int Rev Cytology,1978,54:109-156.
[2] 卢薇.谷胱甘肽的化学与医疗作用[J].化学教育,2004,1:7-10.
[3] Nazzareno B,Suzanne M K,Rosemarie M,et al.Plasma membrane glutathione transporters and their roles in cell physiology and pathophysiology[J].Molecular Aspects of Medicine,2009,30:13-28.
[4] Malin H,Bjorn H.Glutathione turnover in human cell lines in the presence of agents with glutathione influencing potential with and without acivicin inhibition of g-glutamyltranspeptidase[J].Biochimica et Biophysica Acta,2005,1726:42-47.
[5] Malin H,Bjorn H.The effect of different antioxidants on glutathione turnover in human cell lines and their interaction with hydrogen peroxide[J].Chemico-Biological Interactions,2006,163:192-198.
[6] 金春英,崔京兰,崔胜云.氧化型谷胱甘肽对还原性谷胱甘肽清除自由基的协同作用[J].分析化学,2009,37(9):1349-1353.
[7] 范崇东,王淼,卫功元,等.谷胱甘肽测定方法研究[J].生物技术,2004,14(1):68-70.
[8] Mattia L,Anna L R,Laura M G,et al.Determination of blood total,reduced and oxidized glutathione in pediatric subjects[J].Clinical Chemistry,2001,47(8):1467-1470.
Glutathione determination by finger blood sampling using o-phthaladehyde as fluorescent derivatizing agent
ZHANG Xiao-yong, HUANG Cheng-ze, ZHU Ai-hua, CUI Sheng-yun*
(Key Laboratory of Natural Resources of the Changbai Mountain &Functional Molecules(Yanbian University),Ministry of Education,Yanji 133002,China)
Reduced glutathione is sensitively determinined by fluorescent spectrometry using o-phthalaldehyde(OPA)as fluorescent derivatizing agent and different calibration methods by micro sampling of finger blood without protein elimination.The average amounts of GSH determined by calibration and standard addition methods are 4.415μmol/L and 5.417 5μmol/L respectively,recoveries are in the range of 95.28%-97.18%,detection limits is 3.6×10-8mol/L.The methods is suitable for simple,rapid and sensitive determination of GSH in micro blood sample.
glutathione;o-phthaladehyde;fluorescent spectrometry;derivatization
O652
A
1004-4353(2012)02-0146-04
2012-06-07 *通信作者:崔胜云(1957—),男,教授,研究方向为生物分析化学.
国家自然科学基金资助项目(21165021);吉林省教育厅项目(吉教科合字2010D273)

