溪黄草多酚的超声提取及其抗氧化性的研究
李 臻,吴 晖,赖富饶,李晓凤
(华南理工大学轻工与食品学院,广东广州 510640)
溪黄草多酚的超声提取及其抗氧化性的研究
李 臻,吴 晖,赖富饶*,李晓凤
(华南理工大学轻工与食品学院,广东广州 510640)
采用正交实验设计对溪黄草多酚的超声提取工艺条件进行优化。通过Folin-Ciocalteu法对提取液的总酚进行测定。考查了乙醇浓度、料液比、提取温度、超声功率、提取时间等五个因素对溪黄草多酚超声提取率。结果表明:溪黄草多酚超声提取的最佳工艺条件为:乙醇体积分数60%,料液比(g∶mL)1∶10,提取温度40℃,超声功率250W,提取时间25min,在最佳工艺条件下多酚提取率达6.81%±0.11%。DPPH抗氧化实验结果显示溪黄草多酚具有明显的DPPH自由基清除能力,其IC50值为38.47μg/mL。
溪黄草,多酚,超声提取,自由基清除能力
溪黄草(Rabdosiaserra(Maxim.)Hara),又名熊胆草、血风草等,多年生草木,为唇形科香茶菜属植物线纹香茶菜的全草,主产于长江以南的湖南、四川、云南、江西、广东、广西等省区。其性甘苦、凉,可清热,利胆,退黄,治急性黄疸型肝炎,急性胆囊炎[1]。溪黄草主要含萜类、黄酮类、酚类、氨基酸等多种化学成分。多酚具有较强的清除自由基、抗氧化活性、抗肿瘤、抗辐射以及保护心血管系统等重要的生物活性功能[2],鉴于多种慢性病及退行性疾病与体内的氧自由基过剩有关,因此从溪黄草中提取酚类化合物,并评价其抗氧化性强弱就显得非常有必要[3]。超声在20世纪50年代被应用于提高提取率[4],它也被广泛应用于食品工业中的乳化、结晶化和冷冻[5]。超声波在溶剂中的传播产生了一种空穴现象,空化气泡不断产生并被压缩,使得溶剂更易渗透入植物原材料并通过破碎细胞壁而释放细胞内产物,从而使得有机化合物的提取率提高[6]。超声波已被多个研究证明能够显著地减少提取时间、增加提取率从而促进许多植物原材料活性成分的提取[7-10]。
1 材料与方法
1.1 材料与设备
溪黄草 广州万怡药房五山店;DPPH(2,2-Diphenyl-l-picrylhydrazyl)、福林酚试剂(Folin-Ciocalteu) 美国Sigma公司;没食子酸、无水乙醇、甲醇、乙酸乙酯、无水碳酸钠 均为分析纯。
DFY-300型300克摇摆式高速中药粉碎机 温岭市林大机械有限公司;SHZ-D(Ⅲ)型循环水式真空泵 巩义市予华仪器有限公司;RE-52型旋转蒸发器 上海亚荣系列化仪器厂;TGL-16B型台式离心机 上海安亭科学仪器厂;LSHZ-300型低温水浴培养箱 常州诺基仪器有限公司;KQ-250DE型数控超声波清洗器 昆山市超声仪器有限公司; Spectrum lab 752S型紫外可见分光光度计 上海棱光技术有限公司。
1.2 实验方法
1.2.1 溪黄草多酚超声提取工艺[11]10g溪黄草→粉碎→乙醇溶液超声提取→滤纸过滤→0.45μm滤膜抽滤→旋转蒸发除乙醇→加水补充溶液至50mL→加入50mL乙酸乙酯→室温振荡过夜→弃去水层→旋转蒸发至干→50%甲醇溶解定容至50mL→稀释后测定
1.2.2 单因素和正交实验 通过研究乙醇体积分数、料液比、提取温度、超声功率、提取时间对溪黄草多酚提取率的影响等单因素实验后,设计4因素3水平正交实验[12],见表1,优化溪黄草多酚提取工艺条件。选取乙醇体积分数、超声温度、超声功率、提取时间四个因素,设计9组不同组合实验,从中筛选出最佳提取条件。

表1 正交实验因素及水平Tabel 1 Factors and levels in orthogonal array design
1.2.3 总酚提取率测定 根据 Folin-Ciocalteu法[13-14]对提取液的总酚含量进行测定。
标准曲线的绘制:称取0.01g没食子酸于10m L容量瓶,用50%甲醇定容至刻度。分别取60、120、180、240、300、360μL于6个10m L容量瓶,以50%甲醇定容到刻度,配制成浓度为 6、12、18、24、30、36μg/m L的标准液。分别取0.5m L不同浓度的标准液于试管中,加入0.2m L Folin-Ciocalteu试剂,混匀。室温放置10m in后加入2m L质量浓度为7%的碳酸钠溶液,混匀,室温放置15min。在波长750nm处测量其吸光度。根据测量结果绘制标准曲线,得到回归方程:Y=0.003X,R2=0.999。式中,Y为待测样液的吸光度;X为样液总酚含量(μg/m L)。
总酚含量测定:将提取液用50%甲醇稀释适当倍数,按上述方法测定各提取物中总酚含量,每组平行测量3次,根据标准曲线以及稀释倍数,计算多酚提取率,计算公式如下:

式中,Z为多酚提取率(%);n为稀释倍数;X为样液总酚含量(μg/m L);V为提取液体积(m L);m为溪黄草质量(g)。
1.2.4 DPPH自由基清除能力测定[15-16]将已知总酚含量的溪黄草提取液稀释至200μg/m L,再依次用50%甲醇溶液梯度稀释,配成总酚浓度分别为100、50、25、12.5、6.25μg/m L的溶液,按照下述步骤,对6组不同总酚浓度提取液分别进行DPPH自由基清除实验。
以50%甲醇为空白对照组,分别吸取1m L 50%甲醇和1m L提取液于不同试管中,各加入1m L 50μg/m L的DPPH甲醇溶液,混匀,避光放置20m in。以蒸馏水调零,于517nm测量吸光度。DPPH自由基清除率按如下公式计算:

式中,X为空白对照组的吸光度;Y为样品溶液的吸光度。
2 结果与分析
2.1 提取条件的单因素实验
2.1.1 乙醇体积分数对多酚提取效果的影响 固定料液比1∶10,提取温度40℃,超声功率250W,提取时间15m in,分别选取乙醇体积分数50%、60%、70%、80%、90%进行超声提取实验,结果见图1。由图1可知,乙醇浓度不同,提取液极性不同,从而浸提酚类物质的能力也不相同[17]。当乙醇体积分数为60%时,多酚提取率达最大值;当乙醇浓度继续增加时,溶液极性增强,导致多酚类物质的溶解度下降,多酚提取率呈减小趋势。因此,乙醇体积分数60%最为适宜。

图1 不同乙醇体积分数对溪黄草多酚提取效果的影响Fig.1 Effect of ethanol concentrations on extraction efficiency of polyphenols from Rabdosiaserra(Maxim.)Hara
2.1.2 料液比对多酚提取效果的影响 固定乙醇体积分数60%,提取温度40℃,超声功率250W,提取时间15min,分别选取料液比1∶5、1∶10、1∶15、1∶20、1∶25进行超声提取实验,结果见图2。由图2可知,浸提液用量增加,传质推动力增加,有利于提取。但当料液比超过1∶10后,多酚提取率增加不明显,且用量过大会增加后续工艺的难度,能耗较高,也会加大多酚的损失[18]。因此从经济角度考虑,1∶10为最适料液比,后续实验均采用该比例。
2.1.3 提取温度对多酚提取效果的影响 固定乙醇体积分数60%,料液比1∶10,超声功率250W,提取时间15min,分别选取超声温度20、30、40、50、60℃进行超声提取实验,结果见图3。由图3可知,在20~40℃范围内,温度的升高增加了溶剂分子和溶质分子的运动,促进了扩散作用,故多酚提取率增大;而当温度继续升高时多酚,提取率则呈下降趋势,这主要是由于多酚是热敏性物质,易受热而发生氧化,导致提取率下降。当提取温度为40℃时,多酚提取率达最大值。因此,40℃为最佳提取温度。
2.1.4 超声功率对多酚提取效果的影响 固定乙醇体积分数60%,料液比1∶10,提取温度40℃,提取时间15m in,分别选取超声功率 150、175、200、225、250W进行超声提取实验,结果见图4。由图4可知,随着功率的增大,超声波对细胞壁的破碎作用增强,胞内多酚溶出速率增加,故其提取率逐渐增大[17],当超声功率为225W时,多酚提取率达最大值;当功率继续增大到一定程度时,会造成局部温度过高,多酚类物质易在高温条件下发生降解和氧化[19],使多酚提取率反而降低。故225W为最适超声功率。
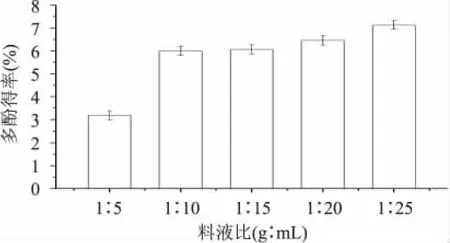
图2 不同料液比对溪黄草多酚提取效果的影响Fig.2 Effect of solid-liquid ratios on extraction efficiency of polyphenols from Rabdosiaserra(Maxim.)Hara

图3 不同提取温度对溪黄草多酚提取效果的影响Fig.3 Effect of extraction temperatures on extraction efficiency of polyphenols from Rabdosiaserra(Maxim.)Hara

图4 不同超声功率对溪黄草多酚提取效果的影响Fig.4 Effect of ultrasonic power on extraction efficiency of polyphenols from Rabdosiaserra(Maxim.)Hara
2.1.5 提取时间对多酚提取效果的影响 固定乙醇体积分数60%,料液比1∶10,提取温度40℃,超声功率225W,分别选取提取时间5、10、15、20、25m in进行超声提取实验,结果见图5。由图5可知,当超声时间为20m in时,多酚提取率达最大值;随着时间增大,多酚提取率有逐渐减小趋势,这可能是因为超声波具有较强的剪切作用,长时间的作用使得多酚的分子结构被破坏,从而提取率降低[17]。故最佳超声时间为20m in。
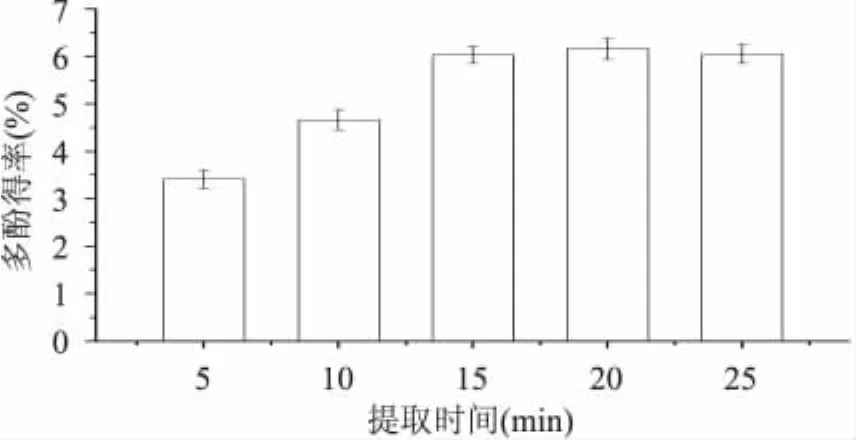
图5 不同提取时间对溪黄草多酚提取效果的影响Fig.5 Effect of extraction time on extraction efficiency of polyphenols from Rabdosiaserra(Maxim.)Hara
2.2 正交法优化提取条件的实验
按照表1中数据进行L9(34)正交实验,所得结果见表2、表3。
分析正交实验结果可知,最佳条件为A2B2C3D3,即乙醇体积分数60%,料液比1∶10,提取温度40℃,超声功率250W,提取时间25m in时,溪黄草超声提取的多酚得率最高。其中,乙醇体积分数和提取温度对提取得率影响最为显著,超声功率和提取时间差异不显著。
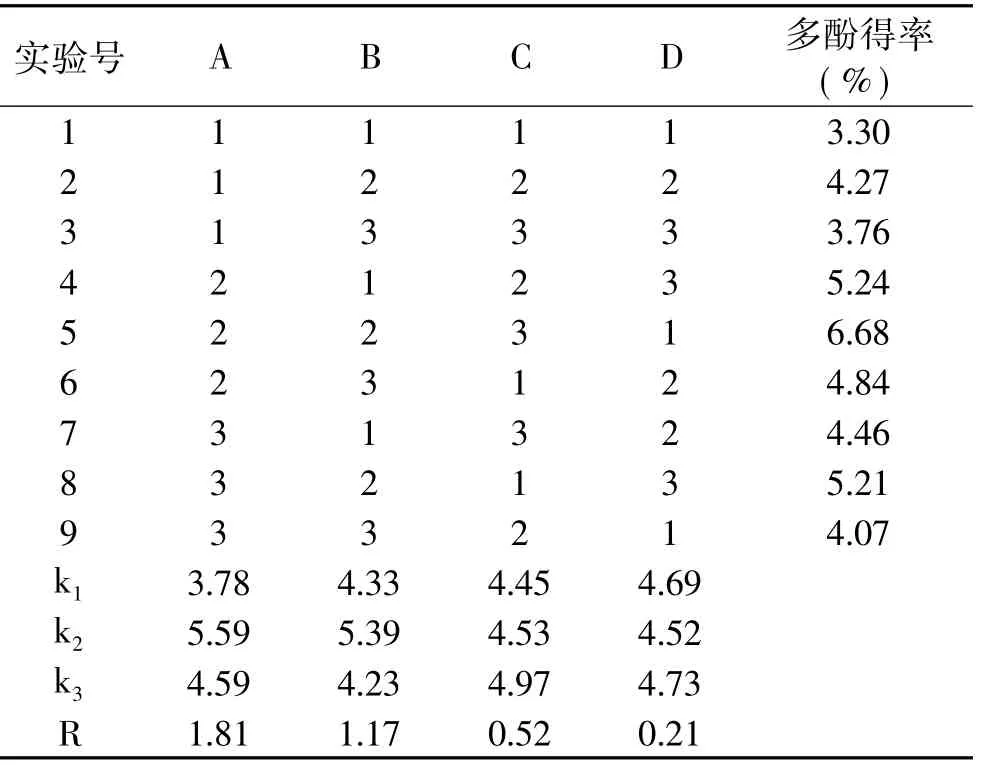
表2 L9(34)正交实验设计及结果Table 2 Orthogonal array designmatrix and experimental results

表3 方差分析表Table 3 Analysis of variance of orthogonal array design experimental results
在正交实验表中并没有用到A2B2C3D3组合,因此需要在此条件下进行验证。在最佳提取条件下,反复提取3次以验证提取效果,测得多酚得率为6.81%±0.11%。
2.3 DPPH自由基清除能力测定
DPPH(2,2-Diphenyl-l-picrylhydrazyl)自由基是一种稳定的有机自由基,通过检测样液对DPPH自由基的清除能力可以表示其抗氧化性的强弱[20]。由图6可知,溪黄草多酚能够清除DPPH自由基,具有很好的抗氧化性能。随着总酚浓度的增大,自由基清除率相应增大,当总酚浓度大于100μg/m L时,DPPH自由基趋近于完全被清除,且在一定浓度范围内,总酚浓度与DPPH自由基清除能力呈一定的效量关系,其线性关系为Y=1.395X-3.670,R2=0.999,其中,Y为DPPH自由基清除率(%),X为样液总酚含量(μg/m L)。根据线性关系,可知溪黄草多酚提取液的IC50=38.47μg/m L。

图6 溪黄草多酚对DPPH自由基的清除能力Fig.6 DPPH radical scavenging capability of polyphenol extracted from the Rabdosiaserra(Maxim.)Hara
3 结论
3.1 溪黄草多酚的超声提取受众多因素影响,根据对实验结果的分析表明,提取的最佳工艺条件为:乙醇体积分数60%,料液比1∶10(g∶m L),提取温度40℃,超声功率250W,提取时间25m in。该条件下,多酚提取率可达6.81%±0.11%。超声波法的多酚提取率较高,可节省大量的时间和资源,是一种快捷、简便、有效的提取方法,为进一步利用溪黄草多酚提供了有益的参考。
3.2 自由基是机体正常代谢过程中的产物,具有强氧化性,机体内自由基过剩时可引起脂质过氧化及生物膜损坏等,导致肿瘤及心脑血管等疾病[21]。实验表明,溪黄草多酚具有抗氧化作用,能够有效地清除DPPH自由基,其IC50值为38.47μg/m L。因此,溪黄草多酚有着很大的开发潜力,在食品、制药工业以及保健品行业都具有良好的应用前景。
[1]广州部队后勤部卫生部.常用中草药手册[M].人民卫生出版社,1970.
[2]王晓阳,唐琳,赵垒.响应面法优化刺槐花多酚的超声提取工艺[J].食品科学,2011,32(2):66-70.
[3]温玲蓉,林恋竹,赵谋明.溪黄草常压回流提取物与减压回流提取物抗氧化性的比较[J].现代食品科技,2010,26(1): 71-75.
[4]VINATORU M.An overview of the ultrasonically assisted extraction of bioactive principles from herbs[J].Ultrasonic Sonochemistry,2001,8(3):303-313.
[5]MASON T J,PANIWNYK L,LORIMER J P.The uses of ultrasound in food technology[J].Ultrasonics Sonochemistry,1996,3(3):2253-2260.
[6]ROMDHANE M,GOURDON C.Investigation in solid-liquid extraction:influence of untrasound[J].Chemical Engineering Journal,2002,87(1):11-19.
[7]ALBU S,JOYCE E,PANIWNYK L,et al.Potential for the use of ultrasound in the extraction of antioxidants from Rosmarinus officinalis for the food and pharmaceutical industry[J]. Ultrasonics Sonochemistry,2004,11(3-4):261-265.
[8]ROSTAGNO M A,PALMA M,BARROSO C G.Ultrasoundassisted extraction of soy isoflavones[J].Journal of Chromatography A,2003,1012(2):119-128.
[9]VALACHOVIC P,PECHOVA A,MASON T J.Towards the industrial production of medicinal tincture by
ultrasound assisted extraction[J].Ultrasonics Sonochemistry,2001,8(2):111-117.
[10]WU J,LIN L,CHAU,F T.Ultrasound-assisted extraction of ginseng saponins from ginseng roots and cultured ginseng cells[J].Ultrasonics Sonochemistry,2001,8(4):347-352.
[11]Haiyan Wang,Mouming Zhao,Bao Yang,et al.Identification of polyphenols in tobacco leaf and their antioxidant and antimicrobial activities[J].Food Chemistry,2008,107(4):1399-1406.
[12]张娜,陈锦屏,严静,等.和田玉枣总皂甙超声提取工艺[J].食品科学,2011,32(2):108-110.
[13]EMMONS C L,PETERSON D M.Antioxidant activity and phenolic content of oat as affected by cultivar and location[J]. Crop Science,2001,41(6):1676-1681.
[14]Varsha Viswanath,Asna Urooj,N G Malleshi.Evaluation of antioxidant and antimicrobial properties of finger millet polyphenols(Eleusine coracana)[J].Food Chemistry,2009,114 (1):340-346.
[15]KUSKOSKI E M,ASUERO A G,MORALES M T,et al. Frutos tropicais silvestres epolpas de frutas congeladas:atividade antioxidante,polifenáis e antocianinas[J].Ciência Rural,2006,36(4):1283-1287.
[16]A L K Faller,E Fialho.Polyphenol content and antioxidant capacity in organic and conventional plant foods[J].Journal of Food Composition and Analysis,2010,23(6):561-568.
[17]胡明明,张国文,何力.响应面法优化超声提取花生壳多酚[J].南昌大学学报,2011,35(3):241-246.
[18]刘小丽,张伟,符毅文.虎杖中白藜芦醇的超声提取及其抗氧化性研究[J].中成药,2011,33(1):150-153.
[19]楠极,李远志,李婷,等.微波辅助提取番石榴叶中多酚物质的工艺研究[J].食品工业科技,2010,31(5):229-231.
[20]彭长连,陈少薇,林植芳,等.用清除有机自由基DPPH法评价植物抗氧化能力[J].生物化学与生物物理进展,2000,27 (6):658-661.
[21]李淑娟.茶多酚的保健和药理作用[J].甘肃农业,2009 (12):47-48.
Study on ultrasonic extraction and antioxidant activity of polyphenol fromRabdosiaserra(Maxim.)Hara
LIZhen,WU Hui,LAI Fu-rao*,LIXiao-feng
(College of Light Industry and Food Science,South China University of Technology,Guangzhou 510640,China)
An orthogonal array design was used to op tim ize the ultrasonic extrac tion conditions ofRabdosiaserra(Maxim.)Hara.The total polyphenol content was determ ined by the Folin-Ciocalteu assay,and the influence of ethanol concentration,solid-liquid ratio,temperature,ultrasonic power and time on the extraction efficiency were studied.Results showed that the op timum extraction conditions were as follows:25m in ultrasonic treatment at 250W power for extracting the raw materialwith a 10-fold volume of 60%aqueous ethanol solution at 40℃.The yield of polyphenolwas 6.81%±0.11%under the op timum cond ition.The DPPH rad ical scavenging capability assay showed that theRabdosiaserra(Maxim.)Hara had strong radical scavenging capability,and its IC50value was 38.47μg/m L.
Rabdosiaserra(Maxim.)Hara;polyphenol;ultrasonic extraction;radical scavenging capability
TS201.1
B
1002-0306(2012)12-0258-04
2011-10-25 *通讯联系人
李臻(1989-),女,在读硕士,研究方向:食品安全与天然产物化学。
中央高校基本科研业务费资助项目(2011ZB0012);国家自然科学基金资助项目(20906031);教育部新世纪优秀人才支持计划资助项目(NECT-06-0746)。

