不同花色铁棒锤基因组DNA提取及遗传差异分析
朱田田 ,杜 弢 ,陈红刚 ,晋 玲 ,林 丽 ,侯 嘉
(1.甘肃中医学院药学系,甘肃兰州730000;2.甘肃省高校中(藏)药化学质量研究省级重点实验室,甘肃兰州730000)
铁棒锤为毛茛科乌头属植物铁棒锤(Aconitum pendulum Busch)的干燥块根[1]。其性热,味辛苦,有大毒,具有祛风除湿、消肿止痛、活血祛瘀之功效[2]。其长期以来一直以野生资源入药,随着市场需求的增加,人工驯化栽培已显得日益迫切。经调查,目前甘肃省仅永登县有少量的人工种植,其种子来源于野生,在栽培群体中有黄花和紫花2种类型,从表型上看,二者有区别,但仅从形态学方面不能说明二者的真正差异性[3]。因此,对其进行遗传差异分析十分必要,可为进一步选育产量高、品质好的新品种提供遗传基础。
RAPD(Random Amplified Polymorphic DNA,随机扩增多态性DNA)技术自1990年由Williams等发展起来后,因其快速、灵敏、程序简便等优点,短时间内被广泛应用于基因定位、连锁图的建立、品系(种)鉴别等方面[4-7]。其基本原理是采用随机序列较短的单个引物,以提取的基因组DNA为模板进行PCR扩增反应,扩增产物可在琼脂糖凝胶电泳中分离成不同大小的DNA片段,遗传差异越大的品种其扩增产物的区别越明显。本研究拟利用RAPD技术对2种不同花色铁棒锤进行遗传分析,从分子水平阐明二者的差异。
1 材料和方法
1.1 材料
1.1.1 植物材料 2008年8月,在甘肃省永登县采集不同花色铁棒锤的新鲜叶片,置于冰盒中带回实验室,储存于低温冰箱(-40℃)中;9月采集种子,自然干燥后放入纸袋保存于实验室阴凉干燥处。植物样品均由甘肃中医学院生药实验室林丽高级实验师鉴定。
1.1.2 仪器设备 数显恒温水浴锅(HH-S24),台式高速冷冻离心机(TGL16M),电泳仪(DYY-7),PCR 扩增仪(PE-2400),涡旋混合仪(WH-3),紫外分光光度计(UV-759),凝胶成像系统(Bio-Rad),等。
1.1.3 主要试剂 CTAB,EDTA,Tris,PVP,β- 巯基乙醇,均购于北京鼎国生物技术有限责任公司;RNA 酶,琼脂糖(Agarose),EB,PCR 相关试剂,均为上海生工生物工程有限公司产品;随机引物,购于北京博迈德科技发展有限公司;其余试剂均为国产分析纯。
1.2 方法
1.2.1 基因组DNA的提取及浓度检测 基因组DNA提取采用CTAB法[8-12],具体步骤为:称取黄花和紫花铁棒锤新鲜叶片各150 mg和干燥种子各30 mg置于洁净干燥研钵中,加入适量PVP,与液氮共研成细粉后迅速转入2 mL离心管中;加入800 μL经65℃预热的CTAB提取缓冲液(2%CTAB,20 mmol/L EDTA(pH 值为 8.0),100 mmol/L Tris-HCl(pH 值为 8.0),1.4 mol/L NaCl,2%β-巯基乙醇),充分混匀,65℃水浴40 min,期间每隔10 min颠倒混匀1次;冷却至室温后加入等体积的氯仿/异戊醇(24∶1),轻轻颠倒混匀后静置5 min,12 000 r/min离心10 min;仔细吸取上层水相至新离心管中,重复此步骤2~3次,直到分界层无白色沉淀为止。取上清液于新的离心管中,加入0.7倍体积的异丙醇,10 000 r/min离心2 min;将离心管中上清液倒掉后倒置于纸巾上10 min,充分吸出水分后,加300 μL去离子水,涡旋混匀,使沉淀物溶于其中,65℃水浴5 min,充分溶解DNA后加入4 μLRNA酶(10 mg/mL),37 ℃水浴 10 min,除去RNA;再加入2/3体积的异丙醇,1/10体积的5 mol/L乙酸钠轻轻混匀,于-20℃放置30 min沉淀DNA;12 000 r/min离心10 min,小心倒掉上清液,保留DNA沉淀于管底,加70%乙醇700 μL洗涤沉淀2~3次;室温干燥后加入130 μL TE缓冲液溶解DNA沉淀,并保存于4℃冰箱中备用(-20℃长期保存)。
基因组DNA电泳检测:取5 μLDNA样品与1 μL TE缓冲液混匀后点样于0.8%琼脂糖凝胶孔,电泳缓冲液为1×TBE溶液,175 V电压下电泳25 min左右,EB(溴化乙锭)染色,用凝胶成像系统照相,保存。
DNA浓度和纯度检测:用无菌去离子水(57 μL)将基因组 DNA母液(3 μL)稀释 20倍后,使用紫外分光光度计测定在260,280 nm处的紫外吸收值。根据A260/A280的值判断总DNA纯度,并计算其浓度。

1.2.2 RAPD-PCR扩增及电泳检测 采用20条随机引物对提取的基因组DNA进行PCR扩增,反应体系为25 μL,含20 mmol/L Mg2+的Buffer 2.5 μL,10 mmol/L dNTP 0.62 μL,10 μmol/L 引物 1.25 μL,2 U/μL Taq 酶 0.3 μL,DNA 模板60 ng。扩增程序:94℃预变性4 min;94℃变性50 s,37 ℃退火 30 s,72 ℃延伸 60 s,40 个循环;72℃延伸10 min,4℃保存。扩增产物在1.2%琼脂糖凝胶上电泳,在凝胶成像系统下观察、拍照。
2 结果与分析
2.1 基因组DNA电泳检测结果
铁棒锤2种不同组织提取的基因组DNA 琼脂糖凝胶电泳检测结果如图1所示。
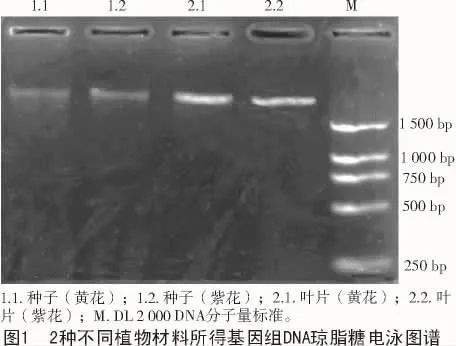
图1表明,从亮度看,采用CTAB法从铁棒锤的新鲜叶片和干燥种子中均可提取出基因组DNA,但从种子中得到的电泳谱带明亮程度较新鲜叶片暗很多,说明从种子中提取的总DNA量低,而叶片提取的量高;从2种材料中提取的基因组DNA的电泳条带均比较整齐无拖尾,点样孔附近无杂质污染,说明CTAB法提取的DNA纯度高、质量好,比较适用铁棒锤基因组DNA的提取。
2.2 基因组DNA紫外分光光度计检测结果
对2种不同铁棒锤组织中提取的基因组DNA进行紫外检测分析(表1)表明,2种材料中提取的基因组DNA的A260/A280值均未达到1.8,说明所得到的DNA在不同程度上都含有一些杂质,如蛋白质、多酚及其他小分子物质等,但从总体看,其A260/A280值均在1.69以上,这已能满足对DNA模板质量要求相对比较低的RAPD-PCR扩增;2种材料提取的基因组DNA质量浓度为56~109μg/mL,按每次PCR的DNA用量为50ng计算,从数量上可以满足大量PCR扩增的需要。
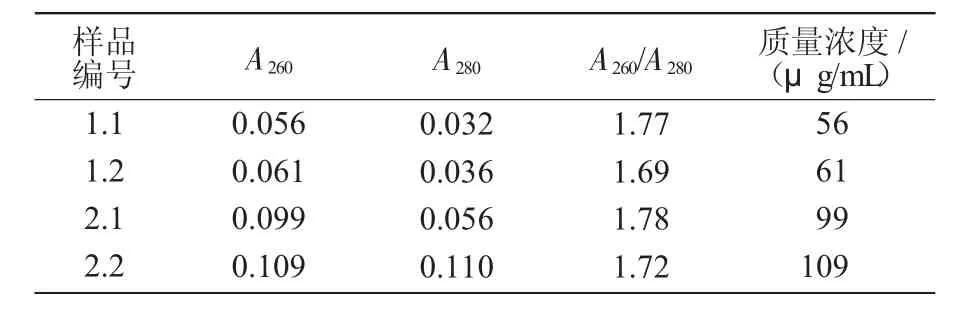
表1 不同植物材料基因组DNA的纯度和质量浓度
2.3 RAPD-PCR扩增产物检测结果
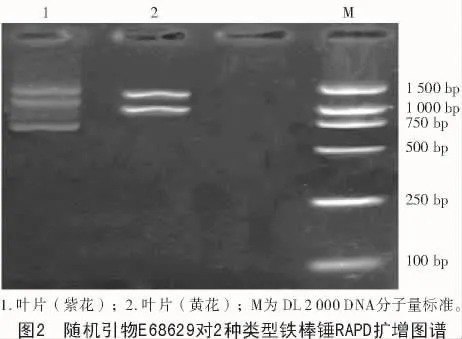
20条随机引物中共有3条能扩增出条带,即 E68629,E68631,E68636,其中,引物 E68629的扩增产物清晰稳定,可用于铁棒锤遗传差异分析。从图2可以看出,2种花色的铁棒锤RAPD扩增产物具有一定的差异性,二者在1 500 bp处有共同条带出现,紫花铁棒锤在1 250,750 bp处有2条特异带,而黄花铁棒锤在1 000 bp处有1条特异带出现。说明二者存在遗传学差异。
3 讨论
CTAB法是植物基因组DNA提取的有效方法之一,对于药用植物铁棒锤也不例外。目前,从新鲜叶片中提取基因组DNA是大多数研究者的首选,但前提条件是样本必须足够新鲜,否则得到的DNA会产生不同程度的降解,而如何保持叶片新鲜成为样品采集过程中的难题。因此,在采样地点较远、叶片不易保存的情况下,改变样品采集部位可解决此问题。除叶片外,植物体其他组织都能提取出DNA,如种子、花粉等,尤其种子中常贮藏较多的蛋白和淀粉,一般不影响基因组DNA的提取效果[13],这与本研究结果一致。
2种不同花色的铁棒锤除了在形态学上有差异外,经过RAPD分析得知,其扩增产物经琼脂糖凝胶电泳分离的DNA片段有区别,除了有1条共同带外,紫花和黄花铁棒锤还分别出现了2条和1条特异带,说明二者的基因型不同,其在遗传学上也具有一定的差异性。但由于供试材料单一,能够扩增出条带的随机引物数量较少,不能满足遗传多态性和遗传距离的分析,这也是今后研究中需要解决的问题。
[1]中华本草编委会.中华本草藏药卷[M].上海:上海科学技术出版社,2002:274.
[2]全国中草药汇编编写组.全国中草药汇编:上册[M].北京:人民卫生出版社,1975:703-704.
[3]郭宝生,刘素恩,王凯辉,等.表观遗传研究在棉花育种中的应用[J].河北农业科学,2010,14(4):75-77.
[4]王海岗,吕建珍,彭锁堂.作物种质资源遗传多样性的评价方法[J].山西农业科学,2007,35(11):26-27.
[5]莫可元.RAPD技术在中药鉴定及相关领域应用的研究进展[J].中国药师,2007,10(9):908-910.
[6]塔娜,逯晓萍,张雅慧,等.皮、裸燕麦种质资源的性状表现和遗传差异分析[J].内蒙古农业科技,2010(2):33-35.
[7]王铁固,杨天佑,赵新亮,等.离子束介导遗传转化小麦突变体的遗传分析[J].河南农业科学,2010(5):11-15.
[8]顾红雅,瞿礼佳.植物基因与分子操作[M].北京:北京大学出版社,2005.
[9]Zhou Y Q.Application of DNA molecular markers technique to plant research[M].Beijing:Chemical IndustryPress,2005.
[10]叶丽娟,禄久幸.蜡梅花瓣基因组DNA提取及RAPD-PCR反应体系优化[J].山西农业科学,2011,39(4):299-303.
[11]刘志刚,范丙友,史国安.上海牡丹根际土壤DNA提取方法研究[J].天津农业科学,2011,17(1):84-87.
[12]韩玉杰,贾炜珑,王自霞,等.几种提取植物DNA方法的比较[J].山西农业科学,2008,36(7):17-19.
[13]易红梅,张芳,王凤格,等.不同取样方式对DNA快速提取效果的影响[J].华北农学报,2007,22(5):114-116.

