重性抑郁障碍患者血浆天冬氨酸和甘氨酸及天冬酰胺水平的变化
付鑫焱,卢蕴容,2,吴娟利,吴雪艳,包爱民
(1.浙江大学医学院神经生物学系、浙江省神经生物学重点实验室、卫生部医学神经生物学重点实验室,浙江杭州 310058;2.浙江大学医学院附属第二医院精神科,浙江杭州 310009)
重性抑郁障碍(Major depressive disorder,MDD)是一种常见的情绪障碍,在世界范围内广泛流行,据统计MDD在浙江省发病率已达到4.3%[1]。MDD 的主要症状是长期情绪低落、思维迟缓和行为迟钝[2]。患者工作能力或行动力丧失,自杀率高达15%,因此,给个人和社会造成巨大危害。在对MDD的发病机制研究中发现,在神经元突触传递过程中起信使作用的神经递质的改变是重要的致病因素之一。在临床上,这种改变可以体现为不同脑区、体液(包括脑脊液、血液和尿液)中神经递质水平变化[3-4]。确定这些神经递质水平的变化特征与发病、治疗以及疾病转归之间的关系,无疑对于抑郁症的临床诊断和相关发病机制研究具有重要意义。
氨基酸类神经递质是一类能够通过神经突触传递神经信息的氨基酸,其中谷氨酸(Glutamate,Glu)和天冬氨酸(Aspartic acid,Asp)是兴奋性神经递质,γ-氨基丁酸(γ-amino butyric acid,GABA)和甘氨酸(Glycine,Gly)是抑制性神经递质[5-6]。大量的临床和对于人脑材料的研究证实,氨基酸类神经递质参与抑郁症发病机制,例如谷氨酸能和GABA能神经递质系统调节失衡导致下丘脑-垂体-肾上腺轴活性亢进[7-8],而后者在抑郁症症状和体征形成中扮演中心角色。关于Asp和Gly在抑郁症中的改变的研究报道则相对较少,结论也不一致。
Francis等人[9]报道了难治性抑郁症患者额叶皮层中Asp浓度升高。Altamura等人[10]发现,未经治疗的抑郁症患者血浆Asp水平和对照组没有差异,Gly水平显著降低。Mauri等人[11]发现,非忧郁型MDD患者血浆Asp和Gly水平与健康对照组相比无显著差异;用药物抗抑郁治疗8周后,MDD患者血浆Asp和Gly水平与治疗前相比也无显著改变。Sumiyoshi等人[12]同样报道了MDD患者血浆Gly水平无明显改变。这些研究发现之间的差异性可能和样本的抑郁症亚型、治疗干预方案等因素有关。因此,在进行这类研究中应该特别注意对于抑郁症亚型、治疗干预的措施等条件的限定,以正确判断氨基酸神经递质水平的相应改变及其和临床转归的关联。
研究表明,血脑屏障(Blood brain barrier,BBB)的存在使血浆和脑中氨基酸绝对水平之间存在差异。BBB的氨基酸转运体系统能够将血浆氨基酸转运至大脑,同时能够将脑中神经递质类氨基酸(包括Asp和Gly)逆浓度梯度转运至血液[13-15]。静脉血和脑脊液内氨基酸水平之间存在着相关性[16-17]。血浆氨基酸水平有可能间接反映脑内氨基酸水平而成为MDD的临床生物学指标之一,但是这种相关性在抑郁症中是否存在以及特征如何尚待研究。因此,本研究从新发病MDD抑郁症亚型患者着手,研究血浆Asp和Gly水平在治疗前后的改变。作为对照,还同时研究了血浆内非神经递质氨基酸天冬酰胺(Asparagine,Asn)的水平。
1 材料与方法
1.1 对象 本实验研究对象为2009年9月至2010年5月间浙江大学附属第二医院精神科住院及门诊的首发MDD患者。MDD患者由浙江大学附属第二医院精神科专科医师根据美国《精神障碍诊断与统计手册第四版》(Diagnostic and Statistical Manual of Mental Disorders,Fourth Edition,DSM-IV)[18]诊断标准诊断,同时进行贝克抑郁问卷(Beck Depression inventory,BDI)和汉密尔顿抑郁量表(Hamilton Depression Rating Scale,HAMD)评分[19]。排除标准为:1)器质性精神障碍、精神活性物质所致精神障碍、精神分裂症;2)严重性躯体疾病;3)体重指数(Body Mass Index,BMI)异常 (BMI≤ 18或BMI≥25)。健康对照者来自同期在医院进行健康体检人群,排除任何躯体疾病和精神障碍。15例MDD患者中男性9例、女性6例,平均年龄(47 ±10.7)岁,BECK 评分为(31.3 ±10.3)分,HAMD 评分为(34.0±10.9)分;14位健康对照者中男性7例、女性7例,平均年龄为(49±13.0)岁。其中7例MDD患者(男5例,女2例)在用氟西汀抗抑郁治疗2月后进行随访并收集血浆,HAMD评分为(14.0±4.2)分。所有患者和健康对照者均志愿加入研究并签署知情同意书,本研究获得浙江大学附属第二医院医学伦理委员会批准。
1.2 方法
1.2.1 样品采集和处理 MDD患者和健康对照者分别于上午6∶00-9∶00空腹抽取静脉血6 ml至抗凝管(含EDTA)中;4℃ 12 000 g离心15 min,取上清液分装于1.5 ml离心管中,-20℃贮存,并在1个月内转移至-80℃保存。样品分析时取出样品,冰上解冻;混匀,静置20 min,4℃,12 000 g离心 20 min;取上清液至新离心管中,放于真空冷冻干燥仪中冻干,然后用60%乙醇溶解上样。
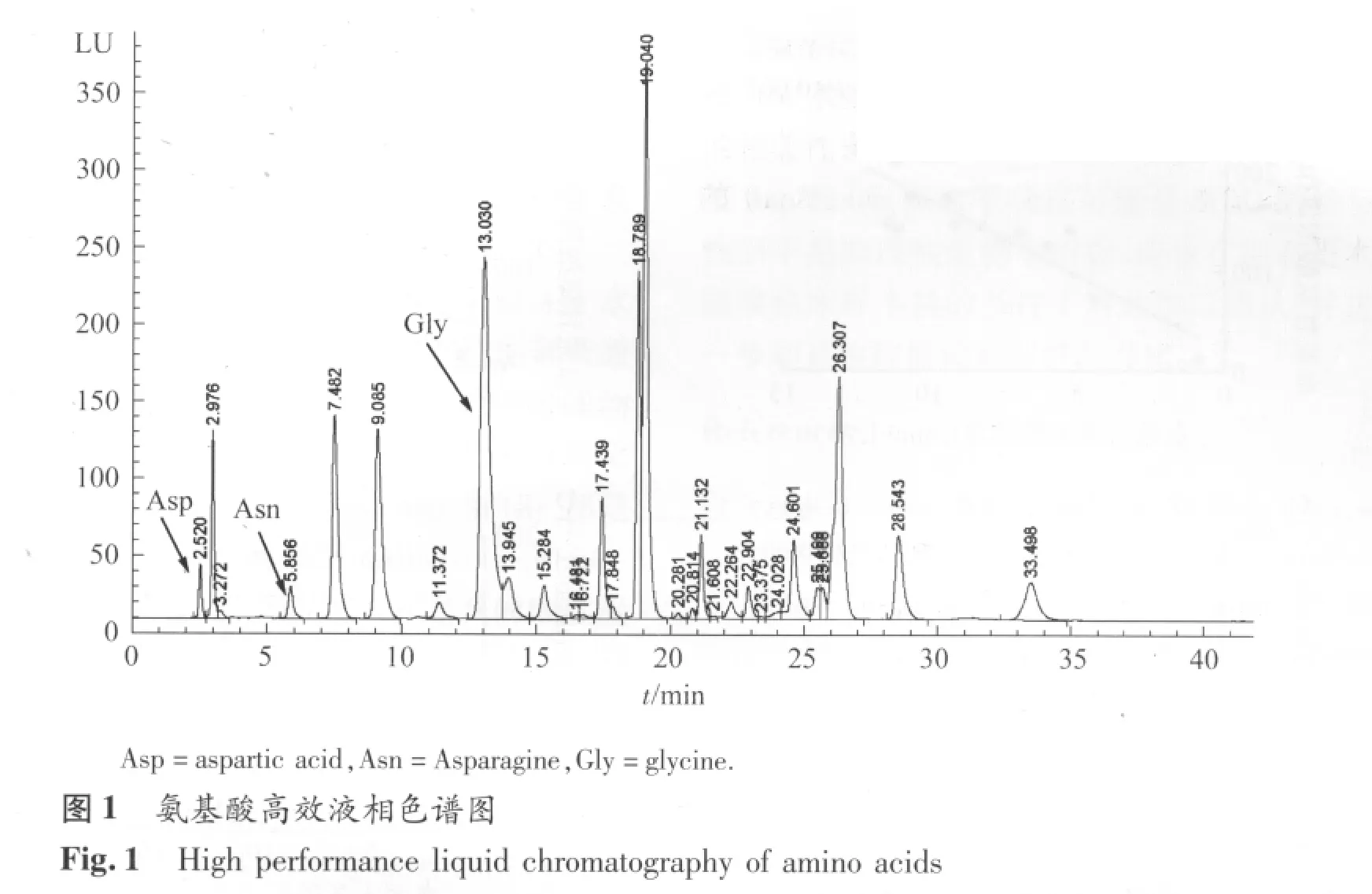
1.2.2 氨基酸浓度测定 血浆氨基酸浓度测定采用高效液相色谱—荧光法(High performance liquid chromatography with fluorescence detection,HPLC-FLD),HPLC 方法参考先前文献并加以修改[21-22]。主要仪器与试剂:Agilent 1100高效液相色谱仪(美国Agilent Technologies),真空冷冻干燥仪(美国Labconco)。L-Asp、L-Asn、L-Gly标品(美国Sigma公司),邻苯二甲醛(o-phthalaldehyde,OPA,美国 Pickering Laboratories公司),甲醇(霍尼韦尔Burdick&Jackson公司),无水醋酸钠(温州润华化工实业有限公司)等。色谱条件:色谱柱:Venusil XBP-C18柱子(4.6 mm ×250 mm,5 μm),流动相 A 相:醋酸钠(20 mmol· L-1)-三乙胺(pH=7.0)-四氢呋喃-甲醇(体积比为1000∶0.18∶3∶100),流动相 B 相:醋酸钠(20 mmol· L-1,pH=7.0)-甲醇(体积比为1∶4)。梯度洗脱程序:在不同时间段,流动相B的体积占流动相总体积(A相 +B相)的百分比分别为:0 ~10 min,90%;10~20 min,88%;20~30 min,50%;30~31 min,90%;31~41 min,90%;整个洗脱过程经历41 min。柱温:35℃;流速:1.0 ml· min-1;进样量 1μL;荧光检测激发波长340 nm,发射波长450 nm。在选定的色谱条件下,经过41 min洗脱,Asp、Asn和Gly的色谱峰分离较好(见图1)。
2 结果
2.1 氨基酸水平 MDD患者血浆Asp水平(2.14±2.02)μmol· L-1显著低于健康对照组(8.18 ±3.21)μmol· L-1,P <0.001。在对照组或者MDD组内,男性血浆Asp水平和女性相比无显著差异(P≥0.478)。
MDD患者血浆 Gly水平(98.70±52.64)μmol· L-1显著低于健康对照组(143.80±55.14)μmol· L-1,P=0.033。在对照组内或者MDD组内,男性血浆Gly水平和女性相比均无显著性差异(P≥0.722)。
MDD患者血浆 Asn水平(9.02±4.37)μmol· L-1和健康对照组(11.04 ±4.03)μmol· L-1相比无显著差异(P=0.208)。在对照组内或者MDD组内,男性血浆Asn水平和女性相比也无显著差异(P≥0.397)。
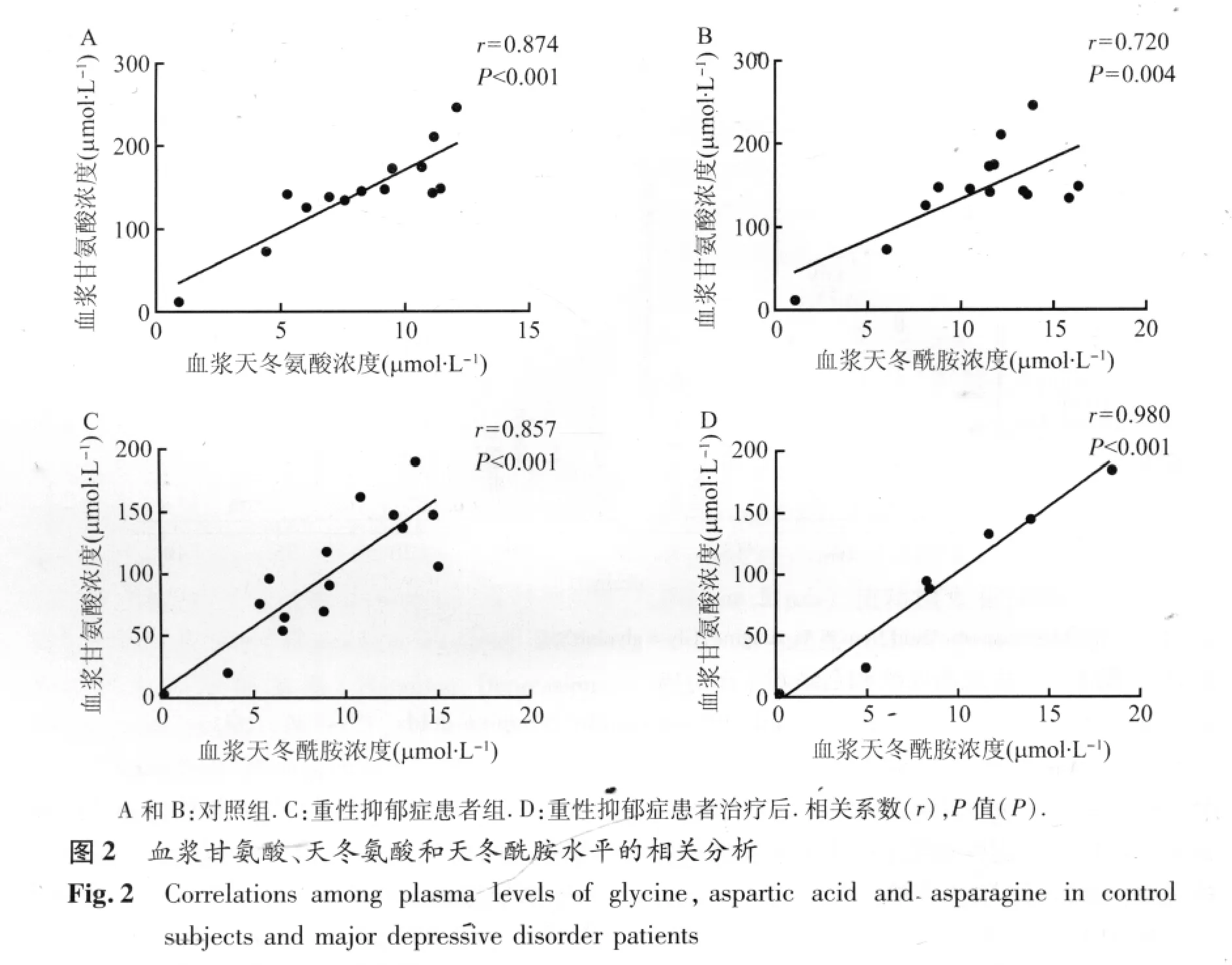
2.2 相关性分析 在健康对照组,血浆Gly水平与 Asp水平显著正相关(n=14,r=0.874,P<0.001,见图 2A),Gly水平与 Asn 水平显著正相关(n=14,r=0.720,P=0.004,见图 2B),Asp水平与Asn水平显著正相关(n=14,r=0.763,P=0.001)。然而,MDD 患者血浆 Gly水平与Asp水平、Asp与Asn水平的相关性分别缺失(P≥0.538),Gly水平与 Asn水平仍然保持显著正相关(n=15,r=0.857,P <0.001,见图2C)。
在健康对照和MDD患者中,血浆氨基酸水平与年龄(P≥0.147)无相关性,在新发MDD患者,血浆氨基酸水平与HAMD评分(P≥0.145)无显著相关性。
2.3 抗抑郁治疗后氨基酸水平 和治疗前相比,MDD患者血浆Asp、Gly、Asn水平无显著改变(P≥0.306)。Gly与 Asp水平、Asp与 Asn水平之间仍然无显著相关性(P≥0.317),而Gly水平与Asn水平的显著正相关性仍然存在(n=7,r=0.980 ,P <0.001,见图2D)。
3 讨论
本次研究发现,新发MDD患者的兴奋性神经递质Asp和抑制性神经递质Gly的血浆水平显著低于健康对照组,非神经递质Asn的血浆水平和对照组相比无显著差异。在健康对照组Gly与Asp水平,以及Asp和Asn水平之间分别显著正相关,而在MDD患者这些相关性消失。MDD患者抗抑郁治疗后在抑郁症状显著改善状态下,Asp、Gly和Asn水平无显著改变,氨基酸水平之间的相关性也保持不变。
我们对于新发MDD患者兴奋性氨基酸神经递质Asp的血浆水平显著降低的报道尚属首次。Altamura等人[10]曾经报道未经治疗的抑郁症患者血浆Asp水平和对照组相比没有差异,我们注意到他们所研究的患者包含双向抑郁症患者。有报道双向抑郁症患者血浆氨基酸类神经递质水平不同于 MDD患者[22]。Mauri等人[11]报道,MDD患者血浆Asp和Gly水平与健康对照组相比无显著差异,但是他们所研究的患者特指非忧郁型MDD(major depression without melancholia)患者。这与我们所研究的病例也不同,我们的研究囊括了忧郁型和非忧郁型MDD。我们发现的血浆Gly水平降低和Altamura等人[10]的报道一致,但是 Sumiyoshi等人[12]曾经报道MDD患者血浆Gly水平和正常对照组相比无差异。值得注意的是,他们所研究的病例至少有3个月没有遵医嘱接受抗抑郁药物治疗,患者平均HAMD评分为23,抑郁程度明显低于我们目前所研究的新发病MDD患者(HAMD评分平均值34)。上述这些研究之间的差异提示,在对于抑郁症患者体内神经递质含量进行研究时,需要严格限定疾病类型、病情程度、治疗状况等干扰因素。MDD患者血浆Asp和Gly水平降低的原因可能包括:(1)MDD患者对营养的消化吸收能力降低,体内氨基酸合成功能下降。Asp、Gly和Asn都属于非必需氨基酸,体内能够自己合成。MDD患者食欲减退,饮食减少,活动量下降,体内新陈代谢率降低,因此,Asp、Gly和 Asn的合成可以降低。但是,非神经递质氨基酸Asn在血浆中水平保持不变的状态则提示,神经递质Asp和Gly血浆水平的改变并非单纯由外周合成降低引起的。(2)BBB转运调节功能改变。BBB的存在使外周氨基酸不能自由进入中枢,血浆和脑中氨基酸浓度存在着差异[15]。血管内皮细胞膜上存在多种氨基酸转运体系统能够将血浆中氨基酸转运至大脑,BBB决定了脑内必需氨基酸的获得和含量[15]。非必需氨基酸例如LAsp的转运速率和摄入量显著低于必需氨基酸[15,23],但是在慢性疾病条件下,这一从外周到中枢的氨基酸转运过程则可能扮演重要角色。BBB还参与清除中枢神经系统的神经递质及其代谢产物的过程[13],星形胶质细胞和神经元上存在转运中性氨基酸和酸性氨基酸的Na+依赖的转运体系统,能够将脑中神经递质类氨基酸,包括Asp和Gly,逆浓度梯度转运至血液[13-15]。MDD患者血浆 Asp和 Gly水平降低可能是由于中枢神经递质类氨基酸水平降低而导致向外周转运减少,和/或BBB转运体功能改变而导致向外周转运氨基酸水平降低,加上外周氨基酸合成功能减低,共同导致血浆Asp和Gly水平低下。
在健康对照组中,血浆Asp、Gly和Asn水平之间的显著相关性体现了它们在代谢调节通路上的密切关联。Asp是合成Asn的前体物质[24],Asn在天冬酰胺酶的催化下又可以转化为Asp。另一方面,神经递质Asp和Gly都是N-甲 基-D-天 冬 氨 酸 (N-methyl-D-aspartate,NMDA)受体的天然配体[25],Asp是其内源性激动剂,Gly是其必需的协同激动剂[26-27],Asp 和Gly之间动态平衡的调节机制是生理状态下NMDA受体功能维持正常的保证。在MDD患者中这些调节机制紊乱,可能是造成这些神经递质之间相关性丧失的主要原因。MDD患者Gly水平与Asn水平之间的显著正相关性在治疗前后均未发生改变,这其中的生物学意义值得进一步研究。这种存在于MDD的神经递质和非神经递质类氨基酸之间的密切关联,为我们了解MDD中NMDA受体调节状态提供了有益的线索。此外,外周非神经组织,例如骨骼、胰腺、心脏、肺脏、肝脏、肠道等处也发现存在着谷氨酸受体,人们推测谷氨酸可能类似于分布更为广泛的“细胞因子”,对不同组织的细胞功能产生影响[28]。因此,抑郁症患者血浆氨基酸水平的改变也为其外周脏器功能改变提供了一种可能的原因,其具体作用机制和结果有待进一步研究。
本次研究发现,MDD患者血浆Asp和Gly及Asn水平在抗抑郁治疗前后无显著变化,这与前人采用药物治疗MDD患者的观察报道一致[11]。值得注意的是,Palmio 等人[29]发现电休克疗法(Electroconvulsive therapy,ECT)对Gly水平无显著影响,但是引起MDD患者血浆Asp和Asn水平显著升高。有报道称ECT能够显著改变BBB的通透性[30]。这再次显示不同的治疗方案可以显著影响体内神经递质转运过程。因此,在进行对比研究时要仔细匹配相关干扰因素,在分析结论时要对相关干扰因素加以甄别。由于在氟西汀抗抑郁治疗之后,在抑郁症状改善的条件下,MDD患者Asp和Gly及Asn水平没有显著改变,而氨基酸水平之间的相关性也保持不变。有理由推测这提示了血浆Asp和Gly低水平状态可能是MDD的特征性而不是阶段性生物学指标,应该在拥有更大规模临床样本量的条件下对此加以确认,并进一步和其他抑郁症亚型进行对比。
[1]SHI Qi-chang,ZHANG Jian-min,XU Fang-zhong,et al(石其昌,章健民,徐方忠,等).Epidemiological survey of mental illnesses in the people aged 15 and older in Zhejiang Province,China [J].Chinese Journal of Preventive Medicine(中华预防医学杂),2005,39(4):8.(in Chinese)
[2]SHEN Yu-cun(沈渔邨).Psychiatry(精神病学)[M].5th edtion.Beijing:People's Medical Publishing House,2009.(in Chinese)
[3]MANJI H K,DREVETS W C,CHARNEY D S.The cellular neurobiology of depression [J].Nat Med,2001,7(5):541-547.
[4]BELMAKER R H,AGAMG.Major Depressive Disorder[J].New Engl J Med,2008,358(1):55-68.
[5]ZORUMSKI C F,OLNEY J W.Excitotoxic neuronal damage and neuropsychiatric disorders [J].Pharmacol Ther,1993,59(2):145-162.
[6]MARK L P,PROST R W,ULMER J L,et al.Pictorial review of glutamate excitotoxicity:Fundamental concepts for neuroimaging[J].Am J Neuroradiol,2001,22(10):1813-1824.
[7]GAO S F,BAO A M.Corticotropin-releasing hormone,glutamate,and gamma-aminobutyric acid in depression [J].Neuroscientist,2011,17(1):124-144.
[8]KUGAYA A,SANACORA G.Beyond monoamines:glutamatergic function in mood disorders[J].CNS Spectr,2005,10(10):808-819.
[9]FRANCIS P T,POYNTON A,LOWE S L,et al.Brain amino acid concentrations and Ca2 +-dependent release in intractable depression assessed antemortem [J].Brain Res,1989,494(2):315-324.
[10]ALTAMURA C,MAES M,DAI J,et al.Plasma concentrations of excitatory amino acids,serine,glycine,taurine and histidine in major depression[J].Eur Neuropsychopharmacol,1995,5 Suppl:71-75.
[11]MAURI M C,FERRARA A,BOSCATI L,et al.Plasma and platelet amino acid concentrations in patients affected by major depression and under fluvoxamine treatment[J].Neuropsychobiology,1998,37(3):124-129.
[12]SUMIYOSHI T,ANIL A E,JIN D,et al.Plasma glycine and serine levels in schizophrenia compared to normal controls and major depression:relation to negative symptoms [J].Int J Neuropsychopharmacol,2004,7(1):1-8.
[13]OHTSUKI S.New aspects of the blood-brain barrier transporters;its physiological roles in the central nervous system [J].Biol Pharm Bull,2004,27(10):1489-1496.
[14]HOSOYA K,SUGAWARA M,ASABA H,et al.Blood-brain barrier produces significant efflux of L-aspartic acid but not D-aspartic acid:in vivo evidence using the brain efflux index method[J].J Neurochem,1999,73(3):1206-1211.
[15]HAWKINS B T,EGLETON R D.Fluorescence imaging of blood-brain barrier disruption [J].J Neurosci Methods,2006,151(2):262-267.
[16]D'SOUZA C,GIL R,CASSELLO K,et al.IV glycine and oral D-cycloserine effects on plasma and CSF amino acids in healthy humans[J].Biol Psychiatry,2000,47(5):450-462.
[17]HAGENFELDT L,BJERKENSTEDT L,EDMAN G,et al.Amino acids in plasma and CSF and monoamine metabolites in CSF:interrelationship in healthy subjects[J].J Neurochem,1984,42(3):833-837.
[18]APA.Diagnostic and Statistical Manual of Mental Disorders(DSM-Ⅳ)[M].4th edtion.Washington,DC:American Psychiatric Press,1994:1-886.
[19]HAMILTON M.A rating scale for depression[J].J Neurol Neurosurg Psychiatry,1960,23:56-62.
[20]DE FREITAS SILVA DM,FERRAZ VP,RIBEIRO ÂM. Improved high-performance liquid chromatographic method for GABA and glutamate determination in regions of the rodent brain [J].JNeurosci Methods,2009,177(2):289-293.
[21]ROWLEY H L,MARTIN K F,MARSDEN C A.Determination of in vivo amino acid neurotransmitters by high-performance liquid chromatography with o-phthalaldehyde-sulphite derivatisation [J].J Neurosci Methods,1995,57(1):93-99.
[22]HOEKSTRA R,FEKKES D,LOONEN AJM,et al.Bipolar mania and plasma amino acids:Increased levels of glycine[J].Eur Neuropsychopharm,2006,16(1):71-77.
[23]SMITH Q R.Transport of Glutamate and Other Amino Acids at the Blood-Brain Barrier[J].J Nutr,2000,130(4):1016.
[24]STEGINK L D,FILER J R,BELL E F,et al.Effect of repeated ingestion of aspartame-sweetened beverage on plasma amino acid,blood methanol,and blood formate concentrations in normal adults[J].Metabolism,1989,38(4):357-363.
[25]FLECK M W,HENZE D A,BARRIONUEVO G,et al.Aspartate and glutamate mediate excitatory synaptic transmission in area CA1 of the hippocampus[J].J Neurosci,1993,13(9):3944-3955.
[26]TRAYNELIS S F,WOLLMUTH L P,MCBAIN C J,et al.Glutamate receptor ion channels:structure,regulation,and function [J].Pharmacol Rev,2010,62(3):405-496.
[27]ZHANG X,NADLER J V.Postsynaptic response to stimulation of the Schaffer collaterals with properties similar to those of synaptosomal aspartate release[J].Brain Res,2009,1295(0):13-20.
[28]SKERRY T M,GENEVER P G.Glutamate signalling in non-neuronal tissues[J].Trends Pharmacol Sci,2001,22(4):174-181.
[29]PALMIO J,HUUHKA M,SARANSAARI P,et al.Changes in plasma amino acids after electroconvulsive therapy of depressed patients[J].Psychiatry Res,2005,137(3):183-190.
[30]CHAMBERLIN E,TSAI G E.A Glutamatergic Model of ECT-induced Memory Dysfunction[J].Harvard Rev Psychiat,1998,5(6):307-317.

