半胱氨酰白三烯受体1参与鱼藤酮诱导PC12细胞损伤的调节
余舒莹,赵 冰,张霞燕,张晓燕,王艳芳,张丽慧,卢韵碧,魏尔清
(1.浙江大学医学院药理学系,浙江杭州 310058;2.杭州师范大学基础医学部药理学教研室,浙江杭州 310036)
鱼藤酮是一种广泛应用于农业的杀虫剂,在体外能损伤多巴胺能神经元[1-2],产生与帕金森病(Parkinson's disease,PD)病理特征相似的表现[3]。鱼藤酮作为一种细胞毒性化合物,是特异性线粒体复合体I抑制剂,可选择性地阻断铁-硫簇N2和泛醌Q的作用,导致线粒体呼吸链电子转运障碍,造成氧化应激及ATP生成障碍,从而引起细胞损伤[4-5]。PC12细胞作为常用的PD细胞模型,是大鼠肾上腺嗜铬细胞瘤克隆化的细胞株,其合成的酶类、表达的受体以及合成的神经递质接近中脑多巴胺(dopamine,DA)神经元[6],已被广泛用于 DA神经元体外研究,特别是用于PD发病机制的研究。
花生四烯酸经5-脂氧酶催化而生的成半胱氨酰白三烯(cysteinyl leukotrienes,CysLTs),包括LTC4、LTD4和LTE4,是一类活性很强的炎症介质,其作用由 CysLT1和 CysLT2受体介导[7]。CysLTs经PD诱变剂鱼藤酮处理后,可激活 PC12 细胞 5-脂氧酶[8],表明 CysLTs可能参与PD病变。鱼藤酮还能增加小鼠小胶质细胞株BV2细胞CysLT1受体表达,提示CysLT1受体参与PD的炎症调节过程[9]。本实验室以往的研究表明,脑缺血性损伤后,脑内CysLT1表达增加[10];CysLT1受体拮抗剂普鲁司特和孟鲁司特对脑缺血性损伤有保护作用[11-14]。但是,DA神经元CysLT1受体是否也参与PD病变过程,CysLT1受体拮抗剂能否保护鱼藤酮诱导的神经元损伤尚待研究。本研究观察CysLT1受体拮抗剂孟鲁司特对鱼藤酮引起PC12细胞损伤的作用,以及鱼藤酮引起CysLT1受体的表达、分布变化。
1 材料与方法
1.1 主要试剂与仪器 胰酶、多聚赖氨酸、鱼藤酮、青霉素、链霉素、二苯基四氮唑溴盐(MTT)购自美国Sigma公司;DMEM高糖培养基和马血清购自美国Gibco公司;胎牛血清购自杭州四季青生物技术有限公司;兔抗小鼠CysLT1受体多克隆抗体由本研究室制备[11];异硫氰酸荧光素(FITC)标记的山羊抗兔IgG、CY3标记的山羊抗兔IgG购自美国Chemicon公司;孟鲁司特(montelukast)由美国Merk公司赠送。BX51荧光显微镜购自日本Olympus公司;CO2培养箱购自美国Forma Scientific公司;多波长酶标仪(Elx800 Universal Micro-plate Recorder)购自美国 Bio-TEK公司;SDS-PAGE胶电泳转膜装置购自美国 BIORAD公司;ODYSSEY免疫印迹膜荧光成像系统购自美国LI-COR Biosciences公司。
1.2 细胞培养 高分化大鼠肾上腺嗜铬细胞瘤PC12细胞购自中国科学院上海细胞生物学研究所,用含10%胎牛血清的高糖DMEM完全培养基(含青霉素105U/L、链霉素105μg/L),在5%CO2培养箱37℃培养,2~3 d传代,相近代数的细胞用于实验。当细胞铺满培养瓶底面积80%~90%时,以0.25%胰酶消化3~4 min,将细胞收集到离心管中,1 000 r/min离心5 min后,弃上清。加入培养基重悬细胞,接种在96孔和24孔中的细胞浓度分别为4 ×103/孔、2.5 ×l04/孔。细胞接种24 h后,进行不同处理。
1.3 确定鱼藤酮处理损伤浓度[15]及形态观察、活性测定(MTT法)[16]PC12细胞种于96孔板,贴壁生长24 h后,分别加入不同浓度鱼藤酮(终浓度 0.3、1、3、10、30 μmol/L),对照组换用培养液,然后放入5%CO2培养箱培养24 h。在光学显微镜下观察细胞形态并摄影。
为测定细胞活性,处理结束后小心吸弃96孔板每孔的培养液,加入100μL MTT溶液(0.5 mg/ml,DMEM 培养基配制),在 5%CO2培养箱37℃继续孵育2 h后,小心吸弃上清液,每孔加入100μL DMSO中止反应,振摇使生成的formazan颗粒充分溶解,用酶标仪测定波长570 nm处吸光值(OD570),OD值大小反映细胞的存活,以正常对照组MTT吸光值为基数100%,以药物处理组与正常对照组吸光值的百分比,计算存活细胞百分率。
1.4 Western blotting测定CysLT1受体蛋白用胰酶消化收集鱼藤酮处理后的PC12细胞,以常规方法提取总蛋白,用考马斯亮蓝法做标准曲线,测定提取液中的蛋白浓度。取100 μg蛋白进行SDS-PAGE电泳,先以100 V恒压使Marker分开,再以150 V恒压继续电泳,直至溴酚蓝条带到达分离胶底部。然后,300 mA电转移90 min至硝酸纤维素膜,经TBST漂洗后,放入含5%脱脂奶粉中,平放在平缓摇动的摇床平台上,室温孵育120 min。取出硝酸纤维素膜,放入混有GAPDH(小鼠单克隆抗体1∶5000)及CysLT1受体(1∶500)的一抗中,4℃冰箱中过夜,再用TBST漂洗10 min,共3次,与抗兔IRDye700DX®偶联或抗鼠IRDye800DX®偶联的二抗(1∶5000)室温孵育2 h,漂洗后,用凝胶成像系统摄像,利用Quality One软件以GAPDH为内参,结果以CysLT1受体和GAPDH的条带光密度比值相对百分比表示。
1.5 免疫细胞化学检测细胞CysLT1受体的分布 PC12细胞种于24孔板的盖玻片上,贴壁生长24 h后,细胞经不同浓度鱼藤酮处理24 h及3 μmol/L鱼藤酮处理不同时间后,收集玻片,以0.01 mol/L PBS轻轻漂洗,冰甲醇冰上固定 5 min,再用 0.01 mol/L PBS清洗3次,加5%非免疫羊血清室温封闭2 h。每孔各加一抗(1∶500),4℃孵育过夜;次日,PBS清洗3次后,加抗兔FITC标记(绿色)或CY3标记(红色)的荧光二抗(1∶200),在室温下孵育2 h,PBS清洗3次,并用碳酸甘油缓冲液(含1∶1000 DAPI,染细胞核)封片。在荧光显微镜下观察CysLT1受体在PC12细胞上的分布并摄影。
2 结果
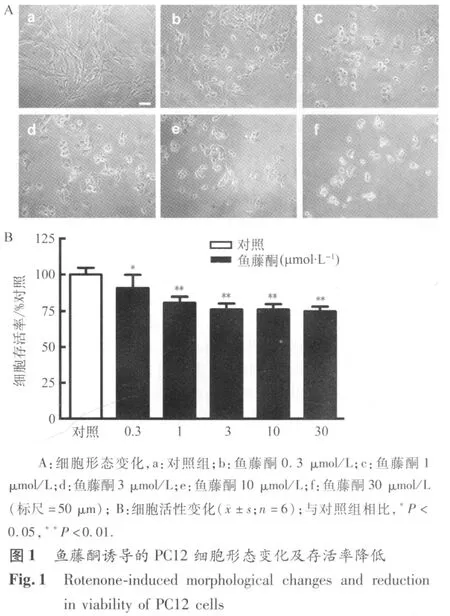
2.1 鱼藤酮诱导PC12细胞损伤变化 鱼藤酮(终浓度 0.3、1、3、10、30 μmol/L)处理 PC12细胞24 h后,光镜下可见,随着鱼藤酮浓度的增大,细胞出现明显的形态学改变,包括细胞突起变短、消失,细胞萎缩、变圆(图1A);细胞活性明显降低,分别降低至对照值的91%、81%、76%、76%、75%(P <0.05 ~0.01,图 1B)。鱼藤酮3 μmol/L的作用24 h的变化明显、适度,因此,选择该条件作为诱导PC12细胞损伤的条件。
2.2 CysLT1受体拮抗剂对鱼藤酮诱导PC12细胞损伤的影响 常规培养条件下,孟鲁司特0.2、1、5 μmol/L 作用24 h,对细胞活性没有明显影响,而 10 μmol/L轻度增高细胞活性[100.0 ±2.3 vs 106.3 ±4.5(%),P <0.01,图2A]。孟鲁司特 0.2 ~10 μmol/L 预先孵育PC12细胞30 min,再用3 μmol/L鱼藤酮处理24 h,结果表明1、5 μmol/L 孟鲁司特可显著抑制鱼藤酮诱导的细胞活性降低[100.0±2.9 vs 103.7 ± 3.1、98.8 ± 4.3(%)],而 0.2、10 μmol/L孟鲁司特无显著抑制作用[100.0±2.9 vs 90.9 ± 2.8、77.1 ± 4.5(%),P < 0.05 ~0.01,图 2B]。
2.3 鱼藤酮引起PC12细胞CysLT1受体表达的变化 Western blotting检测结果表明,PC12细胞在正常条件下表达CysLT1受体(条带约43 kD,图 3A);鱼藤酮 1、3、10 μmol/L 处理 24 h后,PC12细胞表达CysLT1受体表达显著增加[100 ± 4.4 vs 135.7 ± 6.3、146.9 ± 5.8、118.1±5.5(与 GAPDH 的比值),P <0.05,图 3A]。鱼藤酮3 μmol/L 作用3、24 h 后,CysLT1受体表达显著增多[100 ±4.2 vs 155.4 ±5.6,153.3 ±5.7(与 GAPDH 的比值),P <0.05,图3B]。
2.4 鱼藤酮诱导PC12细胞CysLT1受体分布的改变 本实验结果显示,CysLT1受体正常情况下主要分布在细胞核;经0.003 μmol/L鱼藤酮处理24 h后CysLT1受体分布未发生明显变化,但 0.01 μmol/L 以上鱼藤酮处理 24 h后,CysLT1受体趋向分布于胞浆(图 4A),当 3 μmol/L鱼藤酮处理从25 min开始,CysLT1受体分布发生变化(图4B)。

3 讨论
本研究结果表明,鱼藤酮0.3~30 μmol/L处理24 h,可浓度依赖性降低PC12细胞活性,并改变细胞形态。CysLT1受体拮抗剂孟鲁司特对鱼藤酮诱导损伤的保护作用,提示CysLT1受体可能参与PC12细胞的PD样变化。孟鲁司特的作用表现“钟形”量效关系,即1、5 μmol/L能有效减轻细胞损伤,而 0.2、10 μmol/L 则无明显减轻作用,这一结果与脑缺血整体动物实验结果[14]相似。
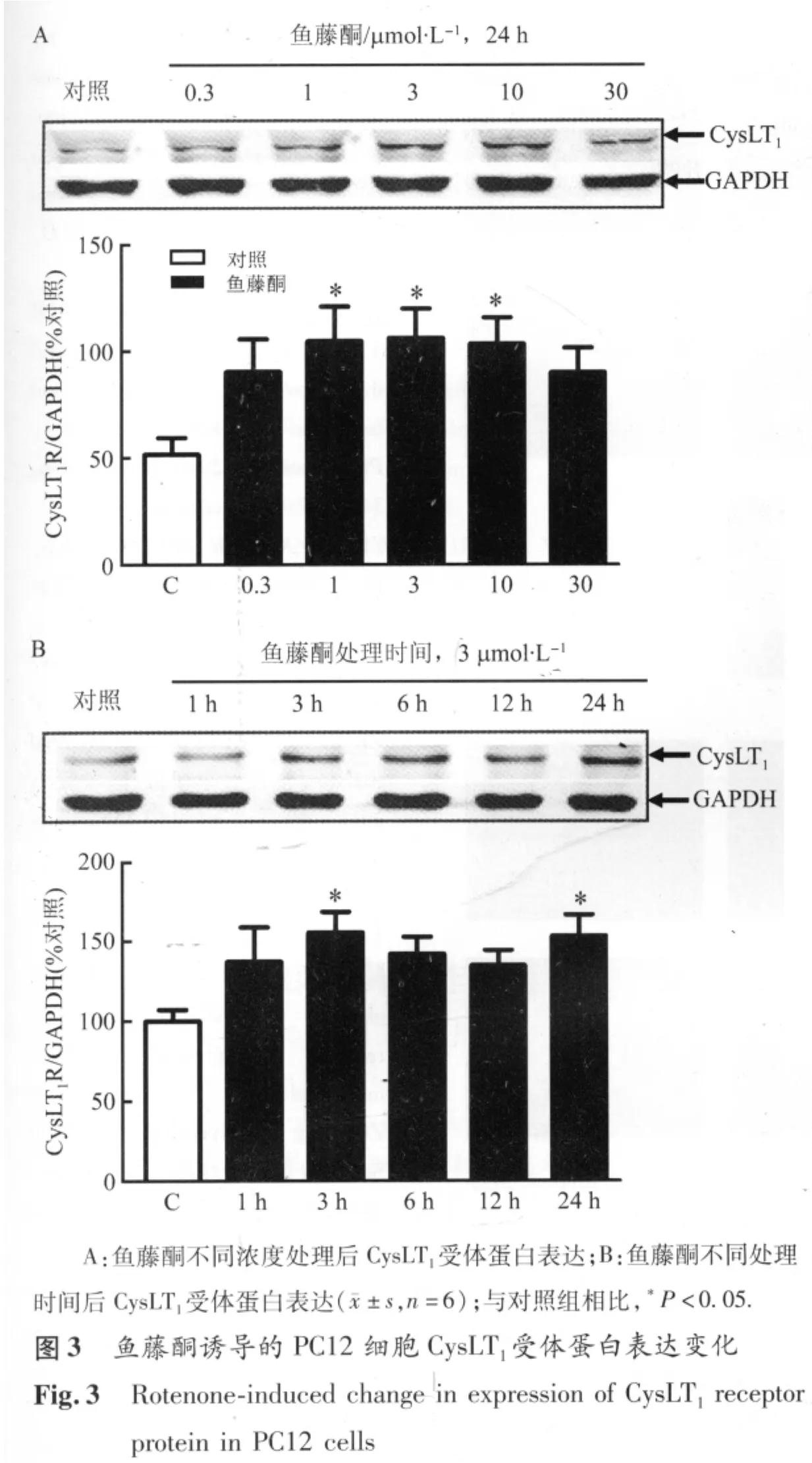

CysLT1受体表达、分布特点进一步证实其与鱼藤酮损伤的关系。鱼藤酮1~10 μmol/L作用 24 h后,CysLT1受体显著增加,但 30 μmol/L未显示该作用。鉴于鱼藤酮慢性中毒诱导PD病变时能到达脑内的浓度可能较低,因此,CysLT1受体可能在PD发生中起调节作用。鱼藤酮3 μmol/L诱导CysLT1受体表达的时间过程具有“双峰”特点,即在3 h及24 h存在表达高峰,提示CysLT1受体可能介导急性和后期效应。在大鼠局灶性脑缺血后,缺血中心区在3~12 h及7~14 d也有2个CysLT1受体表达高峰,分别介导急性神经元损伤和后期小胶质细胞激活[10]。在本实验离体条件下,很可能由于鱼藤酮诱导早期代谢障碍,促进CysLT1受体表达并介导PC12细胞损伤;而后期(24 h)由于细胞因子等释放促进CysLT1受体表达,参与炎症相关的变化。这一双峰表达的机制和意义,还有待阐明。
免疫组化结果证实,正常情况下 CysLT1受体主要分布于PC12细胞的细胞核内,随鱼藤酮作用浓度的升高,CysLT1受体移位到胞浆;3 μmol/L鱼藤酮作用的时间过程表明,从25 min开始,CysLT1受体就发生明显的移位。在结肠癌细胞中,CysLT1受体也主要分布在核内[17],其意义尚未阐明,但认为与细胞增殖反应有关[17]。在 BV2 细胞,鱼藤酮浓度依赖性诱导CysLT1受体核移位[9],可能与小胶质细胞激活相关;但鱼藤酮对PC12细胞表现损伤作用,其诱导的CysLT1受体移位特点有别于BV2细胞。CysLT1受体的这种移位特点,与PC12细胞损伤究竟有什么关联,还需要进一步研究。
综上所述,本研究证明CysLT1受体参与鱼藤酮诱导的PC12细胞损伤,CysLT1受体拮抗剂孟鲁司特可减轻鱼藤酮诱导的细胞损伤,其机制还有待进一步研究。
[1]OLANOW C W.The pathogenesis of cell death in Parkinson's disease[J].Mov Disord,2007,22(S17):S335-S342.
[2]SAI Y,WU Q,LE W,et al.Rotenone-induced PC12 cell toxicity is caused by oxidative stress resulting from altered dopamine metabolism [J].Toxicol In Vitro,2008,22(6):1461-1468.
[3]GREENAMYRE J T,BETARBET R,SHERER T B.The rotenone model of Parkinson's disease:genes,environment and mitochondria[J].Parkinsonism Relat Disord,2003,9(S2):S59-S64.
[4]FATO R,BERGAMINI C,BORTOLUS M,et al.Differential effects of mitochondrial complex I inhibitors on production of reactive oxygen species[J].Biochim Biophys Acta,2009,1787(5):384-392.
[5]ABDIN A A,HAMOUDA H E.Mechanism of the neuroprotective role of coenzyme Q10 with or without L-dopa in rotenone-induced parkinsonism[J].Neuropharmacology,2008,55(8):1340-1346.
[6]DAS P C,MCELROY W K,COOPER R L.Potential mechanisms responsible for chlorotriazineinduced alterations in catecholamines in pheochromocytoma(PC12)cells[J].Life Sci,2003,73(24):3123-3138.
[7]SINGH R K,GUPTA S,DASTIDAR S,et al.Cysteinyl leukotrienes and their receptors:molecular and functional characteristics [J].Pharmacology,2010,85(6):336-349.
[8]ZHANG Xiao-yan,ZHANG Li-hui,LI Cheng-tan,et al(张晓燕,张丽慧,李成檀,等).5-1ipoxygenase is involved in rotenone induced injury in PC12 cells[J].Journal of Zhejiang University:Medical Science(浙江大学学报:医学版),2011,40(2):150-155.(in Chinese)
[9]LUO Jiang-yun,ZHANG Zhuang,YU Shu-ying,et al(骆江云,张壮,余舒莹,等).Rotenone induced changes of cysteinyl leukotriene receptor l expression in BV2 mieroglial cells[J].Journal of Zhejiang University:Medical Science(浙江大学学报:医学版),201l,40(2):131-138. (in Chinese)
[10]FANG S H,WEI E Q,ZHOU Y,et al.Increased expression of cysteinyl leukotriene receptor-1 in the brain mediates neuronal damage and astrogliosis after focal cerebral ischemia in rats.Neuroscience,2006,140(3):969-979.
[11]ZHANG L H,WEI E Q.ONO-1078 reduces NMDA-induced brain injury and vascular cell adhesion molecule-1 expression in rats[J].Acta Pharmaco1 Sin,2005,26(4):435-440.
[12]ZHANG W P,WEI E Q,MEI R H,et al.Neuroprotective effect of ONO-1078,a leukotriene receptor antagonist,on focal cerebral ischemia in rats[J].Acta Pharmacol Sin,2002,23(10):871-877.
[13]YU G L,WEI E Q,WANG M L,et al.Pranlukast,a cysteinyl leukotriene receptor-1 antagonist,protects against chronic ischemic brain injury and inhibits the glial scar formation in mice[J].Brain Res,2005,1053(1-2):116-125.
[14]YU G L,WEI E Q,ZHANG S H,et al.Montelukast,a cysteinyl leukotriene receptor-1 antagonist,dose-and time-dependently protects focal cerebral ischemia in mice [J].Pharmacology,2005,73(1):31-40.
[15]SIDDIQUI M A,KASHYAP M P,KHANNA V K,et al.Association of dopamine DA-D2 receptor inrotenone-induced cytotoxicity in PC12 cells.Toxicol Ind Health,2010,26(8):533-542.
[16]HUANG X J,ZHANG W P,LI C T,et al.Activation of CysLT receptors induces astrocyte proliferation and death after oxygen-glucose deprivation [J].Glia,2008,56(1):27-37.
[17]NIELSEN C K,CAMPBELL J I,OHD J F,et al.A novel localization of the G-protein-coupled CysLT1receptor in the nucleus of colorectal adenocarcinoma cells[J].Cancer Res,2005,65(3):732-742.

