枯草芽孢杆菌转化鱿鱼墨制备溶栓型发酵液
夏 宇,卢笑莹,杨益波,冯伟栋,宋 茹,韦荣编
(1.浙江海洋学院东海科学技术学院,浙江舟山 316004;2.浙江海洋学院食品与药学学院,浙江舟山 316004;3.浙江海洋学院海洋科学学院,浙江舟山 316004)
血栓疾病严重危害人类健康和生命安全,在我国随着人们生活水平提高和生活方式的改变,高脂肪、高蛋白膳食的过量摄取,加上老龄化社会的到来,血栓性疾病已经超过癌症和糖尿病成为头号健康杀手[1]。所以,开发安全性高、特异性强的溶栓剂是目前溶栓制剂的研究热点,其中以生物发酵制备溶栓因子的研究备受关注。虽然传统发酵豆制品是纤溶性纳豆激酶主要来源[2-6],但近年来从溶栓因子产生菌的新型发酵液也不断分离出具有溶栓型活性物质[7-8]。鱿鱼墨蛋白质含量高,并且富含多种氨基酸和多糖类[9],可提供溶栓因子产生菌生长繁殖所需营养,而发酵鱿鱼墨制备溶栓因子的研究还鲜见报道。本文以一种纤溶因子产生菌—枯草芽孢杆菌发酵鱿鱼墨,研究发酵影响因素对产物溶栓性影响,旨在为发酵参数的优化研究奠定基础。
1 材料与方法
1.1 主要材料
鱿鱼墨由舟山市兴业公司提供;枯草芽孢杆菌Bacillus subtilis由浙江海洋学院食品系提供;纤维蛋白原(98 mg/支)、尿激酶、凝血酶购于中国药品生物制品鉴定所;其余试剂均为国产分析纯或生物制剂。
1.2 培养基
枯草芽孢杆菌活化/种子培养基:在1 000 mL蒸馏水中加入酵母浸粉5 g、蛋白胨10 g、NaCl 10 g,调至pH 7.0,121℃加热灭菌30 min。
鱿鱼墨发酵培养基:将鱿鱼墨与蒸馏水按照1:100(w/v)比例混合,加入MgSO4(0.05%)、KH2PO4(0.1%)和葡萄糖(0.5%~3.0%),调节混合液pH至7.2,121℃加热灭菌30 min。
1.3 实验方法
1.3.1 种子液制备
在100 mL锥形瓶中装入50 mL枯草芽孢杆菌种子培养基,然后接入1~2环枯草芽孢杆菌,在37℃培养24 h,摇床转速160 r/min,得种子液,备用。
1.3.2 发酵影响因素
在固定发酵温度37℃、鱿鱼墨培养基pH 7.2条件下,实验分别研究了芽孢杆菌接种量(0.5%、1.0%、1.5%、2.0%、2.5%、3.0%)、发酵时间(24 h、48 h、72 h)、摇床转速(120 r/min、160 r/min、200 r/min)、葡萄糖添加量(0.5%、1.0%、1.5%、2.0%、3.0%)、装液量(40 mL/100 mL、50 mL/100 mL、60 mL/100 mL、70 mL/100 mL)对产物溶栓性影响。
1.3.3 发酵液收集
将不同发酵因素下所得发酵液在7 000 r/min离心20 min,收集上清液用于溶栓性检测。
1.3.4 溶栓性检测
根据纤维蛋白—琼脂糖平板法[1]进行适当改进,具体操作如下:将融化好的琼脂糖培养基5 mL(在50 mL pH7.2磷酸缓冲液中加入琼脂糖和葡萄糖各1 g,加热至透明,5 mL/管分装,110℃高压灭菌15~20 min)放在55~60℃水浴保温,然后加入1 mL纤维蛋白原(7.4 mg/mL),小心振荡混合,再加入0.5 mL凝血酶(21 U/mL),快速混合后倒入灭菌培养皿中,室温下形成乳白色纤维蛋白平板,现用现配以防止污染。用灭菌打孔器在纤维蛋白板上打孔(直径2 mm),每孔加入枯草芽孢杆菌发酵液10 μL,37℃孵育24 h,观察是否有溶栓圈形成。以16~128 IU/mL尿激酶为标准品制作溶栓性标准曲线。
2 结果与分析
2.1 发酵影响因素
2.1.1 接种量对发酵产物的溶栓性影响
鱿鱼墨培养基中葡萄糖添加量2%,在100 mL锥形瓶中鱿鱼墨培养基装液量50 mL,分别按0.5%、1.0%、1.5%、2.0%和2.5%的接种量将活化24 h的枯草芽孢杆菌菌液接入,摇床转速160 r/min,37℃下发酵48 h,测定各发酵液的溶栓性,结果见表1。

表1 接种量对鱿鱼墨发酵液的溶栓性影响Tab.1 Effect of bacteria content on the fibrinolytic activity of squid ink fermentation
表1结果显示当接种量为1.0%时,发酵液的溶栓性并不明显,当接种量大于1.5%时,所得鱿鱼墨发酵液具有一定溶栓性,而鱿鱼墨本身不具有溶栓作用(对照,未接种),说明枯草芽孢杆菌可发酵鱿鱼墨培养基生成纤溶因子。在发酵过程中,微生物利用蛋白质进行生长繁殖分泌出诸如具有纤溶作用的纳豆激酶[10-11]。同时,发酵过程中也会生成大量蛋白水解酶系,进一步水解大分子蛋白生成蛋白胨、活性肽和氨基酸类[12-15]。生成的小分子肽和氨基酸也会被微生物吸收利用,从而又会促进菌体的生长繁殖。表1鱿鱼墨枯草芽孢杆菌发酵液的溶栓作用可能与枯草芽孢杆菌分泌的纤溶蛋白酶或被蛋白水解酶进一步水解生成的鱿鱼墨多肽或糖肽活性有关。
2.1.2 发酵时间对发酵产物溶栓性影响
鱿鱼墨培养基中葡萄糖添加量2%,100 mL锥形瓶装液量50 mL,芽孢杆菌接种量2.0%,摇床转速160 r/min,分别在 37 ℃下发酵 24 h、48 h和 72 h,产物的溶栓性见表2。

表2 发酵时间对鱿鱼墨发酵液的溶栓性影响Tab.2 Effect of fermenting time on the fibrinolytic activity of squid ink fermentation
由表2可知当发酵时间大于48 h时,鱿鱼墨的枯草芽孢杆菌发酵液具有溶栓作用,且发酵时间72 h的溶栓效果要明显强于发酵时间48 h的溶栓性。微生物在发酵过程中分泌的蛋白酶与菌体生成量有关,在发酵初期是菌体量不断增加,蛋白酶活力也不断增加,随着发酵时间的延长,菌体处于稳定生长期,其分泌的蛋白酶活力也达到最高值,之后菌体生长进入衰亡期,相应酶活力也降低[10]。鲍时翔等[3]报道了纳豆菌Bacillus natto strain B-2023在不同氮源和碳源条件下的纳豆菌产酶效果均在72 h时最佳。杨慧宁等[10]用海参为培养基液态发酵纳豆枯草杆菌,同样在发酵时间72 h的纤溶酶活力达到最高。WANG等以虾壳为唯一底物,接种Pseudomonas sp.TKU015发酵2 d时的纳豆激酶活性最高[16]。表2中发酵液的溶栓活性出现在发酵时间大于48 h后,与文献报道是一致的。
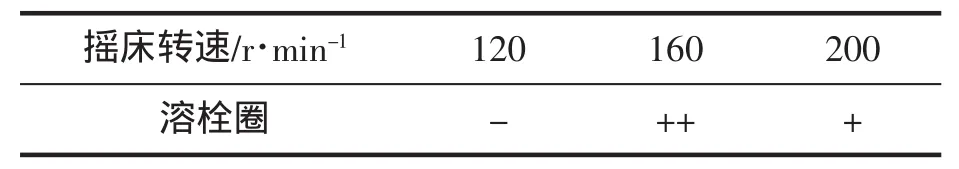
表3 摇床转速对鱿鱼墨发酵液的溶栓性影响Tab.3 Effect of shaking speed on the fibrinolytic activity of squid ink fermentation
2.1.3 摇床转速对发酵产物溶栓性影响
设定枯草芽孢杆菌发酵鱿鱼墨的摇床转速分别为120 r/min、160 r/min 和 200 r/min,其他条件相同,即:鱿鱼墨培养基中葡萄糖加入量2.0%,装液量50 mL/100 mL,芽孢杆菌接种量2.0%,37℃下恒温发酵72 h,摇床转速对发酵产物的溶栓性影响见表3。
表3结果表明当摇床转速为160 r/min时,枯草芽孢杆菌发酵鱿鱼墨培养基所得产物的溶栓性强于低转速120 r/min和高转速200 r/min下的溶栓性。适当提高摇床转速,可以增加发酵液中溶氧量和菌体均匀分布,有利于菌体的生长繁殖,增加枯草芽孢杆菌蛋白酶生成量。但是,摇床转速过高会形成较强的剪切作用,对菌体细胞有一定破坏作用,降低活菌体数量,结果降低蛋白酶生成量。另外,转速过高也不利于蛋白酶与鱿鱼墨蛋白或糖肽底物的充分接触进行酶切,结果小分子肽类或氨基酸等数量减少[17]。而该类小分子化合物与蛋白质或糖肽等大分子相比更易被微生物吸收利用,提供菌体生产繁殖所需营养,所以在规定发酵时间内,菌体相对数量的减少可能导致了鱿鱼墨枯草芽孢杆菌发酵产物溶栓性降低。
2.1.4 葡萄糖添加量对发酵产物溶栓性影响
在制备鱿鱼墨培养基时,葡萄糖添加量分别为0.5%、1.0%、1.5%、2.0%和3.0%,鱿鱼墨培养基在100 mL锥形瓶中的装液量均为50 mL,芽孢杆菌接种量2.0%,摇床转速160 r/min,37℃下发酵72 h,测定发酵的溶栓性,结果见表4。
据报道鱿鱼墨的蛋白质含量达到60%以上[9],所以从理论上来讲鱿鱼墨自身可以提供芽孢杆菌生长繁殖所需氮源。另外,鱿鱼墨苯酚—硫酸反应呈阳性(具体数据未列出),说明含有一定量糖类物质。但在前期实验中发现枯草芽孢杆菌发酵未加葡萄糖的鱿鱼墨培养基所得发酵液无溶栓活性,可能与鱿鱼墨中的糖类物质常常与蛋白质形成大分子不能被菌体有效吸收利用有关,进而影响了菌体生长繁殖和蛋白酶分泌。因此在鱿鱼墨培养基中添加外源糖,可以提供菌体生长繁殖所需碳源。但是,糖添加量过高会形成高渗透环境,不利于菌体对糖的有效利用。表4结果表明在鱿鱼墨培养基中添加葡萄糖量过少时,如:0.5%时,所得的发酵液无溶栓作用,可能与碳源不足菌体生长受到抑制有关。当葡萄糖添加量为2.0%时,发酵液表现出较强的溶栓活性。
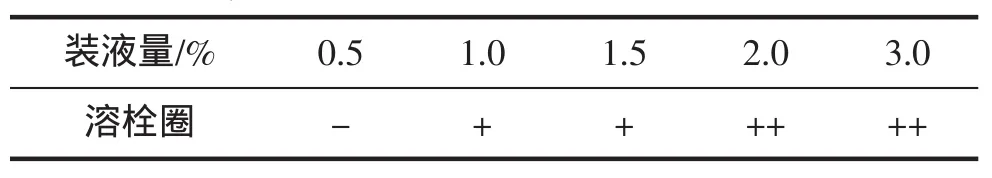
表4 葡萄糖添加量对鱿鱼墨发酵液的溶栓性影响Tab.4 Effect of the content of glucose addition on the fibrinolytic activity of squid ink fermentation
2.1.5 装液量对发酵产物溶栓性影响
在鱿鱼墨培养基中葡萄糖加入量2.0%,100 mL锥形瓶中鱿鱼墨培养基装液量分别为40 mL、50 mL、60 mL和70 mL时,其他发酵条件相同,即:芽孢杆菌接种量2.0%,摇床转速160 r/min,37℃发酵72 h。不同装液量下,发酵液的溶栓活性见表5。
表5结果表明装液量在40~60 mL时,所得发酵液均有一定纤溶作用,而装液量为70 mL时,发酵液无纤溶活性。因为装液量直接影响了发酵过程中溶氧量,装液量过少虽然溶氧量增加,但是从经济角度来考虑不利于生产效率提高;相反装液量过大,发酵液不能有效地充分转动混匀,溶氧量过低,影响了菌体生长繁殖和目标产物的生成。
2.2 溶栓活性评价
标准品尿激酶在16~128 IU/mL与溶栓圈面积大小具有较好线性关系,y=0.021 9 x+0.654 9(R2=0.937 1)(图1)。当鱿鱼墨发酵培养基中葡萄糖添加量为2.0%,枯草芽孢杆菌接种量为2.0%,100 mL锥形瓶中发酵培养基装液量为50 mL,摇床转速160 r/min,37℃发酵72 h后,测定鱿鱼墨枯草芽孢杆菌发酵液的溶栓圈直径最高可达1.5 cm(对应溶栓圈面积1.77 cm2),根据图1尿激酶纤维蛋白—琼脂糖平板标准曲线计算出该发酵液的溶栓活性与50.9 IU/mL尿激酶活力相当。
3 结论
枯草芽孢杆菌接种量、发酵时间、摇床转速、葡萄糖添加量和装液量影响鱿鱼墨枯草芽孢杆菌发酵液的溶栓性。在37℃发酵温度下,菌体接种量2.0%、发酵时间72 h、摇床转速160 r/min、鱿鱼墨培养基中葡萄糖添加量2.0%和100 mL锥形瓶装液量50 mL条件下,枯草芽孢杆菌发酵鱿鱼墨得到发酵液的溶栓活性与尿激酶活性相当。本研究为鱿鱼墨新型高值化应用提供一定依据,但枯草芽孢杆菌发酵鱿鱼墨制备溶栓因子的发酵条件优化、发酵液中溶栓活性物质分离鉴定还有待于进一步研究。
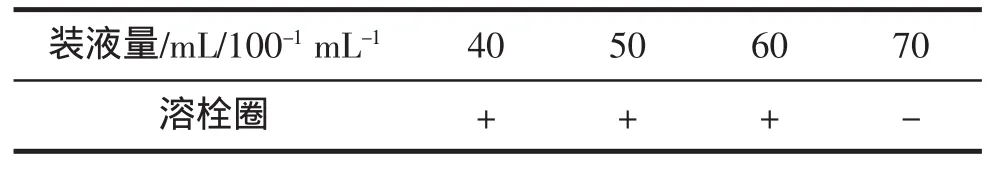
表5 装液量对鱿鱼墨发酵液的溶栓性影响Tab.5 Effect of fermenting volume on the fibrinolytic activity of squid ink fermentation
[1]李宝库.高活性纤溶酶产生菌的筛选及发酵条件优化研究[D].保定:河北大学,2005:16.
[2]薄金岭.纳豆激酶高产菌株的筛选及发酵条件的优化[J].大豆通报,2004(2):22-23.
[3]鲍时翔,田 艳,黄惠琴,等.纳豆菌液体发酵生产纳豆激酶的研究[J].药物生物技术,2002,9(6):322-325.
[4]SUMI H,HAMADA H,TSUSHIMA H,et al.A novel fibrinolytic enzyme(nattokinase)in the vegetable cheese Natto;a typical and popular soybean food in the Japanese diet[J].Cellular and Molecular Life Sciences,1987,43(10):1 110-1 111.
[5]PENG Y,HUANG Q,ZHANG R H,et al.Purification and characterization of a fibrinolytic enzyme produced by Bacillus amyloliquefaciens DC-4 screened from douchi,a traditional Chinese soybean food[J].Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology,2003,134(1):45-52.
[6]MINE Y,WONG A H K,JIANG B.Fibrinolytic enzymes in Asian traditional fermented foods[J].Food Research International,2005,38(3):243-250.
[7]WANG S L,WU Y Y,LIANG T W.Purification and biochemical characterization of a nattokinase by conversion of shrimp shell with Bacillus subtilis TKU007[J].New Biotechnology,2011,28(2):196-202.
[8]CHA W S,PARK S S,KIM S J,et al.Biochemical and enzymatic properties of a fibrinolytic enzyme from Pleurotus eryngii cultivated under solid-state conditions using corn cob[J].Bioresource Technology,2010,101(16):6 475-6 481.
[9]郑高利,张信岳,周彦钢,等.鱿鱼墨和乌贼墨部分成分及微量元素含量比较[J].中国海洋药物,2002,21(3):12-14.
[10]杨慧宁,张苓花,王运吉.海参液态发酵制备枯草杆菌蛋白酶的研究[J].水产科学,2006,25(11):559-562.
[11]DEEPAK V,KALISHWARALA K,RAMKUMARPANDIAN S,et al.Optimization of media composition for Nattokinase production by Bacillus subtilis using response surface methodology[J].Bioresource Technology,2008,99:8 170-8 174.
[12]卢珍华,倪 辉,蔡慧农.枯草芽孢杆菌培养液水解鱼蛋白质制备蛋白胨的初步研究[J].集美大学学报:自然科学版,2006,11(1):34-38.
[13]RAJAPAKSE N,MENDIS E,JUNG W K,et al.Purification of a radical scavenging peptide from fermented mussel sauce and its antioxidant properties[J].Food Research International,2005,38:75-82.
[14]WANG Y K,HE H L,CHEN X L,et al.Production of novel angiotensin I converting enzyme inhibitory peptides by fermentation of marine shrimp Acetes chinensis with Lactobacillus fermentum SM 605[J].Appl Microbiol Biotechnol,2008,79:785-791.
[15]WANG S L,LIN C L,LIANG T W,et al.Conversion of squid pen by Serratia ureilytica for the production of enzymes and antioxidants[J].Bioresour Technol,2009,100:316-323.
[16]WANG S L,CHEN H J,LIANG T W,et al.A novel nattokinase produced by Pseudomonas sp.TKU015 using shrimp shells as substrate[J].Process Biochemistry,2009,44:70-76.
[17]陈 洁,宋 茹.枯草芽孢杆菌发酵鱼蛋白制备抗氧化型发酵液工艺的初步研究[J].浙江海洋学院学院:自然科学版,2011,30(3):254-258.

