磁共振弥散成像活体检测rAd/p53治疗人类结肠癌荷瘤裸鼠早期疗效
谢 琦 ,张鼎旋 ,梁碧玲 ,陈明旺 ,张 静 ,吴延恒
(1.广州医学院附属广州市第一人民医院/广州市南沙中心医院医学影像科,广东 广州 510240;2.中山大学第二附属医院放射科,广东 广州 510120;3.广州医学院附属广州市第一人民医院,广东 广州 510180;4.暨南大学第一临床医学院影像科,广东 广州 510635)
rAd/p53治疗效果的活体评价目前局限于用影像方法观察肿瘤大小的改变[1-3]。而rAd/p53治疗的有效性最早体现在p53能进入肿瘤细胞内并成功转录、表达、引起肿瘤内部细胞凋亡、坏死[1-2],而肿瘤大小改变出现较晚。MR扩散加权成像(DWI)在判断肿瘤细胞的生物学特性与坏死方面具有很大潜力[4-8],本研究拟运用磁共振DWI观察rAd/p53治疗结肠癌荷瘤鼠的早期改变,探索DWI活体无创评价rAd/p53早期抗癌疗效的标记物。
1 材料和方法
1.1 动物模型制作
BALB/c裸鼠购自中山大学动物实验部,19~23 g体质量,鼠龄4~6周,雌雄不限,养殖于中山大学动物实验部SPF级实验室。人类结肠癌SW480细胞株(p53突变型)购自中国科学院上海细胞库。常规细胞培养,取对数生长期细胞制成浓度为1×107mL-1的细胞悬液。
将上述SW480细胞悬液分别注射至5只裸鼠胁部皮下(0.5mL/只)。15d后肿瘤生长至1.5~1.8cm,小鼠在麻醉状态下(4.5%水合氯醛2 mL/100 g腹腔注射)切取肿瘤块并切成约2 mm3小块作为移植瘤材,并种植于52只外表健康裸鼠皮下。
上述荷瘤鼠于种瘤后42 d,活体测量肿瘤大小并计算肿瘤体积(V=π/6×长×宽×高)[9],按肿瘤大小随机均匀分成2组:对照组,给予生理盐水;rAd/p53(深圳赛百诺生物科技公司)治疗组,1×107VIP的rAd/p53/mm3肿瘤,每组25只。给药途径为直接瘤内注射。
1.2 疗效检测
1.2.1 MR检查
上述荷瘤鼠治疗后分笼饲养,于假治疗或治疗后 24 h、48 h、72 h、120 h、168 h 各组分别随机取 5个肿瘤量荷瘤鼠,同上方法麻醉荷瘤鼠,用Philips Gyroscan Intera Achieva 1.5T Ivova Dual HP超导型MR成像仪、膝关节8通道相控阵线圈(Synkeen-8)行以下序列成像。
T2WI快速自旋回波(TSE):TR/TE=2600ms/100ms,SENSE加速因子=2,行轴位、冠状、矢状位成像,成像时间=65 s。采集矩阵=172×135,重建矩阵=224×224,层厚=2 mm,间隔=0,FOV=120 mm。
DWI[9]:采用单次激发平面回波成像序列(EPI),横轴位成像,TR=639~1 220 ms,TE=43~49 ms, 随 b值相应调整,按各向同性施加扩散敏感梯度场,b=800 s/mm2, 采集时间 28.5 s,FOV=120 mm,NAS=6,层厚 2 mm,间隔=0,采集矩阵=64×62,重建矩阵=96×96。
1.2.2 标本的实验检测
荷瘤鼠完成上述检查后,腹腔注射常规麻醉量5倍的水合氯醛处死,完整取出肿瘤,将肿瘤以成像轴位最大径线处对半切开,一半即冻于-30°C冰箱用于western blot,另一半用4%BPS缓冲福尔马林固定液固定,石蜡包埋,连续切片,TUNNEL法检测细胞凋亡(细胞凋亡原位检测试剂盒,南京凯基生物科技发展有限公司)。
2.2 两组患者出院后发生不良反应情况 对照组患者出院1个月后大便出血1例,牙龈出血1例;3个月后大便出血2例,皮肤黏膜出血2例,下肢血栓栓塞2例;6个月后大便出血2例,牙龈出血2例,胃出血1例;下肢血栓栓塞2例。实验组出院6个月后牙龈出血1例。两组患者出院3、6个月发生不良反应情况比较差异有统计学意义(P<0.05)。
western blot检测:从-30℃的冰冻组织提取细胞液,抗原抗体免疫反应的一抗为1∶2 000浓度免抗p53抗体(Santa Crag Bictech公司)或鼠抗β-actin抗体(Baster公司),二抗为1∶3 000浓度抗兔IgGHRP或1∶4 000浓度抗鼠IgG-HRP(Cell Signaling technology公司)。
1.3 结果判定
ADC值与EADC值的测量:DWI采集的数据用磁共振成像仪自带的分析软件拟合出ADC图和EADC图,在肿瘤最大切面利用感兴趣区(ROI)自动测量并计算出ADC值、EADC值。ROI在肿瘤中央区域覆盖高信号区(ADC图),或低等信号区(EADC图),测量肿瘤中央的ADC值与EADC值;在上述区域四周各取4个ROI,测量周围的ADC值和EADC值,取4个值的均值为肿瘤周边的ADC值与EADC值。ROI面积为8.7~69.5 mm2。
病理切片由两位有经验的病理科医师分别按同一标准在光学显微镜下阅片分析,取两者采集的均数值为病理检测结果。TUNNEL检测阳性细胞为细胞核呈棕黄色。在100倍视野下观察并估算切片内TUNNEL染色阳性细胞与形态为死亡细胞的肿瘤细胞面积的百分比为肿瘤凋亡范围。
western blot p53蛋白表达图像分析:最终胶体的显影结果经扫描仪扫入电脑以JPG格式保存,用Imagepro-plus 6.0版自动图像分析系统处理自动计算每组样本每个条带光密度(IOD)。
1.4 统计学处理
所得数据输入SPSS 13.0软件中建立数据库计算分析,整体样本检验采用秩和检验,两两比较采用Wilcoxon检验,相关性分析采用spearman相关检验,将P<0.05设为差异有统计学意义。
2 结果
rAd/p53治疗后24 h即可见肿瘤中央出现ADC图上的高信号、EADC上为低信号区域或相应区域范围扩大(图1)。
2.1 肿瘤ADC值与EADC值改变
2.1.1 肿瘤中部
EADC值:rAd/p53治疗后不同时间点,肿瘤中部的EADC值较对照组降低。各时间点W统计量与P值依时间递增分别为:15,0.008;15,0.008;15,0.008;15,0.008;15,0.008(图3)。
2.1.2 肿瘤边缘
ADC值:rAd/p53治疗后不同时间点,肿瘤边缘部的ADC值多较对照组增加。各时间点W统计量与P值依时间递增分别为:10,0.008;27,1.000;15,0.008;15,0.008;15,0.008(图4)。
EADC值rAd/p53治疗后不同时间点,肿瘤边缘的EADC值较对照组降低。各时间点W统计量与P值依时间递增分别为20,0.151;15,0.008;15,0.008;15,0.008;15,0.008(图 5)。
2.2 实验评价
2.2.1 TUNNEL

图1 单纯rAd/p53治疗后肿瘤在T2WI、ADC图、EADC图的改变。对照组(图1a),治疗后24 h(图1b)。Figure 1.Tumor on T2WI,ADC and EADC images.Control group(Figure 1a).24 h after rAd/p53 adminstration(Figure 1b).

图2 rAd/p53治疗后不同时间点肿瘤中部ADC值变化图。Figure 2. ADC value in the center of tumor after rAd/p53 injection.

图3 rAd/p53治疗后不同时间点肿瘤中部EADC值变化图。Figure 3. EADC value in the center of tumor after rAd/p53 injection.

图4 rAd/p53治疗后不同时间点肿瘤边缘ADC值变化图。Figure 4. ADC value at the periphery of tumor after rAd/p53 injection.
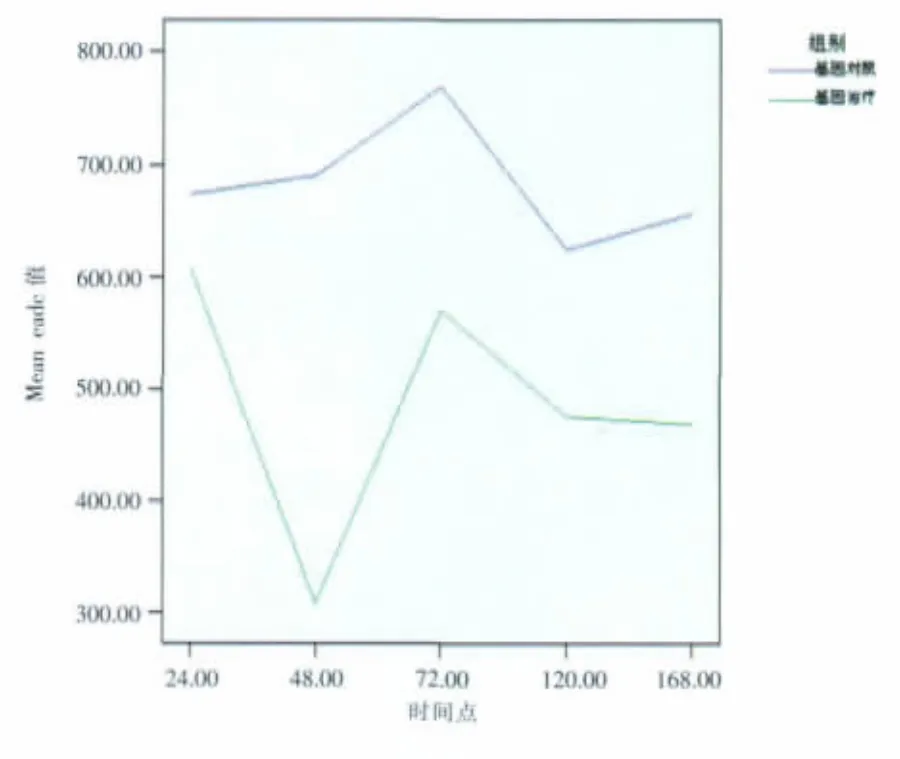
图5 rAd/p53治疗后不同时间点肿瘤边缘EADC值变化图。Figure 5. EADC value at the periphery of tumor after rAd/p53 injection.
rAd/p53治疗后不同时间点,肿瘤内细胞凋亡较对照组增加,见表1(Wilcoxon 检验,P≤0.016)。
2.2.2 p53 表达(western blot)结果见表2,图6。
p53蛋白表达:rAd/p53治疗24 h可见增加,120 h达峰值;基因+碘油治疗,24 h即增加,48 h达峰值,治疗后不同时间点,肿瘤p53蛋白表达较对照组增加(Wilcoxon 检验,P≤0.016)。
表1 不同配伍治疗肿瘤细胞凋亡(TUNNEL)情况的比较()
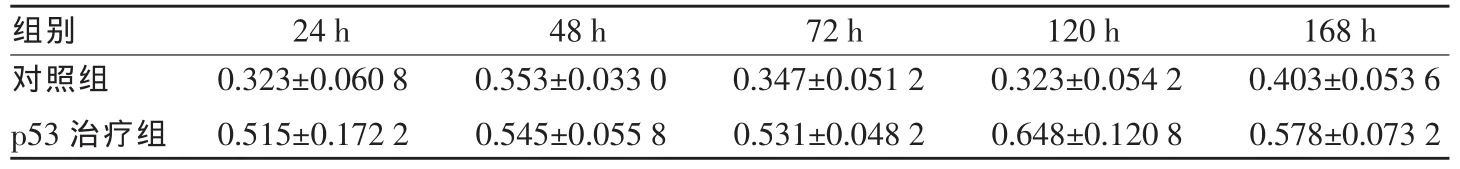
表1 不同配伍治疗肿瘤细胞凋亡(TUNNEL)情况的比较()
组别 24 h 48 h 72 h 120 h 168 h对照组 0.323±0.060 8 0.353±0.033 0 0.347±0.051 2 0.323±0.054 2 0.403±0.053 6 p53 治疗组 0.515±0.172 2 0.545±0.055 8 0.531±0.048 2 0.648±0.120 8 0.578±0.073 2
表2 不同配伍治疗肿瘤治疗组与对照组p53表达光密度情况的比较()

表2 不同配伍治疗肿瘤治疗组与对照组p53表达光密度情况的比较()
组别 24 h 48 h 72 h 120 h 168 h对照组 192.38±73.79 192.38±73.79 192.38±73.79 192.38±73.79 192.38±73.79 p53 治疗组 404.86±133.86 396.99±159.84 1 262.12±218.95 1 283.35±194.23 991.77±108.17

图6 rAd/p53与对照组在不同时间点肿瘤细胞p53表达western blot检测。图6a分别为对照组,治疗 24 h,48 h,72 h,120 h 和 168 h。图6b 为 β-actin。Figure 6.Western blot analysis of p53 expression of tumor at different time point after rAd/p53 injection.
2.3 不同评价方法的相关性分析(spearman相关分析)
p53表达光密度与肿瘤凋亡范围呈明显正相关(γ、P:0.667 8,0.000 0)。ADC 值与肿瘤细胞凋亡范围呈正相关(γ、P:0.205 3,0.000 0), 与肿瘤 p53 表达光密度呈正相关(γ、P:0.2038,0.0000)。EADC 值与肿瘤细胞凋亡范围呈负相关(γ、P:-0.3184,0.0000),与肿瘤 p53表达光密度呈负相关(γ、P:-0.328 0,0.0000)。
3 讨论
p53已作为替换突变与失活的肿瘤抑制基因以达到治疗肿瘤目的的经典候选基因。在p53治疗肿瘤的实验与临床研究可见,有效的治疗可出现外源性野生型p53蛋白的高表达,促进肿瘤细胞滞于G1期,通过多条生物途径引起肿瘤细胞凋亡增加[1-2,10-11]。因此,p53蛋白是外源性野生型p53治疗肿瘤的早期抗癌效果的分子标志物。本研究结果也显示,rAd/p53治疗结肠癌荷瘤裸鼠,肿瘤细胞的凋亡与p53蛋白的表达呈正相关。
但p53要发挥调节细胞周期、促进肿瘤凋亡的作用,需要其下游有完整的信号转导通路,凋亡前基因bax等的功能正常并被激活[12]。有研究表明,对带bax突变的LS174T结肠癌细胞株在p53过表达的情况下,肿瘤细胞凋亡仍受抑制[13]。可见,与其它抗癌药物一样,rAd/p53的抗癌作用也存在肿瘤细胞“耐药”现象。因此,在分子水平及时活体评价p53对肿瘤细胞抗癌效果非常重要。
一般公认DWI是以水分子弥散特点为基础的成像技术,活体的DWI上,组织水分子的扩散系数值受到许多因素的影响,如体液的流动、细胞的渗透性和温度、毛细血管灌注、细胞内外水的黏滞度、比例、膜通透性的方向等[14],因此,DWI能反映组织的生物学特点,可提供组织生物物理特性的信息,如细胞的组织结构、微结构和微循环[15]。在实际工作中常用表观扩散系数(ADC)值来代替真正的扩散系数,指数ADC即EADC用于显示组织的弥散权重效果。如肿瘤细胞膜完整,细胞密实,弥散受限,弥散相对较慢,弥散曲线衰减较慢,ADC值较低[14];肿瘤细胞坏死,细胞膜不完整,细胞稀疏,细胞间间隙扩大,弥散曲线衰减迅速,ADC值大,在高b值的DWI图像上组织信号降低[14-15]。所以,高b值的DW-MRI能更敏感显示肿瘤组织的组织病理特征[9,14-15]。
在临床与临床前期的研究结果提示DWI可作为反映治疗效果的可靠指针[4-8]。对C26结肠癌荷瘤鼠模型经阿霉素化疗或氨基酮戊酸基的光动力治疗,前者在治疗后24~48 h、后者在治疗后6~24 h肿瘤的弥散指数有意义增加[4]。对大鼠皮下横纹肌肉瘤移植模型给予血管靶性治疗药(Combretastatin)的研究[5],用药后1 h和6 h,ADC值降低,组织病理显示肿瘤血管充血或闭塞,无肿瘤坏死,2 d后ADC升高,组织学检查见肿瘤进行性坏死,9 d后ADC值降低与肿瘤再生有关,认为测量ADC值可能区分无灌注而又存活的细胞与无存活的坏死肿瘤组织。在对人类胶质瘤荷瘤鼠模型经5-FU联合TRAIL/APO2L治疗后2 d、3 d可见肿瘤ADC值有意义增加,并与肿瘤细胞的凋亡增加相关[6]。人类胶质瘤荷瘤鼠模型肿瘤内注射化疗药BCNU后24 h可见ADC值有意义增加,并与随后的肿瘤缩小有相关性[7]。临床研究提示[8],对于结肠癌肝转移瘤的患者全程化疗后3周行DWI,对化疗有效的病灶ADC值有意义的增加。上述的一系列研究结果表明DWI可在肿瘤大小发生改变前,及时监测抗癌药对肿瘤细胞的疗效,在早期评价抗癌药物对肿瘤细胞的抗癌效果是一很有潜力的工具。
关于rAd/p53治疗肿瘤疗效评价的实验与临床研究,均采用观察肿瘤大小改变、组织病理改变与临床观察[1-3],目前未见rAd/p53治疗肿瘤后用DWI评价其疗效的实验与临床研究。本研究结果可见,治疗后5个观察时间点可见肿瘤中央与边缘的ADC值大多增加,EADC值降低。ADC值与TUNNEL及western blot提示的肿瘤凋亡增加,p53表达增加呈正相关,EADC值呈负相关。肿瘤中央坏死区域ADC值高于周边区域,EADC值低于周边区域,但治疗组周边区域ADC值较对照组明显升高,EADC值明显降低,组织病理可见完整肿瘤细胞,提示rAd/p53可能通过渗透至周边区域,引起肿瘤细胞膜内外水分子扩散改变。
总之,DWI的ADC图、EADC图及相应的ADC值和EADC值可在治疗后24 h即可出现有统计意义的改变,可作为单纯rAd/p53或联合化疗治疗肿瘤早期疗效活体评价的生物标记物。
[1]Roth JA.Adenovirus p53 gene therapy[J].Expert Opin Biol Ther,2006,6(1):55-61.
[2]Guan YS,La Z,Yang L,et al.p53 gene in treatment of hepatic carcinoma:status quo[J].World J Gastroenterol,2007,13(7):985-992.
[3]Sze DY,Freeman SM,Slonim SM,et al.Becker Young Investigator Award:Intraarterial Adenovirus for metastatic gastrointestinal cancer:activity,Radiographic response,and survical[J].J Vasc Interv Radiol,2003,14(3):279-290.
[4]Roth Y,Tichler T,Kostenich G,et al.High-b-value diffusionweighted MR imaging for pretreatment prediction and early monitoring of tumor response to therapy in mice[J].Radiology,2004,232(3):685-692.
[5]Thoeny HC,Keyzer FD,Chen F,et al.Diffusion-weighted MR Imaging in Monitoring the Effect of a Vascular Targeting Agent on Rhabdomyosarcoma in Rats[J].Radiology,2005,234(3):756-764.
[6]Lee KC,Hamstra DA,Bhojani MS,et al.Noninvasive Molecular Imaging Sheds Light on the Synergy between 5-Fluorouracil and TRAIL/Apo2L for Cancer Therapy[J].Clin Cancer Res,2007,13(6):1839-1846.
[7]Hall DE,Moffat BA,Stojanovska J,et al.Therapeutic efficacy of DTI-015 using diffusion magnetic resonance imaging as an early surrogate marker[J].Clin Cancer Res,2004,10(23):7852-7859.
[8]Koh DM,Scurr E,Collins D,et al.Predicting response of colorectal hepatic metastasis:value of pretreatment apparent diffusion coefficients[J].AJR,2007,188(4):1001-1008.
[9]谢琦,梁碧玲,张静,等.临床医用1.5T MR成像仪对人类结肠癌裸鼠移植瘤模型的DWI研究[J].中国医学影像技术,2009,25(增刊):15-18.
[10]Yazlovitskaya EM,DeHaan RD,Persons DL.Prolonged wildtype p53 protein accumulation and cisplatin resistance[J].Biochem Biophys Res Commun,2001,283(4):732-737.
[11]Yu ZW,Zhao P,Liu M,et al.Reversal of 5-flouroucial resistance by adenovirus-mediated transfer of wild-type p53 gene in multidrug-resistant human colon carcinoma LoVo/5-FU cells[J].World J Gastroenterol,2004,10(13):1979-1983.
[12]Miyashita T,Reed JC.Tumor suppressor p53 is a direct transcriptional activator of the human bax gene[J].Cell,1995,80(2):293-299.
[13]Tamm I,Schumacher A,Karawajew L,et al.Adenovirus-mediated gene transfer of P16INK/CDKN2 into bax-negative colon cancer cells induces apoptosis and tumor regression in vivo[J].Cancer Gene Ther,2002,9(8):641-650.
[14]Lyng H,Haraldseth O,Rofstad EK,et al.Measurement of cell density and necrotic fraction in human melanoma xenografts by diffusion weighted magnetic resonance imaging[J].Magn Reson Med,2000,43(6):828-836.
[15]Ichikawa T,Erturk SM,Motosugi U,et al.High-B-value diffusion-weighted MRI in colorectal cancer[J].AJR,2006,187(1):181-184.

