胆汁内外引流术对梗阻性黄疸大鼠肺肿瘤坏死因子α、中性粒细胞弹性蛋白酶的影响
王小鹏,吴 亮,李 闻
中国人民解放军总医院消化科,北京 100853
梗阻性黄疸是临床常见的多发的症状或体征,引起肝脏损害的同时常伴心肺功能不全、急性肾功能衰竭等全身重要脏器功能受损,其围手术期感染并发症发生率和病死率均较高。梗阻性黄疸可导致全身炎症反应综合征(SIRS)甚至多器官功能衰竭综合征(MODS),而肺是SIRS常见的首发脏器损害,因此,梗阻性黄疸可以引起肺损伤;肺损伤可能与梗阻性黄疸时引起的内毒素血症及由其引发的细胞因子分泌失调密切相关。但迄今为止,术前解除黄疸在外科手术中的作用尚有争议,胆汁内引流与外引流,哪种引流方法更好,目前尚无一致性意见[1-2]。本研究探讨大鼠梗阻性黄疸形成及其解除对肺组织肿瘤坏死因子α(TNF-α)、中性粒细胞弹性蛋白酶(NE)的影响,比较胆汁内、外引流术解除黄疸对肺部炎症反应的作用,为临床上梗阻性黄疸患者的术前治疗提供理论依据。
1 材料与方法
1.1 材料 成年雄性Sprague-Dawley(SD)大鼠64只(体质量330~380 g),购于军事医学科学院实验动物中心。分笼单独饲养,常规饲料喂养,自由进食与饮水,维持环境温度在15~20℃。
1.2 方法
1.2.1 动物模型的建立与分组:将大鼠随机分为四组:假手术组(SH)、梗阻性黄疸组(OJ)、胆汁内引流术组(ID)及胆汁外引流术组(ED),每组16只。SH组:大鼠开腹分离胆总管,但不结扎,14 d后行二次手术分离胆管但不引流,再饲养14 d后取标本。OJ组:大鼠开腹分离胆总管并结扎、切断,建立大鼠梗阻性黄疸模型,梗阻性黄疸14 d后取标本。ID组:OJ模型建成14 d后再次手术,于胆管末端和十二指肠间植入内引流管,内引流14 d后取标本。ED组:OJ模型建成14 d后再次手术,从胆管末端插入外引流管,经皮下引至颈背部体外并固定,外引流14 d后取标本。
1.2.2 标本留取:标本采集日,在腹腔注射2.5%戊巴比妥钠(60 mg/kg)麻醉大鼠后,开胸,留取左肺叶。在预冷的生理盐水中漂洗、除去血液,无菌纱布拭干、称重,将左肺组织剪碎后倒入玻璃匀浆管中,冰浴研磨,并用生理盐水制成10%匀浆液;低温离心(3000 r/min)10 min,留取肺匀浆清液标本,密封保存在-80℃低温冰箱中。
1.2.3 肺匀浆液TNF-α浓度测定:通过双抗体夹心酶联免疫吸附法(ELISA)检测,严格按照说明书操作,大鼠TNF-α ELISA试剂盒购自美国R&B公司。
1.2.4 肺匀浆液NE活性测定:通过比色法测定肺组织匀浆液 NE活性:Methoxysucciny1-alany1-proly1-valine-P-nitroanilide(MEOSAAPVNA)是NE的一种特异性的合成荧光底物。用已知浓度的大鼠纯化中性粒细胞弹性蛋白酶(Sigma公司)为标准品绘制标准曲线。根据标准曲线计算样品的NE活性。在96孔板中每孔加入0.1 mL底液[0.2 mmol/L的MEOSAAPVNA(购于 Sigma 公司)、0.1 mmol/L HEPES、0.5 mmol/L NaCl、0.1%Brij、2%二甲基亚砜,pH 值为 7.5],用分光光度计在405 nm测定基础吸光值(OD1值)。然后加入0.08 mL肺匀浆液,盖上铝箔,25℃孵育2 h,在405 nm测定OD2值。用已知浓度的大鼠纯化中性粒细胞弹性蛋白酶(购于Sigma公司)为标准品绘制标准曲线,根据标准曲线计算样品的NE活性。
1.3 统计学处理 采用SPSS 17.0软件进行统计学处理。肺组织匀浆液TNF-α、NE含量均用均数±标准差()描述,多组间比较采用单因素方差分析(oneway ANOVA),P<0.05为差异有统计学意义。
2 结果
2.1 一般形态观察 结扎大鼠胆管14 d后,梗阻性黄疸形成,大鼠食欲下降,全身皮毛发黄,尿黄,部分大鼠呼吸稍急促,死亡大鼠鼻腔可见淡红色血性分泌物,麻醉解剖时凝血功能较差,肝脏外胆管膨胀,肝脏弥漫性肿大,呈黄色,质硬,呈砂粒感。行胆汁外引流术后,可见大量胆汁通过引流管排出体外,大鼠进食及活动减少,皮肤变薄,体质量减轻或不变,死亡率高于其他各组,死亡大鼠鼻腔可见淡红色血性分泌物。而胆汁内引流组大鼠食欲良好,活动正常,体质量明显增加,肝脏色泽恢复正常,质柔软,无死亡。假手术组无异常、无死亡。
2.2 肺组织匀浆液TNF-α、NE含量的变化 梗阻性黄疸时大鼠肺TNF-α、NE水平较假手术对照组明显升高(P<0.01或0.05)。通过胆汁内引流术解除黄疸后,大鼠肺TNF-α浓度与梗阻性黄疸组相比下降明显(P<0.01),但未降至与假手术对照组同一水平(P<0.05);而通过胆汁外引流术解除黄疸后,大鼠肺TNF-α浓度仍较高、与梗阻性黄疸组相比无差异(P>0.05)。行胆汁内、外引流术后,大鼠肺NE水平均有不同程度降低,但与梗阻性黄疸组相比内引流更明显(P<0.05),外引流无差异(P >0.05),且内引流恢复至正常水平,与假手术对照组相比无差异(P>0.05,见表1)。
表1 各组大鼠肺匀浆液TNF-α、NE含量的变化()Tab 1 TNF-α and NE levels of lung in four groups rats()
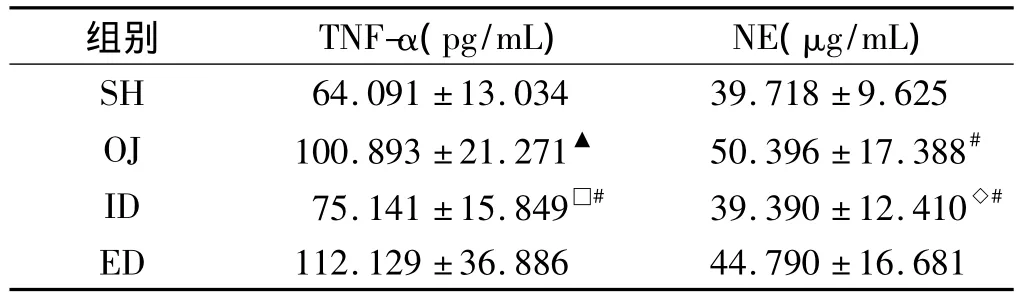
表1 各组大鼠肺匀浆液TNF-α、NE含量的变化()Tab 1 TNF-α and NE levels of lung in four groups rats()
注:与SH 相比,▲P<0.01,#P<0.05;与 OJ相比,□P<0.01,◇P <0.05
组别 TNF-α(pg/mL) NE(μg/mL)SH 64.091 ±13.034 39.718 ±9.625 OJ 100.893 ±21.271▲ 50.396 ±17.388#ID 75.141 ±15.849□# 39.390 ±12.410◇#ED 112.129 ±36.886 44.790 ±16.681
3 讨论
在我们的研究中,我们采用改良的手术方式成功建立了梗阻性黄疸及胆汁内外引流的动物模型[3]。在建立模型的预实验过程中,我们发现:体质量低于300 g的大鼠梗黄难以持续2周时间,死亡率偏高,83.3%(10/12)梗阻性黄疸大鼠死于第10~11 d左右,解剖死因多为胆漏,死亡时体质量下降(70±12.6)g,考虑与梗阻性黄疸进食减少、体质量下降、营养状况恶化引起低蛋白血症、胆总管壁弹性下降、破漏有关;体质量>330 g的大鼠多可成功造模梗阻性黄疸持续2周,死亡率仅为11.1%(7/63),解剖死因有胆漏、胃肠胀气、肺淤血等。胆汁内引流组只要二次手术成功,术后均能存活,且进食增多、体质量上升明显;胆汁外引流组二次术后多在8~10 d死亡,死亡时体质量均<220 g,解剖死因有胃肠黏膜萎缩、腹腔感染、肺淤血等,死亡率高达51.5%(17/33)。
肠道是体内最大的细菌和毒素库,很多动物实验[4-5]证实梗阻性黄疸大鼠肠道细菌可移位至肺。Sewnath等[6]指出梗阻性黄疸可通过释放炎症因子而导致肺部过度炎症反应,从而引起肺损伤。国外研究指出梗阻性黄疸后,细菌移位至肺,产生大量TNF-α,从而引起肺损伤;但关于梗阻性黄疸解除后对肺损伤的影响无相关报道。因此,本研究探讨了梗阻性黄疸形成后,肺损伤的变化,阐明了胆汁内引流术与外引流术对梗阻性黄疸大鼠肺损伤的影响,加深理解了胆汁内引流术优于外引流术的机制,为临床治疗梗阻性黄疸患者提供了实验依据。
TNF-α是一种单核因子,主要由单核细胞和巨噬细胞产生,内毒素是其较强的刺激剂。Kennedy等[7]实验发现,无菌鼠阻塞性黄疸发生时无内毒素血症,内源性TNF-α的分泌也并不增多;而一般鼠阻塞性黄疸发生时内毒素水平明显升高,同时内源性TNF-α的分泌也明显增多。TNF-α是重要的炎症介质,在感染和损伤引起的炎症和免疫反应过程中起着重要的作用,是细菌感染的重要指标,其水平的变化与病情变化的程度相关。Beierle等[8]提示梗阻性黄疸后各种炎症刺激可活化巨噬细胞产生TNF-α,当数量过多或者作用时间过长,可导致ARDS甚至MODS。TNF-α在梗阻性黄疸时引起的肝功能损伤中起重要的促进作用,也是引起心、肺、肾、胃肠等损害的重要介质,梗阻性黄疸患者很容易进展为多器官衰竭而死亡。大量动物实验[9-10]及临床资料[11-12]表明,梗阻性黄疸时,尽管细胞免疫功能受抑制,在内毒素的作用下,血清TNF-α炎性细胞因子显著升高。这与我们的实验结果提示梗阻性黄疸时大鼠肺TNF-α水平较假手术对照组明显升高(P <0.01)是一致的。我们以前的研究[13]表明,解除胆道梗阻可以降低血浆TNF水平,并且内引流优于外引流。Kimmings等[14]也报道胆管炎患者TNF浓度明显升高,引流后降低。我们的实验结果提示通过胆汁内引流术解除黄疸后,大鼠肺TNF-α浓度与梗阻性黄疸组相比下降明显(P<0.01),而通过胆汁外引流术解除黄疸后,大鼠肺TNF-α浓度仍较高,甚至超过梗阻性黄疸组平均水平,但与梗阻性黄疸组相比无差异(P>0.05)。我们的研究从另一个方面梗阻性黄疸对肺TNF-α的影响,进一步验证了胆汁内引流术优于外引流术。
很多研究表明中性粒细胞弹性蛋白酶在肺损伤的发病机制中起重要作用[15-16]。梗阻性黄疸形成明显的内毒素血症,刺激肺脏释放大量前炎症因子,如TNF-α、IL-6等,募集大量中性粒细胞入肺,释放弹性蛋白酶,分解弹性蛋白(气血屏障细胞外基质的主要成分),破坏上皮细胞紧密连接,增加血管通透性,造成大量血浆蛋白及活性物质渗透至肺间质,造成非心源性肺水肿,从而引起肺损伤。我们的研究首次探讨了梗阻性黄疸时及内外引流术对肺NE的影响,实验显示梗阻性黄疸时大鼠肺NE水平较假手术对照组明显升高(P<0.05),胆汁内、外引流术均可不同程度降低梗阻性黄疸时大鼠肺NE的水平,但与假手术对照组相比内引流可降至正常水平(P>0.05);胆汁外引流术虽然也可以降低大鼠肺NE水平,但作用小于内引流术。
我们推测两种引流方法影响的差异与肠肝循环有关。胆汁内引流术能够恢复肠肝循环,使胆汁排泄正常。胆汁有助于提高肠黏膜T2淋巴细胞数量,抑制肠内细菌的过度繁殖和内毒素的产生,维持肠黏膜屏障的完整,并能与内毒素结合和/或将其分解为亚单位而灭活,从而减少了梗阻性黄疸时细菌移位的发生,减轻内毒素血症,同时恢复紊乱的炎性细胞因子分泌,降低肺组织的炎症反应;另外,胆汁有消化食物、吸收营养作用,使大鼠营养状况良好,体质量增加。相反,胆汁外引流时,虽然缓解了梗阻性黄疸,但不能建立胆盐正常的肝肠循环,大量胆汁通过外引流管丢失,导致脂肪吸收不良和一些免疫物质的丢失及水电解质紊乱[17-18]。我们从胆汁内外引流术对梗阻性黄疸大鼠肺肿瘤坏死因子α、中性粒细胞弹性蛋白酶影响的实验观察中,进一步支持胆汁内引流术解除梗阻性黄疸优于外引流术。
[1]Sewnath ME,Karsten TM,Prins MH,et al.A meta-analysis on the efficacy of preoperative biliary drainage for tumors causing obstructive jaundice[J].Ann Surg,2002,236(1):17-27.
[2]Tomazic A,Pleskovic A.Surgical outcome after pancreatoduodenectomy:effect of preoperative biliary drainage[J].Hepatogastroenterology,2006,53(72):944-946.
[3]Li W,Chung SC.An improved rat model of obstructive jaundice and its reversal by internal and external drainage[J].J Surg Res,2001,101(1):4-15.
[4]Sileri P,Morini S,Sica GS,et al.Bacterial translocation and intestinal morphological findings in jaundiced rats[J].Dig Dis Sci,2002,47(4):929-934.
[5]White JS,Hoper M,Parks RW,et al.Patterns of bacterial translocation in experimental biliary obstruction[J].J Surg Res,2006,132(1):80-84.
[6]Sewnath ME,van der Poll T,van Noorden CJ,et al.Cholestatic interleukin-6-deficient mice succumb to endotoxin-induced liver injury and pulmonary inflammation[J].Am J Respir Crit Care Med,2004,169(3):413-420.
[7]Kennedy JA,Clements WD,Kirk SJ,et al.Characterization of the Kupffer cell response to exogenous endotoxin in a rodent model of obstructive jaundice[J].Br J Surg,1999,86(5):628-633.
[8]Beierle EA,Vauthey JN,Moldawer LL,et al.Hepatic tumor necrosis factor-alpha production and distant organ dysfunction in a murine model of obstructive jaundice[J].Am J Surg,1996,171(1):202-206.
[9]Yorganci K,Baykal A,Kologlu M,et al.Endotoxin challenge causes a proinflammatory state in obstructive jaundice [J].J Invest Surg,2004,17(3):119-126.
[10]Kerek M,Akyurek N,Sozuer EM,et al.Effects of recombinant platelet activating factor acetylhydrolase in obstructive jaundice[J].Hepatogastroenterology,2003,50(52):1097-1100.
[11]Hideaki M,Youinori M,Michttaka O,et al.Obstructive jaundice increases sensitivity to lipopolysaccharide via TLR4 upregulation:possible involvement in gut-derived hepatocyte growth factor-protection of hepatocytes [J]. J GastroenterolHepatol,2005,20(12):1859-1866.
[12]Kimmings AN,van Deventer SJ,Obertop H,et al.Endotoxin,cytokines,and endotoxin binding proteins in obstructive jaundice and after preoperative biliary drainage[J].Gut,2000,46(5):725-731.
[13]Meng Y,Gong YC,Dou Y,et al.Changes of serum cytokines and expression of inducible nitric oxide synthase mRNA by Kupffer cells after relief from obstructive jaundice in rats[J].J Gastroenterol Hepatol,2009,24(6):1064-1069.
[14]Kimmings AN,van Deventer SJ,Rauws EAJ,et al.Systemic inflammatory response in acute cholangitis and after subsequent treatment[J].Eur J Surg,2000,166(9):700-705.
[15]Zeiher BG,Matsuoka S,Kawabata K,et al.Neutrophil elastase and acute lung injury:prospects for sivelestat and other neutrophil elastase inhibitors as therapeutics[J].Crit Care Med,2002,30(5):281-287.
[16]Tamakuma S,Ogawa M,Aikawa N,et al.Relationship between neutrophil elastase and acute lung injury in humans[J].Pulm Pharmacol Ther,2004,17(5):271-279.
[17]Sano T,Ajiki T,Takeyama Y,et al.Internal biliary drainage improves decreased number of gut mucosal T lymphocytes and MadCAM-1 expression in jaundiced rats [J].Surgery,2004,136(3):693-699.
[18]Hou SL,Qiao ZY,Kang JS,et al.Influence of drainage by stent and surgery on immunity function in patients with obstructive jaundice[J].Chin J Dig Endosc,2005,22(1):46-47.侯森林,乔占英,康建省,等.支架与手术引流对梗阻性黄疸患者免疫功能的影响[J].中华消化内镜杂志,2005,22(1):46-47.

