红细胞贮存时间对脂多糖诱导的中性粒细胞炎症释放的影响
张莎娜 王海平 曹 惠 王全立
1.解放军总医院输血科,北京 100853;2.军事医学科学院附属医院输血科,北京 100071
血液及血液成分在储存过程中会发生损伤,红细胞自身的生化功能及形态也会发生改变。红细胞悬液中的白细胞和血小板会自发的释放许多生物活性物质,多数活性分子会随着贮存时间的延长而浓度升高。白细胞易崩解并释放各种细胞因子(白介素等)。已有临床报道,血液的贮存损伤会对心脏手术患者和创伤患者带来不良的临床效应[1],但由于发生原因复杂、临床表现不明确,目前相关的临床报道仍存在争议。细菌脂多糖(lipopolysaccharide,LPS)是引起急性肺损伤(acute lung injury,ALI)和急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)的重要因素[2]。中性粒细胞(polymorphonuclear,PMN)是机体内重要的炎症反应细胞[3],为数量最多的白细胞。细菌LPS可以刺激PMN产生多种炎症介质,但对其确切的内在机制了解甚少,为了解大量库存红细胞的输注对受者输血免疫功能的影响,本研究采用体外实验的方法,在LPS的诱导下,观察随红细胞保存时间的延长,对受者PMN炎症释放的作用。现总结报道如下:1材料与方法
1.1 试剂
LPS购自Sigma公司(试剂批号:L2880),中性粒细胞分离液购自天津市川页生化制品有限公司,IL-6和TNF-α试剂盒均购自北京欣博盛生物科技有限公司。
1.2 悬浮红细胞上清的制备
将制备好的悬浮红细胞于4℃保存,分别于1、21、35 d(D1、D21、D35)无菌条件下取出 30 mL,1 500 r/min 离心 20 min得到上清,再将上清12 500 r/min离心5 min,去除细胞后分装于-20℃冻存待集中测定。
1.3 全血中性粒细胞的分离、培养及分组
取9份健康献血者的全血,3 500 r/min离心15 min,得到富含白细胞的层面35~40 mL,分2~3次缓慢地等量加入到15 mL中性粒细胞分离液上,2 000 r/min离心25 min,吸取富含白细胞的中间层,再加入5倍体积以上的PBS,1 200 r/min离心10 min去除血小板;加入含 NH4Cl、NaHCO3溶血素2mL,37℃溶血 30min,溶解残存的红细胞;再加入少量的PBS,1 500 r/min离心10 min,去上清,余下的则为中性粒细胞;PBS洗涤2次,加入RPMI-1640培养液悬浮细胞。经Wright-Giemsa染色鉴定其纯度>95%[4],然后进行台盼兰排斥法证实其存活率>98%。将细胞悬液浓度调整到2×106/mL,将红细胞悬液分为60份,分别进行测定。
24孔细胞培养板中每孔加入1.5 mL细胞悬液,细胞完全培养基由RPMI-1640、10%小牛血清、1%青链霉素组成(购自上海微科生化试剂有限公司)。本实验分为对照组和实验组,均各设一个空白对照,不加红细胞上清,只加完全培养基,其余分别加入含20%D1、D21、D35的红细胞上清的细胞完全培养基。对照组(30份):未加LPS组,培养24 h后收集细胞培养上清;实验组(30 份):先培养 12 h 加入 1.5 μL、100 μg/mL的LPS,再培养12 h收集细胞培养上清。将细胞培养板置于CO2细胞培养箱(37℃、湿度100%、体积分数5%CO2)中孵育。
1.4 细胞因子检测
收集细胞培养上清,12 500 r/min离心5 min,去除细胞,细胞培养上清中IL-6及TNF-α浓度采用酶联免疫吸附试验(ELISA)检测,按产品使用说明书进行。
1.5 统计学方法
采用SAS 9.0统计学软件进行数据分析,计量资料数据用均数±标准差(±s)表示,两组间比较采用 t检验;以 P<0.05为差异有统计学意义。
2 结果
2.1 红细胞上清细胞因子的表达情况
在各时间点收集的未加PMN的红细胞上清中,均未检测到IL-6和TNF-α。
2.2 两组红细胞上清中IL-6水平比较
在LPS的诱导下,D35、D21红细胞上清中IL-6水平高于D1红细胞上清(P<0.05),其浓度随红细胞上清保存时间的延长而增加。与空白对照组比较,差异均有统计学意义(P<0.05)。对照组D1、D21、D35红细胞上清中的IL-6水平高于空白对照,差异有统计学意义(P<0.05)。实验组,D1、D21、D35的 IL-6水平分别比空白对照增长(1.32±0.05)、(1.65±0.08)、(2.14±0.13)倍。 D1、D21、D35 之间差异有统计学意义(P<0.05)。实验组D1、D21、D35红细胞上清中IL-6水平与对照比较,差异有统计学意义(P<0.05)。见表1。
表1 两组红细胞上清中IL-6水平比较(±s,ng/L)
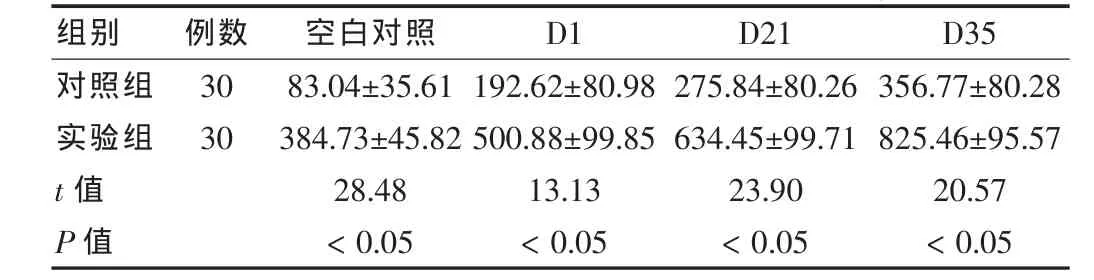
表1 两组红细胞上清中IL-6水平比较(±s,ng/L)
组别 例数 空白对照 D1 D21 D35对照组实验组30 30 t值 P值83.04±35.61 384.73±45.82 28.48<0.05 192.62±80.98 500.88±99.85 13.13<0.05 275.84±80.26 634.45±99.71 23.90<0.05 356.77±80.28 825.46±95.57 20.57<0.05
2.3 两组红细胞上清中TNF-α水平比较
LPS诱导下,D35、D21的红细胞上清中TNF-α水平高于D1红细胞上清,但差异无统计学意义(P>0.05)。实验组D1、D21、D35红细胞上清中TNF-α水平与对照比较,差异无统计学意义(P>0.05)。见表2。
3 讨论
目前全世界都面临血液资源日益紧张的境况,对于延长血液保存时间、提高血液保存质量的需求更为迫切。输血相关的免疫变化可能是红细胞、白细胞、血小板等储存过程中所产生的可溶性物质所引起的。LPS是革兰阴性细菌细胞壁中的一种成分,是强有力的免疫炎症系统活化因子,可引起机体炎症反应,导致致死性感染性休克,病死率极高。本文参照文献[5],按照LPS的剂量效应关系结果,选择LPS的终浓度为 100 μg/mL。 参照输血体外实验“双重打击”(two-hit)的模型[6],采用LPS诱导,模拟临床严重创伤后患者的炎症反应。严重创伤患者在其救治过程中需要大量输血,这对患者的免疫功能影响很大。因此,培养PMN过程中加入20%上清,相当于50 kg体重的临床患者输注12~15U的悬浮红细胞。现有研究表明,输血相关的免疫反应可能与血液保存过程中产生的细胞因子有关。炎症细胞因子(IL-1、IL-6、IL-8和TNF-α)主要由外周的免疫细胞(包括中性粒细胞、单核细胞、淋巴细胞、巨噬细胞)产生,通常介入免疫及炎症反应[7],TNF-α能刺激巨噬细胞产生IL-1间接刺激体温中枢。本实验所检测的细胞因子均为参与炎症反应的重要的介质。TNF-α可促进炎症反应,引起白细胞与毛细血管内皮细胞的黏附,黏附的中性粒细胞被激活可促发损伤级联反应,导致水肿、炎症反应和缺血缺氧的恶性循环[8]。IL-6是炎症和急性期反应重要的细胞因子,其升高的水平与多器官功能衰竭风险增高有关。同时,IL-6和TNF-α共同作用上调免疫应答,是促进炎症反应、引起败血症的重要介质[9]。这两个细胞因子的变化可以间接解释输血引起的炎症反应。
表2 两组红细胞上清中TNF-α水平比较(±s,μmol/L)
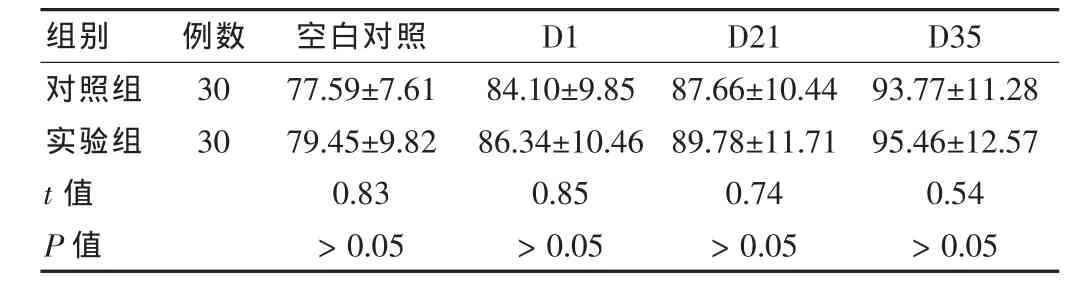
表2 两组红细胞上清中TNF-α水平比较(±s,μmol/L)
组别 例数 空白对照 D1 D21 D35对照组实验组t值P值30 30 77.59±7.61 79.45±9.82 0.83>0.05 84.10±9.85 86.34±10.46 0.85>0.05 87.66±10.44 89.78±11.71 0.74>0.05 93.77±11.28 95.46±12.57 0.54>0.05
本实验结果显示,在LPS的诱导下,D35较D1红细胞上清促使PMN释放更多的TNF-α和IL-6,可以解释为库存血的输注增强了PMN的炎症反应,这与Baumgartner等[5]的实验结果相类似。临床救治时,同时大量输注的血液保存时间并不相同,这可能是造成救助效果不明显的原因之一,这种临床效应很多时候被临床医生忽视,或归因于疾病的并发症。提示在未来的实验中还应进行相关的基础支持研究,努力明确输血相关的副作用,提高临床输血安全。
[1]Silliman CC,Boshkov LK,Mehdizadehkashi Z,et al.Transfusion-related acute lung injury:epidemiology and a prospective analysis of etiologic factor[J].Blood,2003,101(2):454-462.
[2]Motzkus D,Schulz MS,Heitland A.The novel beta defensin DEFB 123 prevents lipopolysaccharide mediated effects in vitro and vivo[J].FASEB J,2006,20(10):1701.
[3]Sarah F,Andrew E,Leitch,et al.Neutrophil Apoptosis:Relevance to the Innate Immune Response and Inflammatory Disease [J].Innate Immun,2010,2(1):216-227.
[4]Mesri M,Altieri DC.Endothelial cell activation by leukocyte microparticles[J].Immunol,1998,161(2):4328-4337.
[5]Bumgartner JM,Nydam TL,Clarke JH,et al.Red Blood Cell Supernatant Potentiates LPS-Induced Proinflammatory Cytokine Response From Peripheral Blood Mononuclear Cells [J].Journal of Interferon&Cytokine Research,2009,29(6):333-338.
[6]Vlaar APJ,Hofstra JJ,Levi M,et al.Supernatant of aged erythrocytes causes lung inflammation and coagulopathy in a “Two-Hit” in vivo syngeneic transfusion model[J].Anesthesiology,2010,113(1):92-103.
[7]Mintz PD.Febrile reactions to platelet transfusion [J].Patho,1991,95(4):609.
[8]Gonzalez R,Glaser J,Liu MT,et al.Reducing inflammation decreases secondary degeneration and functional deficit after spinal cord injury[J].Exp Neurol,2003,184(1):456-463.
[9]Jean-Baptiste E.Cellular mechanisms in sepsis [J].J Intensive Care Med,2007,22(3):63-72.

