鼠伤寒沙门氏菌鞭毛蛋白FliC的原核表达及纯化
王鹤 ,梁宏儒 ,胡旭 ,赵达 ,姜东君 ,尹辉 ,高佳滨 ,陈为宏 ,崔玉东 ,朱战波
(1.黑龙江八一农垦大学动物科技学院,大庆163319;2.黑龙江八一农垦大学生命科学技术学院)
佐剂在增强抗原免疫原性方面起到了重要作用。天然免疫系统的最新研究成果表明Toll-like receptor(TLR)的配体可以作为佐剂[1-3]。细菌的鞭毛赋予了细菌的运动性,以及对宿主黏膜组织的粘附性,而鞭毛蛋白作为细菌鞭毛的主要组成蛋白是TLR5 配体[4],可通过与TLR5 的结合,引起前炎症反应[5]。很多的研究都证实了鞭毛蛋白可以用于新型疫苗的研发,像在鼠疫耶尔森菌[6]、西尼罗病毒[7]、恶性疟原虫[8]、破伤风内毒素[9]以及禽流感[10-11]新型疫苗中,鞭毛蛋白都起到了有效的佐剂作用。
实验拟通过大肠杆菌原核表达系统表达鼠伤寒沙门氏菌鞭毛蛋白,并对其免疫原性进行鉴定,为后期研究其在奶牛乳房炎新型疫苗中的佐剂作用奠定工作基础。
1 材料与方法
1.1 菌株及质粒
鼠伤寒沙门氏菌(Salmonella typhimurium)8014株(购于农业微生物菌种保藏中心);大肠杆菌DH5α、XL1-Blue、原核表达载体pQE-30 质粒均由黑龙江八一农垦大学预防兽医学实验室保存。
1.2 主要试剂
Tryptone、Yerst Extract、Agarose 为 OXOID 公司产品;dNTPs、Taq DNA Ploymerase、限制性内切酶BamHⅠ、SphⅠ及T4 DNA Ligase、蛋白质Marker 均为 Fermentas(MBI)公司产品;DNA Marker、DNA 凝胶回收试剂盒、质粒小提试剂盒购于北京康为世纪生物科技有限公司;脱脂奶粉、PEG8000、TEMED、Tween-20 均为Sigma-Aldrich 公司产品;其他化学试剂为国产分析纯。小鼠抗鼠伤寒沙门氏菌全菌体多抗血清由黑龙江八一农垦大学预防兽医学实验室自制。
1.3 引物设计及合成
根 据GenBank 上S.typhimurium 基因序列(GenBank Accession No.1070204),设计一对PCR 引物F1 和R1,上游引物位于基因的1~21 位,下游引物位于1 466~1 485 位反向互补。并在上、下游引物5′末端分别引入BamHⅠ和SphⅠ限制性酶切位点,两端加保护性碱基。PCR 扩增产物大小为1 485 bp,引物送上海生工生物工程技术服务有限公司进行合成。
1.4 PCR 扩增目的基因
以鼠伤寒沙门氏菌8014 株基因组DNA 为模板扩增fliC 基因片段,反应条件为94℃5 min;94℃40 s,59℃ 30 s,72 ℃ 1 min 循环 30 次;72℃延伸10 min。产物用PCR 产物纯化试剂盒按说明书操作回收目的基因。
1.5 fliC 基因的克隆及测序
回收的PCR 产物与pMD18-T 载体,于16℃连接过夜。取连接产物10 μL 转化感受态E.coli DH5α菌株(TSS 法制备),涂布于含氨苄青霉素 100 μg ·mL-1的LB 琼脂平板上,于37℃培养过夜。挑取数个转化菌单菌落,于含100 μg ·mL-1 氨苄青霉素的2 mL LB液体培养基中37℃培养12 h,用质粒提取试剂盒提取质粒,以BamHⅠ、SphⅠ双酶切及PCR 扩增鉴定质粒。鉴定正确的质粒进行双酶切后纯化回收目的片段,并与双酶切后的表达载体pQE30(+)连接,将连接产物转化感受态XL1-Blue,用氨苄青霉素抗性进行筛选,并经PCR 和BamHⅠ、SphⅠ双酶切鉴定,选PCR 和双酶切结果与预期相符的质粒送生工测序。
1.6 fliC 基因的原核表达及可溶性鉴定
将XL1-Blue(FliC-pQE30)接种于含氨苄青霉素(200 μg ·mL-1)的 LB 液体培养基,取培养后的新鲜菌液,1%接种量扩大培养,培养至OD600 为0.4~0.5,加入终浓度为1.0 mmoL ·L-1IPTG 进行诱导表达。诱导后菌体经裂解后离心,取沉淀和上清。将诱导产物、诱导产物裂解沉淀和上清进行SDS-PAGE,采集图像,经Bandscan 软件分析重组蛋白FliC 的表达量。以空载体转化菌XL1-Blue(pQE30)的诱导表达产物作为对照。
1.7 表达产物的提取及纯化
将诱导表达的重组菌XL1-Blue(FliC-pQE30)培养物离心后收集沉淀。无菌PBS 洗涤3 次,用盐酸胍溶解液重悬,在冰浴条件下超声裂解,于4℃以10 000 r ·min-1 离心15 min,收集上清,采用镍柱亲和层析试剂盒进行纯化。纯化后的蛋白于4℃透析24 h,期间不断地更换PBS 透析液,透析后的蛋白,用PEG8000 进行浓缩。
1.8 表达产物的Western blot 分析
将诱导表达的XL1-Blue(FliC-pQE30)经SDSPAGE 电泳后,将蛋白转印到PVDF 膜上,用含10%脱脂奶粉的PBST 4℃作用12 h;PBST 洗涤3 次后,以实验室自制的小鼠抗鼠伤寒沙门氏菌全菌体多抗血清作为一抗(1∶200 稀释)作用1 h,充分洗涤后以HRP 标记的羊抗鼠IgG 作为二抗(1∶400 稀释)作用1 h,PBST 洗涤3 次后,DAB 显色,蒸馏水终止反应,观察结果,拍照记录。
2 结果
2.1 fliC 基因的PCR 扩增结果及TA 克隆结果
(1)1%琼脂糖凝胶电泳分析显示,FliC 基因PCR扩增产物可见1 485 bp 的特异性条带,大小均与预期相符,如图1 所示。

图1 FliC 的PCR 产物的电泳分析Fig.1 Agarose gel electrophoresis of the PCR product of fliC
(2)将纯化的FliC 基因片段克隆到pMD18-T 载体上,转化后选取疑似阳性质粒为模板,对重组克隆FliC-pMD18-T 进行PCR 鉴定,结果在1 485 bp 处扩增出一条与目的片段大小相符的基因片段;将PCR 鉴定为阳性的fliC-pMD18-T 质粒用BamHⅠ和SphⅠ双酶切鉴定,产物用1%的琼脂糖凝胶电泳,出现两条两个目的基因片段,大小分别为2 662 bp 和1 485 bp,与预期的结果相符。结果如图2 所示:

图2 FliC-pMD18-T 克隆载体重组质粒的酶切鉴定和PCR 鉴定Fig.2 Identification of FliC-pMD18-T plasmid by nucleate endonuclease digestion and by PCR
2.2 重组表达质粒的鉴定
琼脂糖凝胶电泳分析显示,重组表达质粒FliC-pQE30 经BamHⅠ和SphⅠ双酶切可见约3 458 bp载体片段和1 458 bp 的目的基因片段,经PCR 扩增可见1 485 bp 的特异性条带,见图3。测序结果显示,与预期的基因序列完全一致。

图3 FliC-pQE30 表达载体重组质粒的酶切鉴定和PCR 鉴定Fig.3 Identification of FliC-pQE30 plasmid by nucleate endonuclease digestion and by PCR
2.3 表达产物的鉴定
2.3.1 SDS-PAGE 分析:检测结果显示,XL1-Blue(FliC-pQE30)的诱导表达产物可见相对分子质量约56 kDa 的目的蛋白条带,经Bandscan 软件分析,重组蛋白的表达量为菌体总蛋白的27%。重组融合蛋白以可融合和包涵体两种形式表达,但主要以包涵体形式存在。经镍柱亲和层析纯化后,获得单一条带的目的蛋白。
2.3.2 Western blot 分析:结果显示,将已纯化的FliC蛋白,以一定比例稀释的小鼠抗鼠伤寒沙门氏菌全菌体多抗血清(1∶200 稀释)为一抗,HRP 标羊抗鼠IgG(1∶400 稀释)为二抗,对重组蛋白进行免疫原性分析,如图5 所示,FliC 蛋白能与小鼠抗鼠伤寒沙门氏菌全菌体多抗血清发生特异性反应,在相对分子质量约为56 kDa 处可见明显条带,与预期结果相一致。
3 讨论
长期以来,细菌的鞭毛仅被认为是细菌的运动器官,最近研究表明,鞭毛蛋白作为细菌鞭毛的主要成分,是一种很强的致炎因子[12]。鞭毛蛋白是沙门氏菌的主要抗原成分之一,该分子上既存在该菌血清分型的H 抗原,又具有属特异的共同抗原[13]。

图4 重组FliC 蛋白表达及纯化的SDS-PAGE 电泳结果Fig.4 SDS-PAGE results of recombinant FliC protein and purified protein
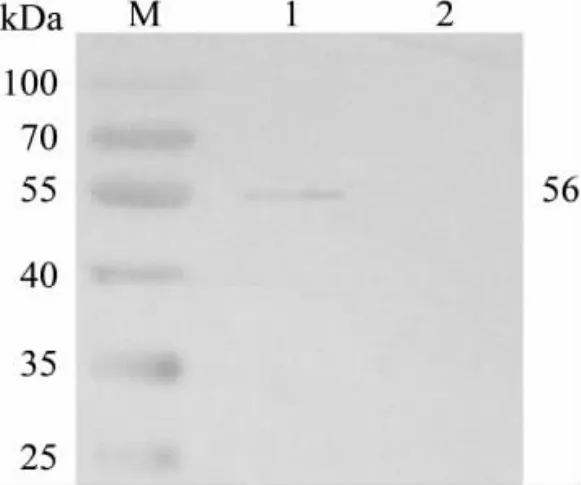
图5 重组蛋白FliC 的全菌血清Western Blotting 结果Fig.5 Western blotting results of the recombinant FliC protein
研究以pQE30 为表达载体在大肠杆菌XL1-Blue 中表达克隆基因FliC。在试验中,构建的重组原核表达质粒FliC-pQE30 在大肠杆菌XL1-Blue 中表达鞭毛重组基因,成功获得鞭毛融合蛋白。pQE30 表达载体采用N 端6 个组氨酸(his)标签。高效表达产物的N 端具备6 个his,便于采用镍柱亲和层析纯化目标蛋白。以融合表达形式获得目的蛋白的方法被越来越多的科研人员所采用[14],研究所选择的pQE30表达体系正是属于融合表达系统,这为我们大量获取鞭毛蛋白提供了良好的保障。带异丙基-β-D-硫代半乳糖苷(IPTG)诱导启动子的质粒表达外源蛋白的总量可以达到全菌蛋白的30%以上。为了获得外源基因在原核细胞中的高效表达,需增加表达质粒的拷贝数量、提高外源基因的转录、翻译水平及防止表达的蛋白质或多肽降解,为此我们用IPTG 诱导表达FliC 融合蛋白,其优越性在于:通过诱导表达,使细菌的生长与外源基因的表达分开,合理地调节好宿主细胞的代谢负荷与外源基因高效表达的关系,从而提高Flic 的表达水平。为了尽可能多的表达我们所需的目的蛋白,我们诱导表达时间进行了选择优化,最终确定的最佳表达条件是加入的IPTG 浓度为1 mM、37℃诱导表达5 h。张晶等人[15]通过构建了gapC-pQE30 质粒,转入大肠杆菌 M15(pREP4),IPTG 诱导后,表达出GapC 蛋白,与研究结果相一致。通过这些优化措施获得了FliC 蛋白的高效表达,经超声破碎,离心获得的上清过镍柱做亲和纯化,收集目的蛋白,PBS 透析,PEG8000 浓缩后,最后经SDS-PAGE 分析发现所得目的蛋白的纯化程度理想。Western Blotting 试验中纯化的重组蛋白FliC 可以与小鼠抗鼠伤寒沙门氏菌全菌体血清相结合,出现单一的目的条带,结果表明构建的该重组蛋白具有天然蛋白的活性。
试验通过克隆鼠伤寒沙门氏菌鞭毛蛋白FliC 全基因并测序列鉴定,构建了fliC-pQE30 原核表达载体,并让其在大肠杆菌XL1-Blue 中大量表达,经镍柱纯化后得到了理想的目的蛋白;从FliC 基因全序列中可以看到其与已经报道的序列高度同源,同源性可达100%,Western Blotting 试验中纯化的重组蛋白FliC 可以与小鼠抗鼠伤寒沙门氏菌全菌体血清相结合,出现单一的目的条带,结果表明构建的该重组蛋白具有天然蛋白的活性,可以用来进行下一步的实验研究。
[1] Pulendran B.Modulating vaccine responses with dendritic cells and Toll-like receptors[J].Immunol Rev,2004,199:227-250.
[2] Coffman RL,Sher A,Seder RA.Vaccine adjuvants:putting innate immunity to work[J].Immunity,2010,33(4):492-503.
[3] Leroux-Roels G.Unmet needs in modern vaccinology:adjuvants to improve the immune response[J].Vaccine,2010,28(Suppl.3):C25-C36.
[4] Reichhart JM.TLR5 takes aim at bacterial propeller[J].Nat Immunol,2003(4):1159-1160.
[5] Murthy KG,Deb A,Goonesekera S,et al.Identification of conserved domains in Salmonella muenchen flagellin that are essential for its ability to activate TLR5 and to induce an inflammatory response in vitro[J].Biol Chem,2004,279(7):5667—5675.
[6] Honko AN,Sriranganathan N,Lees CJ,et al.Flagellin is an effectiveadjuvantforimmunization againstlethal respiratory challenge with Yersinia pestis[J].Infect.Immun,2006,74:1113-1120.
[7] McDonald WF,Huleatt JW,Foellmer HG,et al.A West Nile virus recombinant protein vaccine that coactivates innate and adaptive immunity [J].Infect Dis,2007,195:1607-1617.
[8] Bargieri DY,Rosa DS,Braga CJ,et al.New malaria vaccine candidatesbased on the Plasmodium vivax Merozoite Surface Protein-1 and the TLR-5 agonist Salmonella Typhimurium FliC flagellin [J].Vaccine,2008,26:6132-6142.
[9] Lee SE,Kim SY,Jeong BC,et al.A bacterial flagellin,Vibrio vulnificus FlaB,has a strong mucosal adjuvant activity to induce protective immunity [J].Infect Immun,2006,74:694-702.
[10] Ben-Yedidia T,Arnon R.Epitope-based vaccine against influenza[J].Expert Rev Vaccines,2007(6):939-948.
[11] Adar Y,Singer Y,Levi R,et al.A universal epitopebased influenza vaccine and its efficacy against H5N1[J].Vaccine,2009,27:2099-2107.
[12] Ramphal R,Balloy V,Jyot J,et al.Control of Pseudomonas aeruginosa in the Lung Requires the Recognition of Either Lipopolysaccharide or Flagellin[J].Immunology,2008,181(1):586-592.
[13] 焦新安,杨静,王志亮,等.沙门氏菌属鞭毛蛋白共同抗原表位的初步定位[J].中华微生物与免疫学杂志,1993,13(6):351-353.
[14] MakridesSC.Strategiesforachieving high-level expression of genes in Escherichia coli[J].Microbiol Rev,1996,60(3):512-538.
[15] 张晶,朱洪伟,崔玉东.金黄色葡萄球菌GapC 基因的克隆和表达[J].黑龙江八一农垦大学学报,2008,20(3):50-53.

