猪蓝耳病和传染性胸膜肺炎混合感染的病例报告
靳明武,张洋龙,孙晓雨,邵光喜,倪宏波
(1.黑龙江农垦总局九三管理局畜牧兽医局,嫩江161441;2.黑龙江八一农垦大学动物科技学院)
近年来,随着养殖规模的不断扩大,养殖数量不断增多,动物疫病尤其是传染病日趋复杂,病谱逐渐扩大,猪病多以病原的混合感染或继发感染为主要的流行形式。猪群发病往往不是由单一病原所致,而是以两种或两种以上的病原体相互协同作用所造成的。这样常常导致猪群的高发病率和高死亡率,危害极其严重,而且控制难度大[1]。混合感染包括病毒的混合感染、细菌的混合感染以及病毒与细菌的混合重感染。在病毒的混合感染中,以猪繁殖与呼吸综合征病毒、猪环状病毒2型、猪瘟病毒、猪流感病毒以及伪狂犬病病毒之间的混合感染较为常见,特别是猪繁殖与呼吸综合征病毒与环状病毒2型的双重感染最为严重,由此造成猪群的双重免疫抑制,抵抗力下降[2-3]。细菌的混合感染主要涉及猪肺炎支原体、副猪嗜血杆菌、传染性胸膜肺炎放线杆菌,猪多杀性巴氏杆菌、大肠杆菌、沙门氏菌、猪链球菌、附红细胞体等。另外病原的继发感染在规模化猪场中也十分普遍,特别是在猪群存在原发感染(如猪繁殖与呼吸综合征病毒、猪环状病毒2型、猪肺炎支原体)情况下,一旦应激因素和饲养管理不良,就很容易发生细菌性继发感染[4-5]。
猪繁殖与呼吸综合征(Porcine reproductive and respiratory syndrome,PRRS)是猪群发生以繁殖障碍和呼吸系统症状为特征的一种急性、高度传染的病毒性传染病。在发病过程中会出现短暂性的两耳皮肤紫绀,故又称为蓝耳病。主要感染途径为呼吸道,空气传播、接触传播、精液传播和垂直传播为主要的传播方式,病猪、带毒猪和患病母猪所产的仔猪以及被污染的环境、用具都是重要的传染源。此病在仔猪中传播比在成猪中传播更容易。本病主要采取综合防制措施及对症疗法[6]。
猪放线杆菌是一种条件性致病菌,常存在于健康猪的扁桃体和上呼吸道,因此,对本病的预防应加强猪群的饲养管理,饲喂高营养的全价料,搞好猪舍的卫生消毒,防止皮肤、黏膜受损,局部损伤后及时处理与治疗[7]。
最近两年实验室通过对临床送检病料进行实验室诊断,结果显示目前猪场的混合感染比较严重且很普遍,试验是对山东某猪场送检病料进行实验室诊断,现将结果报告如下:
1 材料与方法
1.1 材料
1.1.1 病料
山东地区某猪场送检的一例病死仔猪,无菌采集其肺、淋巴结等组织。
1.1.2 试剂
Marker DL 2000购自大连宝生物工程有限公司,TIANamp Genomic DNA Kit DNA提取盒购自TIANGEN公司,PCR Master Mix缓冲液,RNeasy Plus Mini Handbook RNA提取盒购自QIAGEN公司,RevertAid First Strand cDNA Synthesis Kit反转录盒购自MBI公司。其余试剂均为国产分析纯。
1.1.3 引物设计
根据GenBank中已发表的:猪支原体P46基因序列;猪巴氏杆菌16SrRNA基因序列;猪链球菌cps2J基因序列、副猪嗜血杆菌16SrRNA基因序列、胸膜肺炎放线杆菌omlA基因序列;猪繁殖与呼吸系统综合征病毒美洲型ATCC VR-2332参考毒株序列;猪瘟病毒Alfort株的基因序列;圆环病毒2型的全基因序列中的ORF1序列等基因序列设计特异引物。猪支原体F5′`CCAGGATGCACAAAATAACTG3′,`R5′`ACCCGAAGAACTTCAACAGC3′,目的片段大小为795 bp,`猪巴氏杆菌:F5′-AGGGCACGCAGGCGG ACTTTTA-3′,R5′-ATCGACAGCGTTTACAGCGTGG A-3′,目的片段大小为253 bp;猪链球菌:F5′-GATAGATGACGGTTCTTCAGATT-3′,R5′-TCCTCTC CTAACCACTGTTCAG-3′,目的片段大小为450 bp;副猪嗜血杆菌F5′-GTGATGAGGAAGGGTGGTGT-3′,R5′-GGCTTCGTCACCCTCTCTGT-3′,目的片段大小为822 bp;胸膜肺炎放线杆菌F5′-AAGGTTGATA TGTCCGCACC-3′,R5′-CACCGATTACGCCTTGCCA-3′,目的片段大小为450 bp;蓝耳F5′-GCAAGCAGC AAAAGAAAAAGAAGG-3′,R5′-GCGTCGGCAAACT AAACTCCACAG-3′,目的片段大小为309 bp;圆环病毒F5′-GAGTCTGGTGACCGTTGC-3′,R5′-TTCC TCCGTGGATTGTTC-3′,目的片段大小为493 bp;猪瘟病毒F5′-GCTCCTGGTTGGTAACCTCGG-3′,R5′-TGATGCTGTCACACAGGTGAA-3′,目的片段大小为507 bp;引物由上海生工生物工程技术服务有限公司合成。
1.2 方法
1.2.1 细菌分离鉴定
1.2.1.1 细菌分离纯化及培养特性观察
分别无菌剪取一小块深部组织脏器,分别接种涂抹于血琼脂培养基上,分别做需氧和厌氧培养,置37℃恒温箱中24 h,观察菌落形态和溶血情况等。挑取疑似菌的单个菌落进行纯培养,划线于血琼脂培养基,37℃恒温箱中需氧培养24 h。然后将分离得到的细菌接种到不同的固体培养基上观察其生长特性。
1.2.1.2 革兰氏染色
利用革兰氏染色技术在油镜下观察细菌的形态及颜色,紫色的是革兰氏阳性菌,红色的是革兰氏阴性菌。
1.2.1.3 生化实验鉴定
纯化 株接种常规糖类培养基,M.R、V-P、靛基质、脲酶、氧化酶、接触酶、枸橼酸盐等生化实验。
1.2.1.4 细菌DNA粗提取
挑取单个菌落悬浮于含100μL超纯水的1.5 mL离心管中,震荡混匀,煮沸10min后置于冰上冷却2min,12 000 r·min-1离心2 min,取上清液作为PCR反应的粗制DNA模板,置-20℃保存备用。
1.2.2 病毒鉴定
1.2.2.1 组织DNA提取:按照TIANamp Genomic DNA Kit DNA提取盒(购自TIANGEN公司)上面的步骤说明进行操作。
1.2.2.2 组织RNA提取:按照RNeasy Plus Mini Handbook RNA提取盒(购自QIAGEN公司)上面的步骤说明进行操作。
1.2.2.3 RNA反转录:按照RevertAid First Strand cDNA Synthesis Kit反转录盒(购自MBI公司)上面的步骤说明进行操作。
1.2.3 PCR扩增
以实验室分离得到的DNA和cDNA为模板,猪巴氏杆菌、猪链球菌、副猪嗜血杆菌、胸膜肺炎放线杆菌、猪瘟病毒、蓝耳病毒、圆环病毒等的特异性引物为引物进行PCR反应扩增,扩增体系如下:PCR Master Mix12.5μL,上游引物1μL,下游引物1μL,模板DNA1μL,加去离子水补至25μL。PCR反应程序:95℃预变性5min,94℃变性30 s,退火30 s(巴氏杆菌56.5℃,猪链球菌54℃,副猪嗜血杆菌60℃,胸膜肺炎放线杆菌60℃,猪繁殖与呼吸系统综合征病毒57℃,圆环病毒52℃,猪瘟病毒60℃),72℃延伸30 s,30个循环,最后72℃终延伸10 min。
1.2.4 PCR产物检测
取5μL扩增产物加入点样孔,以165 V电压进行1%琼脂糖凝胶(含1%溴化乙锭2μL)电泳。电泳液用1×TAE缓冲液。25 min后在紫外灯下观察扩增结果,并一次成像拍照。
2 结果与分析
2.1 临床症状
临床表现患病仔猪群表现呼吸困难、肌肉震颤、共济失调、打喷嚏,有的仔猪耳部发紫和身体末端皮肤发绀。发病猪体温升高,喘气时有时伴有震颤或呈划水样。
2.2 病理学诊断
主要病理变化为弥漫性间质性肺炎,并伴有卡他性肺炎。腹膜、肾周围脂肪、肠系膜淋巴结、皮下脂肪和肌肉等部位发生水肿,可见胸膜炎、心包炎。
2.3 实验室诊断
2.3.1 培养特性
从病料中分离得到一种细菌,对其进行培养特性鉴定。分离菌在绵羊鲜血琼脂平板、巧克力琼脂平板上生长良好,在普通琼脂平板生长缓慢,在麦康凯琼脂平板、伊红美蓝琼脂平板上不生长,判定本菌严格需要V因子。绵羊鲜血琼脂平板上10%CO237℃培养24 h形成细小、圆形、透明的黏稠菌落,直径约1mm,可见β溶血环。
2.3.2 革兰氏染色
用病料中所分离的细菌进行革兰氏染色、涂片、镜检。可见其为两极染色的杆菌。
2.3.3 生化试验
纯化菌株发酵葡萄糖、麦芽糖、蔗糖、乳糖、果糖产酸,不发酵甘露醇、山梨醇、鼠李糖及甘露糖。M.R、V-P和靛基质试验均为阴性,不产生H2S。氧化酶、接触酶、脲酶、枸檬酸盐试验阳性。
2.3.4 PCR
2.3.4.1 细菌PCR
对纯培养的细菌做菌落PCR,分别选用放线杆菌、巴氏杆菌、副猪嗜血杆菌、支原体和链球菌的特异性引物,对细菌进行PCR鉴定。对PCR结果经琼脂糖凝胶电泳分析。结果发现,在加样孔1的450 bp左右处看到一条清晰的特异条带,与放线杆菌的引物目的片段大小相一致(如图1)。
2.3.4.2 病毒PCR
以组织中提取的病毒DNA以及病毒RNA反转录的cDNA为模板,分别选用圆环病毒、蓝耳病毒和猪瘟病毒的特异性引物,对病毒进行PCR鉴定。PCR结果经琼脂糖凝胶电泳分析。结果发现,在加样孔2的约300 bp处看到清晰条带,与蓝耳病毒的引物目的片段大小相一致(如图2)。
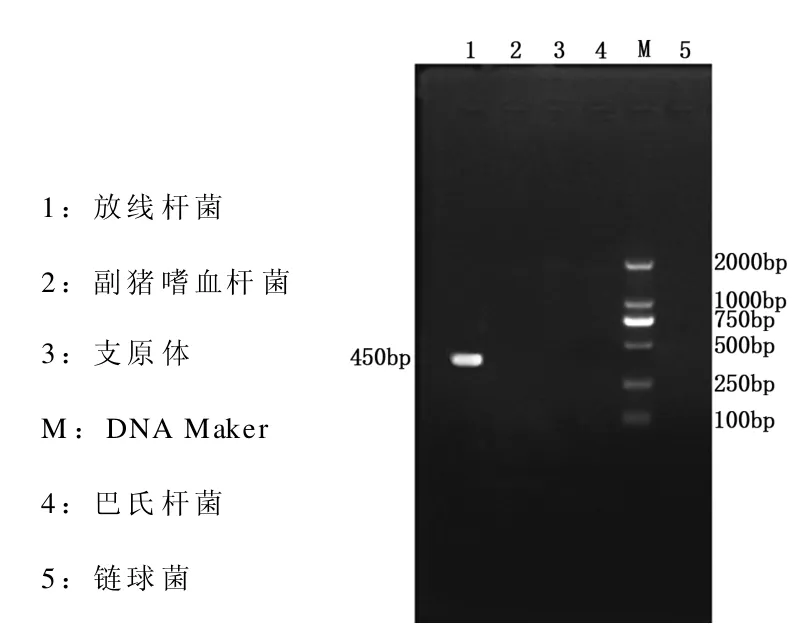
图1 细菌PCR结果Fig.1 The results of bacterial PCR

图2 病毒PCR结果Fig.2 The results of Virus PCR
3 讨论
通过对该猪场的病料进行细菌的分离与纯化,发现该病猪至少感染了一种细菌,并对该菌进行培养特性观察、革兰氏染色镜检、生化试验以及PCR检测,结果表明它的各种特性均与放线杆菌相符,且PCR产物大小也与其引物目的片段大小一致。因此确定该种菌为放线杆菌。本实验还对该送检病料进行了病毒的检测,发现其感染有蓝耳病毒。再结合其临床症状、病理变化可以确诊该病料为蓝耳病毒和放线杆菌混合感染。
近年来随着养殖规模的不断扩大,养殖数量不断增多,动物疫病尤其是传染病日趋复杂,病谱逐渐扩大,形成多种疾病并存的混合感染。尤其是春季来临之际,由于气温回升变暖,各种病菌将会大量繁殖,而同时经历冬季,猪的体质有所下降,抗病能力减弱,如果在饲养管理过程中不加注意,将会引起疫病的发生,造成不良后果,直接影响经济效益。因此,疾病的预防尤为重要[8-9]。
首先,应该加强饲养管理制度,保持猪舍温暖、干燥、通风、清洁,经常对猪圈消毒,消除病菌的生存环境。春季气温变化大,仔猪体温调节功能还不成熟,抗寒、抗病能力差。因此要保持猪舍温暖、干燥、通风,以适宜猪的生长。根据春季猪的生长需求,要对使用的猪舍进行必要的维修,做到防雨、防风、防潮。创造良好的环境条件是保证仔猪健康快速成长的基础。要保持猪舍环境卫生,定期对猪舍进行彻底消毒[10]。
其次,春季病菌活跃,疫病易发。因此要严格按照免疫程序要求,按时、按质做好猪的免疫注射工作。一旦发现疫情,要严格按规定封锁、消毒、强化预防注射,按规定处理好病死猪体。如果周边有疫情发生,在做好防疫的同时还应及时搞好猪舍的消毒。生产区严格控制车辆进入,严格禁止外人进入,对外出车辆和人员进场要严格消毒。在对本场猪群进行强化免疫的同时,要供给猪群提供高营养的饲料。按猪的不同生长阶段,科学配制饲料,保证营养充足,特别是保证维生素的供给[11]。可在饲料中加入胡萝卜等多汁饲料和啤酒糟、饼类饲料,以改善猪饲料的口感,增加猪的食欲,增强猪的体质,提高抵抗力。
最后,做好平时药物预防工作。对于季节性多发病进行针对性药物预防。对已经生病的猪群,应尽快查明病因,找出传染源和传播途径,借助实验室诊断和药物实验,找出主要病原和敏感药物,鉴别好不同的呼吸道疾病,分清混合感染和单一感染,确保做到对症下药,对已经查明病因的根据检查结果将它分为病猪、可疑病猪、假定健康猪,分别进行隔离,已确定病原的可采取紧急免疫接种[12]。
[1]王永辉.规模化猪场管理中存在的问题及建议[J].今日畜牧兽医,2011(4):11-12.
[2]左玉柱,曹洪战,范京惠.当前猪病流行特点及防控措施[J].北方牧业,2011,14:6-8.
[3]徐春厚,马建,王辉,等.猪场混合感染流行特点的研究[J].黑龙江八一农垦大学学报,1994(1):54-56.
[4]乔瑾,赵保生.规模化猪场生物安全控制技术研究[J].畜牧兽医杂志,2011,30(4):30-33.
[5]康小春.当前规模猪场传染病流行特点与防控对策[J].畜禽业,2011,267:10-11.
[6]陈溥言.兽医传染病学[M].5版.北京:中国农业出版社,2010.
[7]陆承平.兽医微生物学[M].4版.北京:中国农业出版社,2010.
[8]尹皑.猪病防控中的难点及应对措施[J].畜牧与饲料科学,2010,31(9):174.
[9]李喆.春季几种常见猪病的防治措施[J].养殖技术顾问,2010(4):58-59.
[10]赵广建.养猪场必备的防疫条件及操作规程[J].兽医导刊,2011(S1):205-206.
[11]Kim J,Chae C.Simultaneous detection of porcine circovirus 2 and porcine parvovirus in naturally and experimentally coinfected pigs by double in situ hybridization[J].JVet Diagn Invest,2002,14(3):236-240.
[12]Bogdan J,Wetal.Association of porcine circovirus 2 with repro-ductive failure in pigs:a retrospective study 1995-1998[J].Cana-dian Veterinary Journal,2001,42(7):548-550.

