双氟沙星在异育银鲫体内药代动力学研究*
章海鑫,阮记明,胡 鲲,郑卫东,杨先乐**,王会聪
(1.上海海洋大学国家水生动物病原库,上海201306;2.江西省水产科学研究所,江西 南昌330039;3.江西农业大学动物科学技术学院,江西 南昌330045;4.中国水产科学研究院长江水产研究所,湖北 武汉430223)
双氟沙星(difloxacin,DIF)属于第三代氟喹诺酮类抗菌药物,其对多种水产致病菌具有良好的作用效果,而且与其他抗菌药物无交叉耐药性,已被广泛的用于防治水产养殖细菌性疾病[1-2]。目前,A.Goudah[3]、M.Ismail[4]、K.Abo-El-Sooud[5]等 国 外 学 者 报 导 了DIF在小山羊和小羊羔以及小牛、骆驼体内的药代动力学特征;此外,猪[7]、兔[8]、鸡[9]、甲壳动物[10]等均也有关于DIF药代动力学的相关报导;Ding F K等[11]详细的介绍了不同温度条件下鲤鱼口服DIF后,DIF在血液中的动力学特征及组织消除情况。以上的研究均为DIF在病害防治中的合理使用提供了有力的理论参考。然而,目前对于DIF特别是其代谢产物沙拉沙星(Sarafloxacin,SAR)在异育银鲫体内的分布、代谢及消除等情况还不是很清楚。因此,本研究采用单次口灌(20mg·kg-1)给药的方式,研究了DIF及代谢产物SAR在异育银鲫(Carassais auratus gibebio)体内的药代动力学规律,并提出建议休药期,为水产养殖上DIF的安全使用提供理论依据。
1 材料与方法
1.1 仪器、药品及试剂
1.1.1 仪器 Agilent-1100型高效液相色谱仪(四元泵、自动进样器、柱温箱、紫外检测器、荧光检测器及HP化学工作站);漩涡混合器;氮气吹干仪;精密电子天平(METTLER AB104-N);高速冷冻离心机;超滤管(Amicon 10kD)等。
1.1.2 药品及试剂 双氟沙星(DIF)标准品(含量≥99.9%)、沙拉沙星(SAR)标准品(含量≥99.6%),购于Sigma公司;盐酸DIF原料药(纯度为98%)由浙江国邦药业有限公司提供。乙腈、四丁基溴化氨均为HPLC级;二氯甲烷、正己烷、柠檬酸、柠檬酸三钠、氯化钠、磷酸氢二钠、磷酸二氢钠均为分析纯,以上药品均由国药集团化学有限公司提供。
1.2 实验动物与取样
1.2.1 实验动物 健康的异育银鲫(Carassais auratus gibebio)购买于南通某国营农场,体重为(80.5±5.3)g,暂养一周后选取100尾实验,20尾做空白对照。实验期间使用自动控温系统控制水温为(25±1)℃,自然光照,供氧充足;每两天换水1次,并及时清除水体残饵和排泄物。
1.2.2 取样 盐酸DIF原料药按20mg·kg-1鱼体重标准,用细导管灌入实验鱼前肠,无回吐现象的留作实验。分别于给药后0.017、0.25、0.5、1、2、3、6、12、24、48、72、96、120、144和196h分别取血样和肌肉、肝脏、肾脏等组织样品(N=6),放入-70℃冷冻保藏至样品处理,给药前采取同一批实验鱼血液及组织空白样品。
1.3 样品处理
1.3.1 血液样品 取1mL血液加入酸化乙腈(乙腈∶盐酸∶水=250∶1∶1)5mL,漩涡混合10min,4℃条件下8 000r/min离心10min,取上清液,45℃恒温氮气条件下吹干,加1mL流动相溶解,经0.45μm微孔滤膜过滤,HPLC测定。
1.3.2 组织样品 组织样品匀浆后精确称取1.0g,置于10mL离心管中,同时加入1mol/L NaCl和0.2 mol/L PBS缓冲溶液(pH=7.4)各1mL,再加入5mL二氯甲烷进行药物萃取,漩涡混合振荡10min后,4℃条件下8 000r/min离心10min,取有机相;剩余残渣中再加入5mL二氯甲烷,重复以上操作步骤进行第二次萃取,并合并2次有机相,于45℃恒温氮气条件下吹干,加1mL流动相溶解后,加5mL正己烷脱脂;混匀、离心后将下层液体经0.45μm微孔滤膜过滤,HPLC分析。
1.3.3 双氟沙星血浆蛋白结合 血浆蛋白结合率的测定方法采用 A.Goudah[3]等方法,分别取0.5、1、3、6、12、24h血浆各0.5mL加入超滤管(10KD),4℃条件下12 000g离心120min,收集超滤液。超滤液中加入5mL二氯甲烷,漩涡混合10min,4℃条件下8 000r/min离心10min。取有机相,45℃恒温氮气条件下吹干。1mL流动相溶解残留物,0.45μm微孔滤膜过滤后HPLC测定游离药物浓度。

1.4 色谱条件
色谱柱为:ZORBAX SB2C-18分析柱(150mm×4.6mm,5μm);流动相:V(乙腈):V(四丁基溴化铵)(0.030mol·L-1、pH=3.1)=5∶95;检测波长276nm;流速1.5mL/min;柱温40℃;进样量10μL。
1.5 数据处理
标准曲线、药时曲线采用Microsoft Excel绘制;药物动力学模型拟合及参数计算使用3P97药代动力学软件处理。
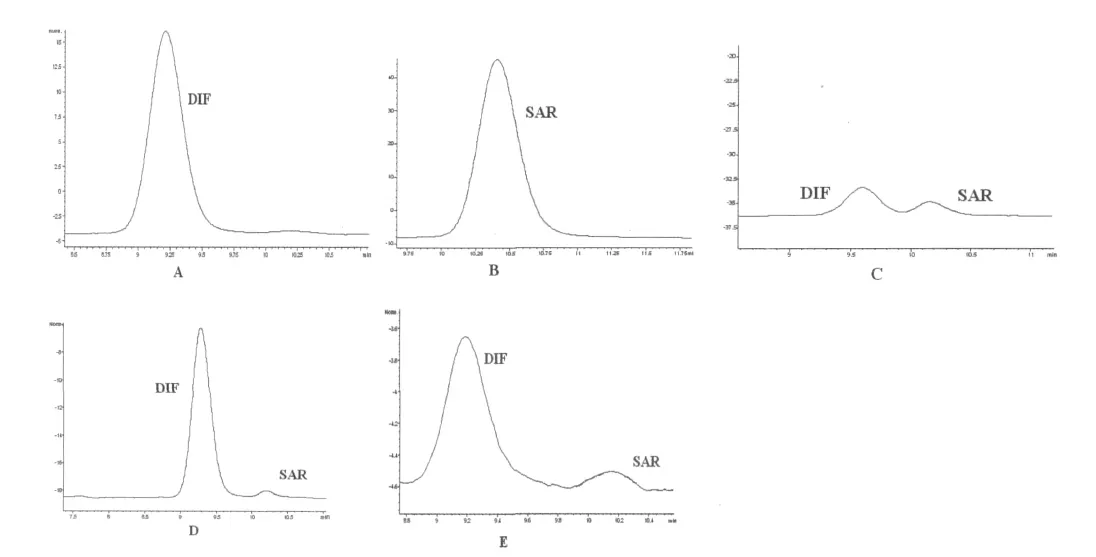
图1 DIF及其代谢产物SAR色谱图Fig.1 HPLC chromatograms of DIF and SAR
2 结果与分析
2.1 方法确证
DIF与SAR在组织中的检测采用李海迪等[6]的方法,使用外标法计算药物浓度,在0.01~10μg·mL-1浓度范围内DIF和SAR的标准曲线分别为y=31.173x-3.275,R2=0.999 3;y=27.643x-2.980 4,R2=0.999 8。图1可以看到组织中DIF与SAR均能够较好的分离,基线平稳,特异性强,重现性好。样品中DIF和SAR的保留时间分别为9.185~9.613min和10.186~10.216min,检测限分别为0.01和0.04 μg·g-1。DIF与SAR在各组织中的回收率为90.2%~102.3%,日内精密度系数不大于3%,日间精密度不大于5.8%。
2.2 异育银鲫体内DIF药物代谢动力学
DIF在异育银鲫血液中的药物时间曲线如图2所示。结果显示,给药后0.017h血液中就可检测到DIF,并在0.25h达到顶峰,达峰浓度(Cmax)为15.739 μg·mL-1,0.017~0.25h时间段为DIF的体内吸收过程。达峰后浓度开始下降,但在第2h时又可观察到一个小的吸收峰;2~6h药物浓度保持在1个较高的水平上;6~24h时药物浓度又有1个快速下降期,196h时血液药物浓度降到检测样品的最低值。用药后第1h可在血液中检测到代谢产物SAR,第2h达到第一个峰值(1.510μg·mL-1),第3h时有点下降;之后逐步上升,在第120h时SAR浓度达到了顶峰,随后快速下降,在第196h时浓度降到检测样品的最低值。组织中DIF药时曲线如图3所示:DIF在各组织中的药时曲线趋势一致,均有2个吸收峰;达峰时间肾脏(0.25h)快于肝脏(0.5h)快于肌肉(3h);Cmax则是肝脏(67.750μg·g-1)>肾脏(36.630μg·g-1)>肌肉(17.870μg·g-1)。
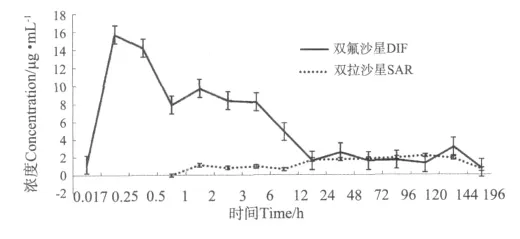
图2 血液中单次口灌20mg·kg-1 DIF药时曲线Fig.2 The concentration-time curves of DIF and SAR in plasma following a single oral gavage of 20mg·kg-1
血液与组织中DIF药代动力学参数见表1,从表中可以看到DIF消除半衰期(T1/2β)表现为血液最快,肝脏快于肾脏,肌肉组织中最缓慢;清除速率(CL)表现为血液最快,肾脏快于肝脏,肌肉最慢;曲线下面积(AUC)表现为肌肉最大,肝脏大于肾脏,血液最小。

表1 口灌20mg·kg-1 DIF血浆和组织中药代动力学参数Table 1 Pharmacokinetic parameters of DIF in plasma and tissues following a single oral gavage of 20mg·kg-1

图3 肝脏、肾脏、肌肉组织中单次口灌DIF 20mg·kg-1药时曲线Fig.3 The concentration-time curves of DIF in tissues following a single oral gavage of 20mg·kg-1
2.3 DIF在异育银鲫体内的房室模型与血浆蛋白结合率
25℃水温条件下,以20mg·kg-1剂量给异育银鲫单次口灌DIF药液后,使用3P97药代动力学软件分析血液药物时间浓度数据,结果均符合开放性二室模型。二室模型结构如图4所示,由图可知中央室向外周室转运的速率(K12)>外周室向中央室转运速率(K21);总体表观分布容积(Vb)由血浆分布容积(Vc)和组织分布容积(Vp)组成,为2.158mL·kg-1;总体消除速率Ke为0.091h-1。各时间点血浆蛋白结合率结果见图5,可知结合率为52.39%~64.10%,24h时结合率显著高于其他时间点。
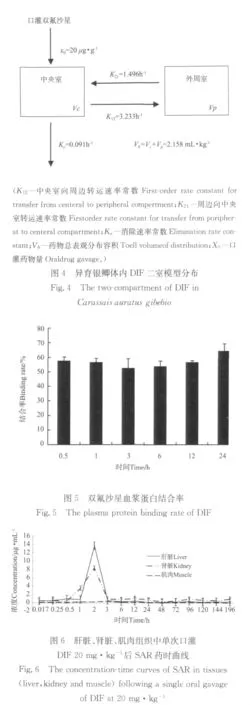
2.4 代谢产物SAR的分布与残留
DIF代谢产物SAR组织药时曲线(见图6)所示,在用药后的第0.017h肝脏和肾脏均可观察到SAR,其Cmax分别为16.640和8.340μg·g-1,并分别占肝脏和肾脏DIF峰浓度的24.56%和22.77%。肌肉组织中虽然也可观察到SAR的存在,但肌肉组织中SAR的浓度一直处在较低的水平内波动,只在第3h时出现1个小峰,且达峰浓度不高。
3 讨论
3.1 DIF在异育银鲫体内的吸收与分布
目前,在人、畜禽和水产动物上均有关于DIF药代动力学的研究[7-13]。本实验中DIF各组织药物浓度时间数据均可用开放性二室模型进行拟合。血液组织中DIF吸收半衰期 T1/2Ka短于猪[7]、鸡[9]和鲤[11],但长于中华绒螯蟹[10]。表观分布容积Vd值小于中华绒螯蟹,稍大于鲤;A.Goudah等[3]给小山羊和小羊羔静脉注射DIF后,发现小山羊和小羊羔体内的Vd值为0.048和0.049L·kg-1,而 M.Ismail等[5]和 K.Abo-El-Sooud等[4]分别使用静脉注射的方法研究了小牛仔和骆驼体内DIF药代动力学时,发现Vd值分别为1.120和1.020L·kg-1,这些结果都明显的低于实验结果。DIF在异育银鲫体内血浆蛋白结合率高于小山羊和小羊羔体内的10.32%和12.98%,也高于小牛仔和骆驼体内的31.7%~36.8%和28%~43%[3-5]。表明DIF在异育银鲫体内较易吸收,但其在体内的分布程度除了与动物的个体种类及给药方式有关外,异育银鲫体内较高的血浆蛋白结合率使得DIF具有较高的血液分布容积也有一定的关系。
组织中,给药后0.25h肾脏就达到吸收峰,肝脏和肌肉也分别在0.5和3h达到吸收峰,达峰浓度肝脏高于肾脏高于肌肉。实验结果与Ding F K等[11]和杨先乐等[12]研究结果一致。组织中K12和K21的值均不等且K12/K21>2,可见DIF从中央室向周边室转运后,在周边室滞留的时间较长也直接导致了药物在血液中的清楚速率,这与钱云云等[13]的研究结果一致。表明,肝、肾组织在给药前期能够储存DIF。比较各组织中的曲线下面积(AUC),发现肌肉组织的AUC稍大于肝脏和肾脏,钱云云等[13]研究恩诺沙星在罗氏沼虾体内药物代谢动力学时也发现AUC大于肌肉,而李海迪等[10]发现中华绒螯蟹中DIF组织AUC肝胰脏最大,表明DIF在动物体内的吸收与分布具有物种差异性。谭超等[14]研究单诺沙星在鲫鱼体内代谢动力学时也得出单诺沙星在动物体内吸收具种属差异性的结果。
综上所述,异育银鲫体内,DIF进入血液后,会有部分药物与血浆蛋白发生结合,游离药物则快速的进入肝脏和肾脏组织,然后代谢、转运入血液和消除。
3.2 DIF在异育银鲫体内的消除和代谢
CL和T1/2β是反映药物在机体内消除快慢的药代参数。实验中,DIF在组织间清除率相差不大,与恩诺沙星在虹鳟体内采用血管内给药的体清除率(0.058 L·h·kg-2)[15]比较接近;但均大于在中华绒螯蟹组织中的清除率(0.008~0.040L·h·kg-2)[10]。A.Goudah[3]与 M.Ismail[5]也发现小山羊、小羊羔和小牛仔的CL值小于0.1L·h·kg-2。异育银鲫组织中DIF的消除半衰期小于其在中华绒螯蟹组织中的半衰期(67.01~137.52h)[10],但大于高等脊椎动物[3,5,7,9],表明DIF在异育银鲫体内的消除较慢,但快于中华绒螯蟹。杨先乐[12]认为,甲壳类主要通过触角腺及肝胰腺对药物进行排泄和降解,而鱼类等可以通过肾、呼吸器官等进行扩散消除,因而不同动物种属间代谢器官的差异,造成其对药物代谢消除机能的差别。
异育银鲫肝脏、肾脏和肌肉组织中第2h均出现DIF浓度在峰谷,但此时代谢产物SAR均出现吸收峰;可以推测第2hDIF在肝脏和肾脏中显著下降的原因可能是DIF被大量的代谢。DIF的主要代谢部位为肝脏和肾脏,参与DIF代谢的主要代谢酶主要存在肝脏和肾脏组织等组织中[16-17]。于灵芝等[18]研究发现DIF代谢酶在肾细胞孵育2h时表达量达最高;Guihong Fu等[19]研究发现第2h时,DIF浓度在肝脏组织中出现峰谷,而其代谢酶CYP1A1基因表达量最高,这些研究结果都与本实验结果一致。
DIF通过脱甲基作用代谢为具有活性的SAR[20]。本实验研究发现各组织中SAR的达峰浓度占各组织DIF峰浓度的比例不一样,最高的为肝脏,然后肾脏,最后是血浆和组织。这种代谢的组织差异在猪、鸡及中华绒螯蟹上都有报道[7,9,10],其他的喹诺酮类药物也有类似的报导[21]。血液组织中代谢产物SAR表现为多封现象,这与李海迪等[10]和Jun Tang等[21]研究的结果相似;同时血液组织中观察到SAR的时间晚于肝、肾组织,说明代谢产物SAR在组织中是一种活性成分,能够在体内再分布和消除。由此可见,肝脏和肾脏既是代谢产生SAR的组织又是清除SAR的主要组织。
3.3 给药建议与休药期
姜春椿等[22]报导了盐酸二氟沙星对革兰氏阳性菌、肠菌、假单胞菌及厌氧菌的最低抑菌浓度(MIC);杨雨辉等[23]也测定了二氟沙星对嗜水气单胞菌的MIC和最小杀菌浓度(MBC),其中二氟沙星对嗜水气单胞菌的 MIC和 MBC分别为0.2和0.8mg·L-1,表明DIF是一种较好的抗菌药物。通常我们使用Cmax/MIC90和 AUC0-24/MIC90两个比值来评价药物剂量的临床效果,当Cmax/MIC90≥10和 AUC0-24/MIC90≥120时,说明药物剂量临床效果较好[24]。根据实验数据,使用Cmax/MIC90≥10来预测临床给药方案。在25℃水温条件下,口服剂量为20mg·kg-1时,DIF有效浓度保持时间可达4~6h。所以建议在治疗异育银鲫一般性细菌性疾病时,常温条件下(25℃左右),口服剂量为20mg·kg-1,2次/d,连用3d。
另外,休药期是根据国家规定的最大残留限量(MRL)标准和动物对药物残留消除规律来确定。目前欧盟规定的DIF在所有食品的物种中的残留限量分别为肝(800μg·kg-1)、肌肉(300μg·kg-1)、肾(600μg·kg-1),而SAR在动物性食品中的最大残留限量为30μg·kg-1,据此可以计算出各组织中DIF消除残留低于最大残留限量的时间为肌肉432h(18d)、肝96h(4d)、肾264h(11d);因此建议在25℃环境温度下,DIF在异育银鲫上的休药期应大于18d。
[1] 农业部《新编渔药手册》编撰委员会.新编渔药手册 [M].北京:中国农业出版社,2005:211-212.
[2] 刘开永,李英伦,胡廷秀.二氟沙星的研究概况 [J].中国兽药杂志,2004,38(6):27-31.
[3] Goudah A,Mouneir S M.Comparative pharmacokinetics of difloxacin in goat kids and lambs[J].Small Ruminant Research,2008,78:186-192.
[4] Abo-El-Sooud K,Goudah A.Pharmacokinetics and intramuscular bioavailability of difloxacin in dromedary camels(Camelus dromedarius)[J].The Veterinary Journal,2009,179:282-286.
[5] Ismail M.Disposition kinetics of difloxacin after intravenousIntramuscular and subcutaneous administration in calves[J].Veterinary Research Communications,2007,31:467-476.
[6] 李海迪,杨先乐,胡鲲,等.高效液相色谱法测定中华绒螯蟹主要组织中双氟沙星及其代谢产物沙拉沙星方法 [J].药物分析杂志,2009,29(7):1142-1147.
[7] 曾振灵,丁焕中,黄显会,等.二氟沙星在猪体内的药物动力学及生物利用度研究 [J].中国农业科学,2003,36(7):846-850.
[8] Garcia M A,Solans C,Aramayona J J,et al.Simultaneous determination of difloxacin and its primary metabolite sarafloxacin in rabbit plasma[J].Chromatographia,2000,51:487-490.
[9] 丁焕中,曾振灵,杨贵香,等.二氟沙星在鸡体内的药物代谢动力学及生物利用度研究 [J].中国兽医科技,2004,34(6):20-24.
[10] 李海迪,杨先乐,胡鲲,等.双氟沙星及其代谢产物在中华绒螯蟹体内药物代谢及残留消除规律 [J].动物学杂志,2009,44(2):12-20.
[11] Ding F K,Cao J Y,Ma L B,et al.Pharmacokinetics and tissue residues of difloxacin in crucian carp(Carassius auratus)after oral administration[J].Aquaculture,2006,256:121-128.
[12] 杨先乐,李正,杨勇,等.盐酸环丙沙星药液口灌在中华绒螯蟹体内的代谢动力学研究 [J].水产学报,2004,8(增刊):25-29.
[13] 钱云云,唐骏,杨先乐,等.恩诺沙星在罗氏沼虾体内的药物代谢动力学 [J].动物学杂志,2007,42(5):62-69.
[14] 谭超,李彩云,刘湘新,等.单诺沙星在鲫鱼体内的药物代谢动力学研究 [J].动物医学进展,2008,29(4):22-26.
[15] Rocca G,Della A D,Salvo J,et al.The disposition of enrofloxacin in seabream (Sparus auratal )after single intravenous injection or from medicated feed administration [J].Aquaculture,2004,232:53-62.
[16] Pesonen M,Celander M,Forlin L,et al.Comparison of xenobiotic biotransformation enzymes in kidney and liver of rainbow trout(Salmo gairdneri)[J].Toxicol and Appl Pharmacol,1987,91:75-84.
[17] Lorenzana R M,Hedstrom O R.Localization of cytochromme P-450in the head and trunk Kidney of rainbow (Salmo gairdneri)[J].Toxicol Appl Pharmacol,1988,96:159-167.
[18] 于灵芝,杨先乐,王翔凌,等.草鱼肾细胞中双氟沙星代谢酶的酶动学 [J].水产学报,2010,34(3):404-409.
[19] Fu G H,Yang L X,Zhang H X,et al.Effects of cytochrome P4501Asubstrate(Difloxacin)on enzyme gene expression and pharmacokinetics in crucian carp (hybridized Prussian carp)[J].Environmental Toxicologyand Pharmacology(2010),2010,11:9.
[20] Granneman G R,Snyder K M,Shu V S.Difloxacin metabolism and pharmacokinetics in humans after single oral doses[J].Antimicrobial Agents and Chemotherapeutics,1986,30(3):689-693.
[21] Tang J,Yang X L,Zheng Z,et al.Pharmacokinetics and the active metabolte of enrofloxacin in Chinese mittenhanded crab (Eriocheir sinensis)[J].Aquaclture,2006,260:69-76.
[22] 姜春椿,宋克王.最新广谱喹诺酮类抗微生物药 [M].北京:人民军医出版社,1991:26-45.
[23] 杨雨辉,佟恒敏,卢彤岩,等.几种氟喹诺酮类药物对嗜水气单胞菌体外药效学研究 [J].东北农业大学学报,2003,34(4):368-371.
[24] Walker R D.The use of fluoroquinolones for companion animalantimicrobial theraphy[J].Aust Vet J,2000,78:84-90.

