羟基喜树碱自乳化传递系统的处方筛选和体外评价
杨根生,包方廷,王文喜
(浙江工业大学 药学院,浙江 杭州310032)
自乳化药物传递系统 (Self-emulsifying drug delivery systems,SEDDS)是由油相、乳化剂和助乳化剂形成的热力学稳定的均一、透明或半透明溶液,该系统可以在胃肠道内或在轻微搅拌(37℃)的情况下自发形成水包油型乳剂(粒径≤5μm).随着乳化剂用量的增多,粒径可进一步减小(粒径≤100nm),此时称为自微乳化药物传递系统(Self-microemulsifying drug delivery systems,SMEDDS).SEDDS和SMEDDS能提高药物溶解度,降低胃肠道副作用,提高疏水性、难吸收或易水解的药物溶出度,增加小肠上皮的渗透性,降低或抑制P-糖蛋白药物外排,有助于提高药物的生物利用度等[1-2].羟基喜树碱(Hydroxycamptothecin)是从珙桐科旱莲植物喜树中分离得到的一种色氨酸-萜烯生物碱,在临床上主要用于原发性肝癌、胃癌、慢性粒细胞白血病、直肠癌、膀胱癌的治疗[3].由于羟基喜树碱溶解度较低,导致生物利用度不高,同时该药物化学稳定性差,内酯环对pH敏感,开环后抗癌活性降低90%,限制了其临床应用[4].为了提高羟基喜树碱口服吸收效果,增强疗效,笔者开展了制备羟基喜树碱口服自乳化给药系统(HCPT-SEDDS)的研究.
1 材料与方法
1.1 仪器设备
台式漩涡振荡仪(常州国华电器有限公司);HH-4数显恒温水浴器(金坛市江南仪器厂);KNAUER SY-4000K 型 高 效 液 相 色 谱 仪 (德 国KANUER有限公司);Smartline Autosampler 3800自动进样器(德国KANUER有限公司);Hypersil C18色谱柱,250×4.6mm,5μm(大连依利特有限公司);JEM透射电子显微镜(日本电子公司);DelsaNano激光粒度测定仪(Beckman公司);ZRS-8型智能溶出试验仪(天津大学仪器厂).
1.2 药品与试剂
羟基喜树碱(HCPT,纯度≥98%)购置于上海龙翔科技有限公司;聚氧乙烯蓖麻油(Cremophor EL)购置于法国BASF;氢化玉米油(Maisine 35-1)、辛酸葵酸聚乙二醇甘油酯(Labrasol)、油酸甘油酯(Peceol)、丙二醇二癸酸酯(Labrafac PG)和二乙烯基乙二醇单乙醚(Transcutol P)购置于法国佳法赛;三丁酸甘油酯(Glyceryl tributyrate)购置于庄信万丰公司(A Johnson Matthey Company);油酸乙酯(Ethyl oleate)、油酸正丁酯(Butyl oleate)、肉豆蔻酸异丙酯(Isopropyl myristate)购置于阿拉丁试剂公司;辛酸葵酸甘油酯(GTCC)购置于北京凤礼精求商贸有限责任公司;甲醇为市购色谱纯,其余试剂为市购分析纯.
1.3 实验方法
1.3.1 药物在各辅料中平衡质量浓度的考察
将过量HCPT置于具塞离心管中,分别加入油相、乳化剂或助乳化剂2.0mL.将混合物漩涡混匀,在37℃恒温水浴中震荡平衡72h,于5 000r/min离心5min,用甲醇稀释适宜倍数后,用HPLC法测定HCPT含量,计算其在各辅料中的质量浓度.选用的HPLC条件:色谱柱为 Hypersil C18(250mm×4.6mm,5μm);流动相为V(甲醇)∶V(水)=60∶40;检测波长为266nm;柱温为室温;流速为1.0mL/min.
1.3.2 三元相图的绘制
根据质量浓度考察和预先配伍试验结果,选定Maisine35-1和 GTCC作为油相,Cremophor EL和Labrasol作为乳化剂,Transcutol P作为助乳化剂.以Maisine35-1作为单一油相以及联合使用Maisine35-1,GTCC作为混合油相的微乳区域比较进行油相的考察.分别以Cremophor EL和Labrasol作为单一乳化剂时的微乳区域与使用混合乳化剂时的微乳区域进行比较进行乳化剂的筛选,其中定义Cremophor EL和Labrasol的质量比为KM,依次考察KM=1∶2,1∶1,2∶1,3∶1和4∶1四个比例的相图情况.
称取Km1=m(乳化剂)∶m(助乳化剂)分别为1∶4,1∶3,1∶2,1∶1,2∶1,3∶1和4∶1七个比例;Km2=m(油相)∶m(乳化剂+助乳化剂)分别为1∶9,2∶8,3∶7,4∶6,5∶5,6∶4,7∶3,8∶2和9∶1九个比例,总量为1g的不同处方[5].漩涡震荡使充分混匀,37℃恒温水浴保温2h.在不断振摇下加入100mL去离子水,观察过程现象和最终的成乳情况,以体系澄清透明或半透明,带有淡蓝色乳光作为考察标准,判断能否形成微乳.
以油相、乳化剂和助乳化剂作为三元相图的三个顶点,根据各组分在处方中所占总量的质量分数,利用Origin Pro8.0软件绘制相图.按Km1七个比例所对应绘制Km2九个比例的一系列点,筛选其中能形成微乳的临界点,与斜边所组成的图形从而得到相图的微乳区域.
1.3.3 HCPT-SEDDS质量评价指标的选择及测定
理想的自乳化处方应具有对药物良好的溶解能力,应在较短的时间内快速分散成粒径小而均匀的乳滴.因此,选择处方对药物的平衡质量浓度、微乳的平均粒径和处方的自乳化速率作为质量评价指标.
1.3.3.1 药物平衡质量浓度的测定
将过量HCPT加到2.0g空白自乳化制剂中,密闭状态下于37℃水浴中震荡72h达到平衡,吸取上清液,离心5min(5 000r/min),精密吸取一定量的样品,用色谱甲醇适量稀释后,采用HPLC法测定HCPT含量,计算平衡质量浓度.
1.3.3.2 粒径测定
取 HCPT自乳化制剂0.5g,在37℃,50r/min磁力搅拌下滴加到100mL 0.1mol/L HCl中,待形成微乳后,采用DelsaNano激光粒度测定仪测定微乳的平均粒径及粒径分布.
1.3.3.3 自乳化速率的测定
取HCPT自乳化制剂适量,在37℃0.1mol/L HCl中,50r/min 搅拌,于 1,2,3,5,7,10,15,20min取液,在250nm波长下测定其吸光度A,以20min测得的A0值作为100%,将吸收度达到100%的时间t作为完全乳化的时间.
1.3.4 星点设计-响应面法优选处方
在相图考察的基础上,选择对微乳形成有显著性影响的两个因素作为考察对象,即油相质量分数(X1)和乳化剂与助乳化剂的比值(X2),实验采用两因素五水平的星点设计[6],取值范围X1为20~50,X2为1~4.各因素水平的代码值和实际操作值由星点设计原理确定,因素和水平见表1.
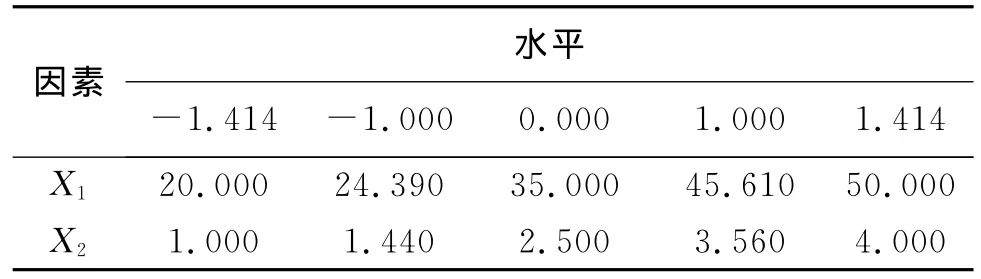
表1 各因素水平代码值和实际操作物理量值Table 1 Independent variables and the correspondent values in coded and physical form
以处方中药物平衡质量浓度、微乳粒径、自乳化速率作为评价指标(因变量),以 Design-Expert 7.0.0为统计软件,分别对各因素水平进行二项式非线性拟合.以拟合方程的回归系数r对方程进行准确性检验,根据最优方程绘制响应面和等高线,分析各因素对各效应值的影响,选取最佳优化区,确定最优处方.
1.3.5 优化HCPT自乳化传递系统的制备
称取处方量的Labrasol和Transcutol P置于具塞三角锥瓶中,混匀后,加入HCPT原料药,将三角锥瓶置于50℃水浴中,直至药物完全溶解.然后依次加入一定量的 Cremophor EL,Maisine 35-1和GTCC,漩涡混匀,在50℃恒温水浴中缓慢震荡直至形成淡黄色均一溶液.
1.3.6 溶出度测定
将HCPT自乳化处方灌装于硬胶囊中,按照(中国药典)2010年版二部附录XC第一法(转篮法)[7],温度为(37±0.5)℃,转速为50r/min,溶出介质为200mL 0.1mol/L HCl,分别于5,10,20,30,45,60,90,120min时取样5mL,并补充同体积的温度为(37±0.5)℃的溶出介质.再用0.45μm微孔滤膜过滤,采用HPLC法测定HCPT在不同时间点的溶出度,计算溶出百分率并绘制溶出曲线.同时,用不含药物的空白制剂作对照以消除体系浊度的影响.
1.3.7 微乳形态观察
取HCPT-SEDDS用水稀释100倍,形成半透明带淡蓝色乳光的微乳.将3%的磷钨酸溶液滴到蜡板上,另将稀释一定浓度的微乳滴加到铜网上,用滤纸吸取过多的样品溶液,将铜网正面盖在染液上负染20min,取出铜网,用滤纸吸取过多的染色液,在透射电镜下观察并照相.
1.3.8 初步稳定性评价
根据处方配比,制成HCPT-SEDDS制剂,密封于西林瓶中室温保存,分别于0,1,2,3,6月末取样,对其外观、微乳粒径、自乳化时间、1h累积溶出度与药物含量进行考察[8].
2 结果与讨论
2.1 药物在各辅料中平衡质量浓度的考察
平衡质量浓度测定结果如表2所示(37℃).HCPT在助乳化剂Transcutol P中的质量浓度最大,在乳化剂Labrasol中的溶解度次之.
通过质量浓度实验及初步配伍试验选择油相为Maisine 35-1和GTCC,乳化剂为Cremophor EL和Labrasol与助乳化剂Transcutol P.HCPT在一些油相中的质量浓度也不是很理想,而在Labrasol和Transcutol P两种溶剂中的质量浓度远远大于其他辅料.这可能由于HCPT一端是亲油链,另一端是带有羟基的亲水链,而Labrasol和Transcutol P恰恰也是类似的结构.他们对HCPT良好的溶解能力很好说明了相似相容的原理.因此,在制备处方的时候,首先将HCPT完全溶解于Labrasol和Transcutol P,再依次加入其他组分,这样混合才能有利于形成澄清、均一和稳定的浓缩液.

表2 羟基喜树碱在不同辅料中的平衡质量浓度Table 2 The equilibrium solubility of HCPT in different solvents
2.2 三元相图的绘制
相图中用实线封闭的区域代表自乳化形成微乳的区域,黑点表示被考察的区域.由图1(a,c)比较可知:混合油相m(Maisine35-1)∶m(GTCC)=1∶1的自微乳区域明显大于单独使用Maisine35-1的区域.由图1(a,b)比较可知:乳化剂为Cremophor EL的自微乳化区域要远远大于Labrasol的自微乳化区域.单独以Cremophor EL作为乳化剂时,乳化过程中有凝胶现象出现,自乳化速率较慢,所以考虑选择混合乳化剂.联合使用乳化剂Cremophor EL和Labrasol,一方面利用了Cremophor EL较强的乳化能力,另一方面利用了Labrasol良好的溶解性能,在保证乳化效果的同时提高了对药物的溶解能力.通过比较图1(d—g)可知:当联合使用Cremophor EL和Labrasol时,形成的自微乳区域还是比较大,并且随着Cremophor EL与Labrasol比例的增大,自微乳区域增大,乳化速率减慢.
三元相图的研究初步筛选出了处方的较佳组分组成.在综合考虑质量浓度和乳化能力的情况下,选择了含碳数为8~10的油脂GTCC和含碳数为16的不饱和油脂Maisine 35-1联合使用作为处方的油相.乳化剂选择了HLB为12~14的Cremophor EL和HLB为12的Labrasol联合使用.根据文献[4]报道喜树碱类提取物为P-糖蛋白底物,自乳中的表面活性剂Cremophor EL和Labrasol可抑制P-糖蛋白的外排作用,降低药物外排几率,增加药物的吸收.
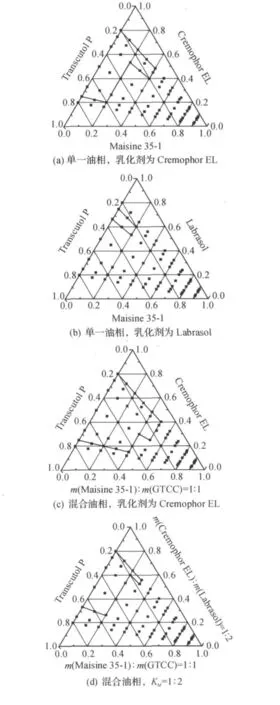

图1 不同组分形成差异性微乳区域的三元相图Fig.1 The phase diagram of difference microemulsion area due to different compositions
2.3 星点设计-响应面法优化处方
大多数情况下,各因素对效应的影响并非线性,而目前普遍采用正交设计和均匀设计优化工艺、筛选处方,即用线性数学模型进行拟合,实验次数虽少,但精度不够,预测性较差.研究采用星点设计-响应面法对处方中不同成分的比例进行了优化,该方法遵循循序渐进的原则,根据球面设计原理确定极值和水平,更适合于非线性拟合的试验设计[9].研究按照星点设计原理,安排了13次试验,对试验数据进行二次多项式非线性拟合,以方程回归系数r最大且F检验合格为原则,结果二次多项式拟合结果较好,得到回归方程为
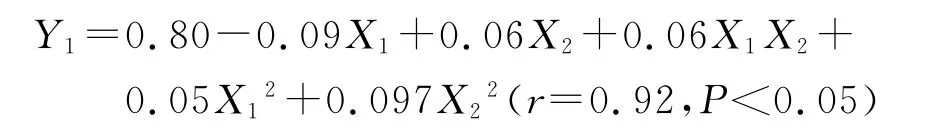
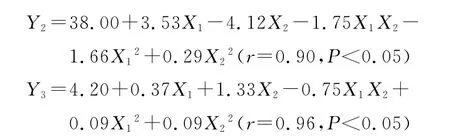
采用Design-Expert 7.0.0统计软件绘制以上拟合方程的效应面和等高线,结果见图2.
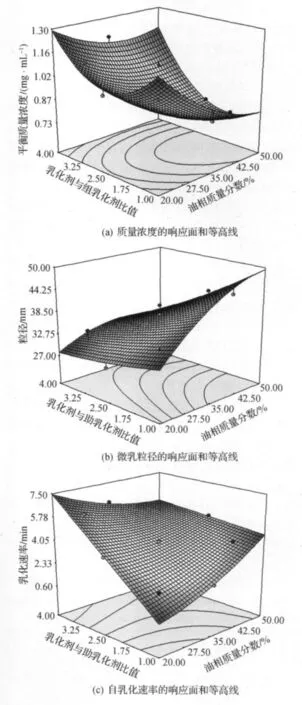
图2 两因素五水平非线性拟合的响应面及其等高线Fig.2 Response surfaces and contour line of nonlinear fitting of two factors and five levels
2.4 最优处方的确立
2.4.1 药物平衡质量浓度
增加HCPT溶解度是本实验的主要目的之一.结果表明:当油相比例(X1)一定时,随着乳化剂/组乳化剂比例(X2)的增大,体系对药物的增溶能力是先减小后增大;固定X2比例时,增大油相比例导致增溶能力降低.从药物在体系各成分中平衡质量浓度的测定结果中,药物在Transcutol P的质量浓度最大,在一定范围内,体系对药物的增溶能力依赖于助乳化剂Transcutol P的质量分数.
2.4.2 微乳粒径
减小微乳的粒径有利于提高药物的吸收.结果表明:当油相比例(X1)小于25%时,X2的变化对粒径没有明显的影响,而当油相质量分数较高时,随着X2的增大,微乳粒径逐渐减小.当X2一定时,随着油相比例(X1)从20%增加到50%,粒径增大趋势明显.所以要选择一个合适的油相比例,在此基础上选择一个合适的乳化剂/组乳化剂比例,才能形成粒径理想的微乳.
2.4.3 自乳化速率
自乳化速率越小说明从浓缩液变为微乳所需时间越短,体系的效果越好.结果表明:当油相比例(X1)一定时,随着X2的增大,自乳化速率增大;当固定X2时,自乳化速率随着X1的增大而增大.当乳化剂和油相的比例都增加的时候,体系从浓缩液变为微乳所需时间都延长.
理想的且体内吸收良好的SEDDS应该对药物有较好的质量浓度,能在较短的时间内乳化,且得到粒径较小的微乳.本研究中规定HCPT-SEDDS的优化处方应满足以下指标:药物平衡质量浓度≥1mg/mL,微乳粒径≤40nm,自乳化速率为4min左右或者更短.依据上述指标,综合评价,选出因素最佳取值范围为:X1=25~35,X2=1.25~2.0,以油相用量尽量多和形成粒径尽量小的原则,最后确定Km1=2∶1,Km2=35∶65为最优处方,见表3.
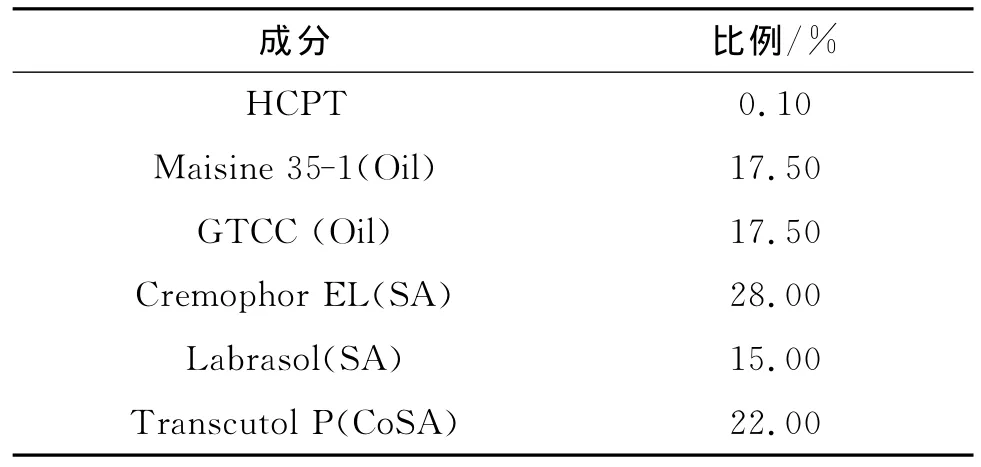
表3 最优HCPT-SEDDS浓缩液中各成分及其比例Table 3 The ingredients and proportion in the optimal HCPT-SEDDS concentrate
2.4.4 溶出度及其微乳粒径的测定和形态观察
HCPT的SEDDS胶囊与其粉末胶囊的累积溶出度差异很大(图3),50min后SEDDS胶囊的溶出可达90%以上,而粉末胶囊从始至终都达不到10%,两种制剂在模拟体内两种不同介质(0.1mol/L HCl和磷酸盐缓冲液PBS)中的溶出差异不大.体外累积溶出度实验表明:HCPT-SEDDS不管在人工胃液还是人工肠液中都能得到很好的溶出释放,达到90%以上,远优于原料药.
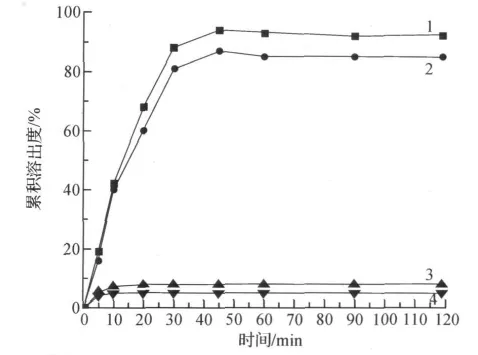
图3 HCPT自乳化胶囊和粉末的累积溶出曲线图Fig.3 The stripping curve for HCPT-SEDDS and HCPT powder capsules
粒径测定结果见图4.最优处方稀释200倍后,微乳粒径为28.42nm,分散系数为0.085 1,微乳粒径小且分布均匀,符合微乳的粒径要求.形成的微乳在透射电镜下为均匀球状或椭圆状液滴,如图5所示.

图4 最优处方粒径分布图Fig.4 The particle size distribution figure of the optimum prescription
2.4.5 初步稳定性评价
在室温留样条件下放置6个月,HCPT-SEDDS的外观仍为均一淡黄色澄清透明溶液,遇水约6min可自乳化形成微乳.形成的微乳半透明带淡蓝色乳光,离心不分层,粒径仍在30~50nm之间,1h累积溶出度达85%以上,药物含量仍在90%以上,符合制剂要求.结果表明:HCPT-SEDDS的各项考察指标基本上无显著变化,说明HCPT-SEDDS在6个月内稳定(表4).

表4 HCPT-SEDDS在六个月内各项理化性质的比较Table 4 The comparison of the HCPT-SEDDS physicochemical properties within six months
初步稳定性试验表明:羟基喜树碱自乳化给药系统(HCPT-SEDDS)在六个月内各项指标均无异常,但其长期稳定性试验还需进一步考察.
3 结 论
HCPT是水溶性和脂溶性均不好的抗肿瘤药物,其在正辛醇/水中分配系数不大,这个理化性质显示了其口服吸收受到极大限制.自乳化给药系统作为一种新型药物传递系统,在提高药物质量浓度、增加药物稳定性、降低药物毒副作用、缓控释给药等方面有着广泛的应用.研究制备的自乳化浓缩液对羟基喜树碱有较大的质量浓度,在人工胃肠道消化液环境下可自发形成粒径小于40nm的微乳液,可经淋巴管吸收克服首过效应,而且避免了胃肠道内酶水解,有助于提高口服生物利用度.而且由于处方中大量的表面活性剂能改变细胞膜的流动性,提高药物的膜渗透性,可以大大提高口服生物利用度[9].此外,羟基喜树碱自乳化传递系统的体外抗肿瘤细胞活性及体内吸收情况有待于研究,进而为其自乳化制剂的开发提供更加详实的依据.
[1]GURSOY R N,BENITA S.Self-emulsifying drug delivery systems(SEDDS)for improved oral delivery of lipophilic drugs[J].Biomed Pharmacother,2004,58(3):173-182.
[2]SHAN N H,CARVAJAL M T,MALICK A W,et al.Self-emulsifying drug delivery systems(SEDDS)with polyglycolyzed glycerides for improving in vitro dissolution and oral absorption of lipophilic drugs[J].Int J Pharm,1994,106(1):15-23.
[3]ZHANG Rui-wen,LI Yu-feng,CAI Qiu-yin,et al.Preclinical pharmacology of the natural product anticancer agent 10-hydroxycamptothecin,an inhibit or of topoisomerase I[J].Cancer Chemother Pharmacol,1998,41(4):257-267.
[4]HATEFI A,AMSDEN B.Camptothecin delivery methods[J].Pharm Res,2002,19(10):1389-1399.
[5]潘国梁,贾晓斌,魏惠华,等.药用微乳伪三元相图的几种制备方法比较研究[J].中国药房,2006,17(1):21-23.
[6]吴伟,崔光华.星点设计-效应面优化法及其在药学中的应用[J].国外医学药学分册,2000,27(5):292-298.
[7]国家药典委员会.中华人民共和国药典:第二部[M].北京:化学工业出版社,2010.
[8]陆彬.药物新剂型与新技术[M].2版.北京:人民卫生出版社,2005.
[9]SINTOV A C,SHAPIRO L.New microemulsion vehicle facilitates percutaneous penetration in vitro and cutaneous drug bioavailability in vivo[J].J Control Release,2004,95(2):173-183.

