白蛋白结合型紫杉醇治疗食管癌的临床观察
崔瀚之,戴广海,石 燕,陈 丽,王中岳,管莎莎
解放军总医院 肿瘤综合治疗科,北京 100853
紫杉醇是新一代广谱抗癌药,具有显著的抗肿瘤活性。目前临床上常用的普通紫杉醇制剂因其水溶性较差,通常以聚氧乙烯蓖麻油(Cremophor EL)和无水乙醇(1∶1)混合液作为助溶剂;但这些助溶剂可导致不同程度的过敏反应,加重紫杉醇的神经毒性反应。因此,临床用药前需常规给予抗组胺药物及地塞米松等进行预处理。另外,聚氧乙烯蓖麻油在血液循环中形成的小微粒能将紫杉醇包裹,阻止药物分布到肿瘤组织中,从而影响药物的治疗效果[1]。白蛋白结合型紫杉醇是一种新型的不含聚氧乙烯蓖麻油的紫杉醇制剂,它将难以溶解的紫杉醇与白蛋白结合在一起形成0.1-0.2μm大小的稳定且具有良好水溶性的纳米颗粒,能够更好地被肿瘤组织所摄取。笔者回顾性分析2009年1月-2011年6月,使用白蛋白结合型紫杉醇治疗食管癌14例的疗效及不良反应,报告如下。
资料和方法
1 资料 2009年1月-2011年6月我院使用白蛋白结合型紫杉醇化疗的食管癌患者共14例,可评价病例14例。所有病例均经组织学或细胞学确诊为食管鳞癌。美国东部肿瘤协作组(ECOG)评分≤1,预计生存期>12周。血液学标准:中性粒细胞(ANC)≥1.5×109/L,血小板(PLT)≥100×109/L,血红蛋白(Hb)≥90g/L,谷丙转氨酶(ALT)、谷草转氨酶(AST)≤正常值上限2.5倍以内,总胆红素正常,血肌酐(Cr)≤正常值上限1.5倍以内。见表1。
2 治疗方法 所有患者使用的白蛋白结合型紫杉醇制剂为美国阿博利斯生产的Abraxane(生产批号:6101465),起始剂量为260mg/m2,静脉滴注30min,用药前不予抗过敏预处理。
3 疗效评价 每2个周期评价1次疗效。按实体瘤疗效评定标准(RECIST),分为完全缓解(CR),部分缓解(PR),稳定(SD),进展(PD)。
4 不良反应评价 不良反应按WHO化疗药物急性及亚急性毒性分级标准评定,分为0-4度。
结 果
1 一般资料 14例患者均签署化疗知情同意书,接受至少4个周期的化疗。其中男性11例,女性3例;年龄43-68岁,中位年龄53岁。见表1。
2 近期疗效评价 14例中,1例获得CR,7例获得PR,5例获得SD,1例获得PD,总体有效率57.1%。
3 不良反应 主要不良反应为中性粒细胞减少和神经毒性(表2)。本次研究中无一例发生严重过敏反应,未观察到心动过缓、低血压及严重心血管事件。
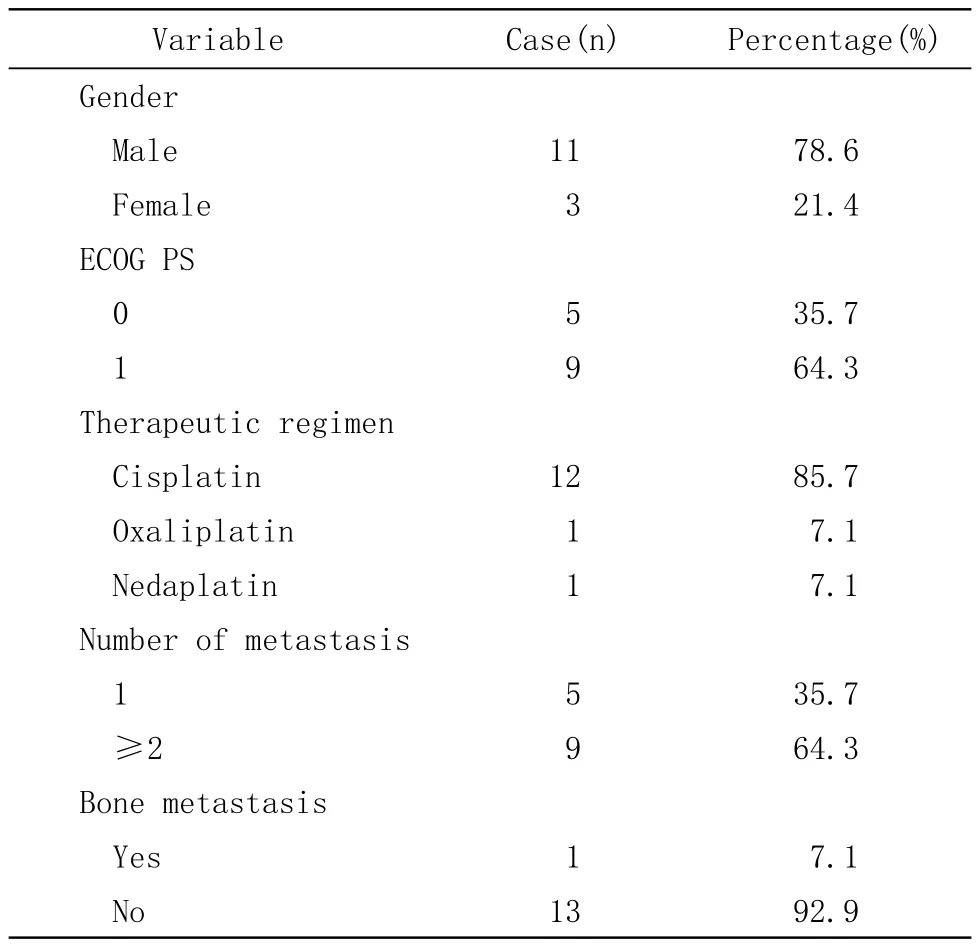
表1 患者一般资料Tab 1 General parameters of patients included in this study
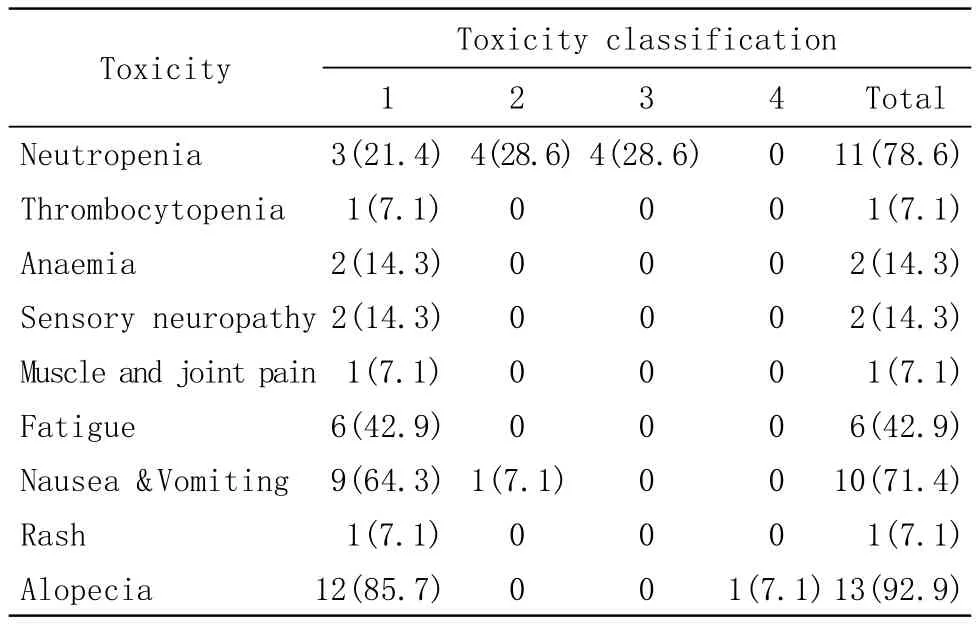
表2 白蛋白结合型紫杉醇毒性反应Tab 2 Toxic reactions in patients to albumin-bound paclitaxel(n, %)
讨 论
紫杉醇最为严重的不良反应是过敏性休克,主要表现为支气管痉挛性呼吸困难、面部潮红、皮疹、胸痛、窦性心动过速、高血压、血管性水肿、荨麻疹等。在Ⅰ期临床研究中,上述症状发生率为20%-40%,但通过延长输注时间及给予地塞米松、苯海拉明及西咪替丁等预处理后可显著降低不良反应发生率。然而,即使给予预处理仍有1.5%-3%的病人发生致命的不良反应。主要与聚氧乙烯蓖麻油引起的组胺释放有关[2]。此外,输注紫杉醇时,须使用一次性非聚氯乙烯材料的输液袋和输液管,并通过直径不超过0.22μm的过滤器过滤后静脉滴注。本研究中使用的白蛋白结合型紫杉醇由于不含聚氧乙烯蓖麻油,所有病例未给予抗过敏预处理也未发生严重过敏反应,仅有1例发生轻度过敏反应,表现为皮疹,未予特殊处理。
紫杉醇引起的神经毒性包括周围神经毒性、运动神经毒性、自主神经毒性、肌病、中枢神经系统毒性等。周围神经毒性表现为麻木、感觉异常、刺痛、灼热感,常见于手指及脚趾等。运动神经毒性最常见表现是轻度麻木和感觉异常[3]。周围神经毒性持续时间长,具有不可逆性,是紫杉醇受剂量限制的影响因素[4]。研究表明,小鼠接受大剂量蓖麻油时,可引起轴突肿胀、囊泡变性、背根神经节脱髓鞘病变等。而接受不含蓖麻油紫杉醇治疗的小鼠神经组织中却未检测出紫杉醇[5]。Nabholtz等[6]报道,紫杉醇单药剂量为135-175mg/m2时,感觉神经毒性发生率为46%-70%,而3度或4度感觉神经毒性发生率为3%-7%。这可能与聚氧乙烯蓖麻油引起的脱髓鞘病变和神经元退行性变有关,当紫杉醇剂量提高至剂量为200-250mg/m2时,4度感觉神经毒性发生率为9%-12%。本研究中,感觉神经病变的发生率为14.3%,表现为手足麻木、感觉异常、刺痛等。
1 Van ZL,Karlsson MO,Verweij J,et al. Pharmacokinetic modeling of paclitaxel encapsulation in cremophor EL micelles[J]. Cancer Chemother Pharmacol,2001,47(4):309-318.
2 Gelderblom H,Verweij J,Nooter K,et al. Cremophor EL:the drawbacks and advantages of vehicle selection for drug formulation[J]. Eur J Cancer,2001,37(13):1590-1598.
3 吴洪斌. 紫杉醇注射液不良反应的预防及处理[J]. 中国新药杂志,2002,11(2):168-169.
4 Yamamoto Y,Kawano I,Iwase H. Nab-paclitaxel for the treatment of breast cancer:efficacy,safety,and approval[J]. Onco Targets Ther,2011,4:123-136.
5 Henderson IC,Bhatia V. Nab-paclitaxel for breast cancer:a new formulation with an improved safety profile and greater efficacy[J].Expert Rev Anticancer Ther,2007,7(7):919-943.
6 Nabholtz JM,Gelmon K,Bontenbal M,et al. Multicenter,randomized comparative study of two doses of paclitaxel in patients with metastatic breast cancer[J]. J Clin Oncol,1996,14(6):1858-1867.

