组蛋白乙酰化酶hMOF在肾透明细胞癌组织中的表达及其临床意义
迟长亮,芦志华,管旌旌,王 勇,唐宇哲,蔡 勇,金景姬,王春喜
(1.吉林大学第一医院泌尿外科,吉林 长春 130021;2.吉林省人民医院泌尿外科,吉林 长春 130021;
3.吉林大学生命科学学院表观遗传学实验室,吉林 长春 130012)
组蛋白乙酰化修饰在基因转录调控、DNA损伤修复及细胞周期调控等生物学过程中发挥重要作用,是近年来表观遗传学、肿瘤学领域的研究热点。组蛋白乙酰转移酶(histone acetyl-transferases,HATs)和组蛋白去乙酰化酶(histone deacetylase,HDACs)是调控组蛋白乙酰化修饰的2种重要的酶。组蛋白乙酰化酶hMOF是组蛋白乙酰转移酶家族的成员之一,负责组蛋白H4的第16位赖氨酸(H4K16)的乙酰化。其表达量的减少将导致整个基因组组蛋白H4K16乙酰化水平的下降,引起基因组的蛋白表达发生改变[1]。目前研究[2]表明:hMOF表达量的异常与恶性肿瘤的发生、发展及恶性程度相关。肾细胞癌(renal cell carcinoma,RCC)是泌尿系统常见恶性肿瘤之一,其发病机制一直是研究的热点。目前有关hMOF蛋白与肾癌发病机制的研究国内外尚无相关报道,本文作者通过研究hMOF蛋白在肾癌组织中的表达情况,探讨其在肾癌发生、发展中的作用。
1 材料与方法
1.1 实时荧光定量聚合酶链反应
1.1.1 标本及主要试剂 收集近期本院行肾癌根治术的癌组织标本9例,其中Fuhrman分级Ⅰ、Ⅱ、Ⅲ级各3例,并留取癌旁正常肾组织作为对照。主要试剂及仪器:superRT cDNA 试剂盒(CWbio公司)。Tiozol RNA 试剂盒(Biomiga公司)。hMOF及β-actin基因PCR引物,hMOF基因上游引物5′-GAAGTCACGGTGGAGATCGGA-3′,下游引物5′-CTTGGCCAGCAGACACAGGTT-3′;β-actin基因上游引物5′-ATGGGTCAGAAGGATTCCTATGT-3′,下游引物5′-AGCCACACGCAGCTCATT-3′(上海生工生物技术公司合成)。荧光定量PCR仪(ABI PRISM 7300)。
1.1.2 方法 组织样本留取后迅速用液氮冷冻保存。采用Tiozol RNA 试剂盒提取组织总RNA,并测定含量。用superRT cDNA 试剂盒将总RNA逆转录成cDNA,-20℃保存待用。采用SYBER Green嵌合荧光法扩增目的基因和内参基因。qRT-PCR体系如下:SYBR Green 12.5 μL,dH2O 4.5 μL,上、下游引物各2 μL(2 mmol·L-1),cDNA模板4 μL(2 mg·L-1)。反应条件:预变性,95℃、30 s;PCR扩增,95℃、5 s,64℃、20 s,40个循环;融解曲线分析:95℃、0 s,65℃、15 s,95℃、0 s;退火:60℃。实验数据应用2-△△Ct进行处理,其前提是目的基因和内参基因扩增率一致[3]。每个样本重复进行3次实验,计算各样本平均Ct(threshold cycle number)值和ΔCt值(ΔCt=Ct目标组-Ct对照组),计算2-△△Ct,2-△△Ct=2-(△Ct目标组-△Ct对照组),其数值表示目的基因表达值相对于参照表达值的相对倍数。
1.2 免疫组织化学
1.2.1 一般资料 选取吉林大学第一医院泌尿外科2007年1月—2010年1月手术切除并经病理证实的RCC标本66例,其中男性43例,女性23例,年龄29~83岁,平均年龄56岁。病理分期采用2002年AJCC肾癌分期系统分为:pT1 18例,pT2 24例,pT3 17例,pT4 7例;组织学分级采用Furhman标准分级:Ⅰ级22例,Ⅱ级22例,Ⅲ级22例,所有患者术前均为原发肾癌,术前均未接受放疗、化疗或免疫治疗。以癌旁正常肾组织作为对照组。所有标本均经10%甲醛固定,石蜡包埋。
1.2.2 试剂 hMOF蛋白一抗为Bethyl公司生产的hMOF蛋白抗体(编号:IHC-00497),抗体工作比例均为1∶250。
1.2.3 方法 采用免疫组化染色,将常规石蜡包埋的蜡块,每例做2 μm连续切片2张,分别行HE染色与免疫组织化学法(LSAB方法)染色。将切片置于有保护膜的载玻片上,常规脱蜡,逐级水化,用0.3% H2O2阻断内源性过氧化物酶30 min,微波炉沸腾10 min,再将切片行常规LSAB法染色。用已知阳性切片作为阳性对照,以磷酸盐缓冲液代替一抗作为阴性对照。
1.2.4 结果判定 采用双盲法,由2位有丰富临床经验的病理医师进行。hMOF以细胞核着色、呈棕黄色或棕褐色颗粒为阳性;根据染色强度与阳性细胞比率双评半定量法进行评分,A:阳性细胞百分率<10%为0分,10%~30%为1分,31%~50%为2分,51%~75%为3分,>75%为4分;B:根据切片染色程度进行评分,未染色为0分,浅黄色为1分,黄色为2分,棕黄色为3分。最后根据阳性细胞率的得分与染色程度得分相乘作为结果进行判定,0分定为阴性(-),1~4分为弱阳性(+),5~8分为阳性(),9~12分为强阳性()。本实验中采用免疫组织化学染色评分≤4分和>4分2组进行比较。
1.3 统计学分析
采用SPSS 12.0统计软件进行统计分析,计数资料和率的比较采用四格表精确概率法和χ2检验。
2 结 果
2.1 qRT-PCR检测结果
9例RCC组织中,4例(44.4%)hMOF mRNA表达水平较其癌旁正常肾组织下降2倍以上(即log2<-1),其中FuhrmanⅡ级1例,FuhrmanⅢ级3例。RCC组织中hMOF的表达量明显低于正常肾组织。见图1。
2.2 免疫组织化学染色结果
RCC组织中hMOF表达量明显低于正常肾组织,差异具有统计学意义(P<0.05)。FuhrmanⅢ级中hMOF表达明显低于FuhrmanⅠ~Ⅱ级,差异具有统计学意义(P<0.05)。中低分化RCC组织hMOF表达明显低于高分化组,差异具有统计学意义(P<0.05)。见图2(插页四)。
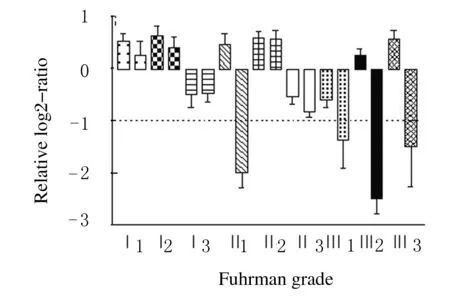
图1 qRT-PCR分析结果
2.3 hMOF蛋白表达水平与RCC患者临床特征的关系
根据RCC组织中hMOF蛋白表达水平的综合免疫组织化学评分,将患者分为hMOF综合免疫组织化学评分≤4分和>4分2组。比较2组间临床资料的特点,不同年龄及性别的患者肾癌组织中hMOF蛋白表达量相差不大,差异无统计学意义(P>0.05)。hMOF蛋白随肾癌组织Fuhrman 分级及病理分期的增高表达量下降,差异具有统计学意义(P<0.05)。同时,hMOF蛋白表达水平降低的肾癌患者其区域淋巴结及远处器官转移的风险增高。见表1。
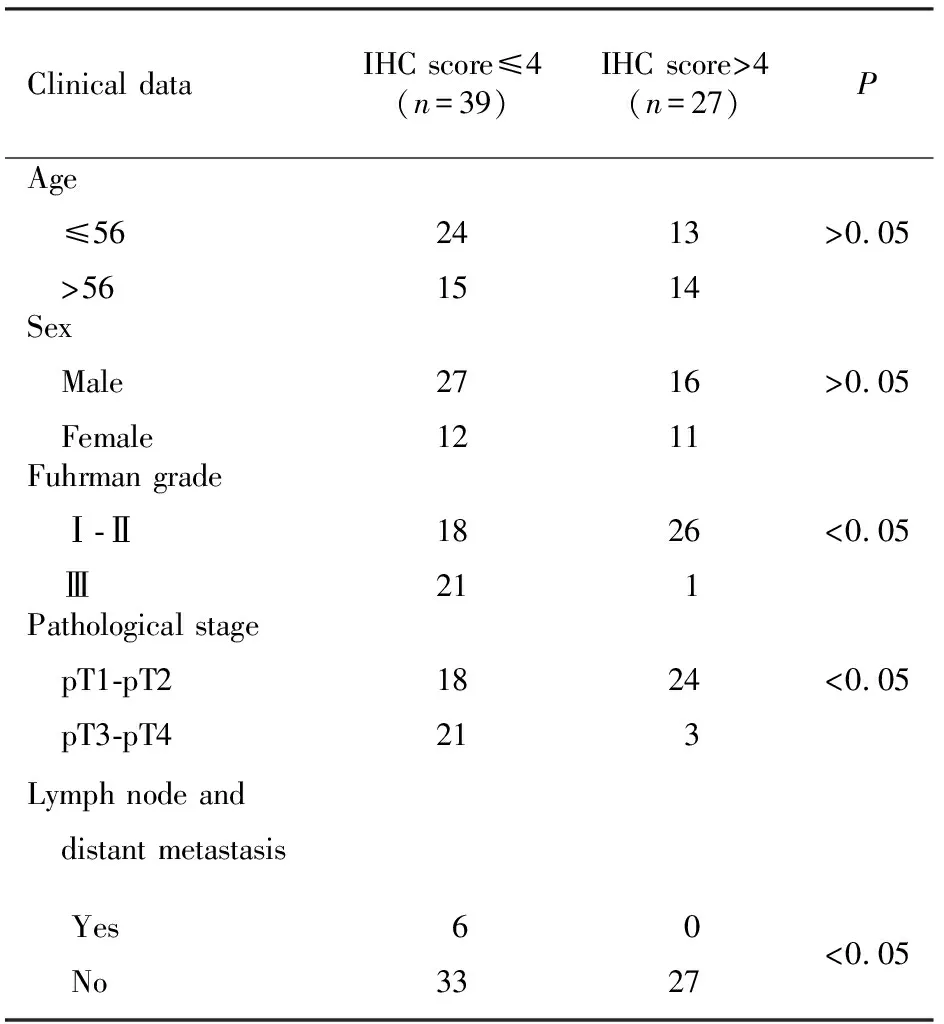
表1 hMOF蛋白表达与肾癌患者临床病理特征的关系
3 讨 论
基因有序的转录调控是机体细胞维持正常功能的前提,如果基因转录调控功能紊乱,细胞可能发生癌变。遗传调控和表观遗传调控共同控制真核基因的表达。随着人们对疾病认识的进一步加深,表观遗传疾病越来越受到重视。表观遗传是指基于非基因序列改变所致基因表达水平的变化,即基因型未发生变化而表型却发生了改变[4]。表观遗传调控主要包括DNA甲基化、RNA干涉、组蛋白修饰等方面,其中组蛋白修饰引起的染色体局部构象的改变,在真核生物基因表达调控中发挥着重要的作用。组蛋白修饰主要包括对组蛋白尾部的赖氨酸和精氨酸残基的乙酰化、甲基化、磷酸化和泛素化。其中组蛋白的乙酰化修饰较为普遍。组蛋白乙酰化修饰直接影响核小体的结构,并为其他蛋白提供了和DNA作用的结合位点[5]。如果组蛋白乙酰化修饰出现了问题,基因组的蛋白表达将发生问题,从而导致癌症的发生。调控组蛋白乙酰化和去乙酰化的是一对功能相互拮抗的酶—HATs和HDACs。HATs主要是在组蛋白H3、H4的N端尾上的赖氨酸加上乙酰基,而HDACs则相反。两者之间的动态平衡调控基因表达的稳定[6]。任何一方的功能失调,都将导致人类疾病甚至恶性肿瘤的发生。乙酰化酶的突变可引起正常基因不能表达使抑癌基因或调节细胞周期的蛋白出现异常,导致癌症发生。去乙酰化酶突变或一些和去乙酰化酶相关蛋白的突变使去乙酰化酶错误募集而引发肿瘤等疾病[7]。
HATs可归于两大类:一类是GNAT家族,另一类是MYST家族。hMOF是MYST HATs家族的成员,又称MYST1。MYST HATs家族是近年来发现的一个在细胞核内广泛存在、并有着重要生物学功能的HATs 家族[8]。MYST家族对于维持细胞的正常生理活动具有十分重要的作用。hMOF蛋白最基本的功能是乙酰化组蛋白H4第16位赖氨酸,进而产生一系列的生物学作用。60%的组蛋白H4呈单乙酰化状态,并且多数发生在组蛋白N端第16位赖氨酸(K16)[9],即H4K16Ac。体外和体内实验[10]表明:hMOF介导的组蛋白H4K16乙酰化活性是染色体模板正确转录所必需的。大量的研究结果表明:恶性肿瘤的发生、发展与癌基因、抑癌基因异常密切相关,组蛋白乙酰化修饰直接影响癌基因的激活和(或)抑癌基因的失活。所以组蛋白乙酰化修饰的研究有助于进一步明确恶性肿瘤的发生、发展机制。目前的研究[11]结果显示:hMOF蛋白表达异常可能导致乳腺癌、成神经管细胞瘤等恶性肿瘤的发生,并提示其有可能成为肿瘤术后辅助治疗的关键生物学指标。本研究结果显示:hMOF蛋白的mRNA表达量在癌组织中明显降低,与Pfister等[11]研究的原发性乳腺癌和成神经管细胞瘤的结果具有相同的趋势,提示hMOF蛋白在肾癌组织表达降低发生在转录水平。目前尚无关于hMOF蛋白转录水平降低原因的报道,有待于进一步研究,可以从DNA转录的起始部位即启动子的角度进行研究来揭示导致hMOF蛋白表达量降低的原因及其与癌症发生、发展的关系。
本研究中hMOF蛋白在肾癌组织中表达免疫组织化学评分≤4分为62.1%(39/66),而hMOF蛋白在癌旁组织中表达免疫组织化学评分≤4分仅为6.1%(4/66),提示hMOF表达的降低是引起RCC发生的一个重要因素;另外中低分化RCC组织中hMOF表达量明显低于高分化组,提示hMOF表达的高低与肿瘤恶性程度呈负相关,即肿瘤的恶性程度越高,hMOF的表达量越低。揭示hMOF表达量的降低可促使肿瘤的进一步发展。此外,由于RCC根治术后局部复发率仅为1%~2%[12],本研究66例RCC患者仅有6例出现了肾门淋巴结转移或远处器官的转移,鉴于病例数量较少,随访时间较短,目前尚无法通过多变量回归分析来确定hMOF蛋白作为分子标志物判断肾癌患者预后的有效性。随着病例数量的增加、随访时间的延长,这一问题将会得到进一步明确。
综上所述,hMOF蛋白表达异常与肾癌发生、发展有关,可能作为判定肾癌恶性程度的一项客观指标,对肾癌的诊断及预后判断具有重要意义。
[参考文献]
[1]Taipale M,Rea S,Richter K,et al.hMOF histone acetyltransferase is required for histone H4 lysine 16 acetylation in mammalian cells[J].Mol Cell Biol,2005,25 (15):6798-6810.
[2]Sykes SM,Mellert HS,Holbert MA,et al.Acetylation of the p53 DNA-binding domain regulates apoptosis induction[J].Mol Cell,2006,24(6):841-851.
[3]Lival KJ,Schmittgen TD.Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T) method [J].Methods,2001,25(4):402-408.
[4]Li XZ,Wu LP,Callie A,et al.Two mammalian MOF complexes regulate transcription activation by distinct mechanisms[J].Mol Cell,2009,36(2): 290-301.
[5]Li X,Corsa CA,Pan PW,et al.MOF and H4 K16 acetylation play important roles in DNA damage repair by modulating recruitment of DNA damage repair protein Mdc1[J].Mol Cell Biol,2010,30(22):5335-5347.
[6]Ikura T,Ogryzko VV,Grigoriev M,et al.Involvement of the TIP60 histene acetylase complex in DNA repair and apoptosis[J].Cell,2000,102(4):463-473.
[7]Dang WW,Steffen KK,Perry R,et al.Histone H4 lysine 16 acetylation regulates cellular lifespan[J].Nature 2009,459:802-808.
[8]Cai Y,Jin J,Swanson SK, et al.Subunit composition and substrate specificity of a MOF-containing histone acetyltransferase distinct from the male-specific lethal (MSL) complex[J].J Biol Chem,2010,285(7):4268-4272.
[9]Thomas T,Dixon MP,Kueh AJ,et al.Mof (MYST1 or KAT8) is essential for progression of embryonic development past the blastocyst stage and required for normal chromatin architecture[J].Mol Cell Biol,2008,28(16):5093-5105.
[10]Dou Y,Milne TA,Tackett AJ,et al.Physical association and coordinate function of the H3K4 methyltransferase MLL1 and the H4K16 acetyltransferase MOF [J].Cell,2005,121(6):873-885.
[11]Pfister S,Rea S,Taipale M,et al.The histone acetyltransferase hMOF is frequently downregulated in primary breast carcinoma and medulloblastoma and constitutes a biomarker forclinical outcome in medulloblastoma[J].Int J Cancer,2008,122(6):1207-1213.
[12]Levy DA,Slaton JW,Swanson DA, et al.Stage specific guide-line for surveillance after radical nephrectomy for local renal cell carcinoma[J].J Urol,1998,159(4):1163-1167.

