高粱BTx623幼苗多酚氧化酶Real-time PCR引物扩增效率的检测
蔡玉笑,张志雯,秦素平,陈于和
(河北科技师范学院生命科技学院,河北秦皇岛,066600)
实时荧光定量PCR(Real-time PCR)技术在检测基因表达中起到重要的作用,其检测结果灵敏性高,操作简便,已被广大科研人员所广泛应用[1,2]。但在具体操作过程中经常出现重复性不稳定的现象,这与引物的扩增效率有直接关系[3~6]。PPO包含2个铜离子保守结构域,由细胞核基因编码然后运输到质体中。PPO的活性部位主要在N-结构域,由酪氨酸修饰[7]。近年来,关于多酚氧化酶的生化特性和反应机理的报道很多[8]。在菌类中,人们报道了很多关于PPO抑制剂,及其在生物工程及生物技术中可能的临床应用[9,10]。另外,对于多酚氧化酶蛋白二级结构也有了新的研究,其结构酷似软体动物的血蓝蛋白[11]。同时,人们对多酚氧化酶活性和生物抗逆性也有了很深的认识,但在高粱幼苗中SbPPO的表达情况还不是很清楚,本试验对高粱BTx623幼苗中的SbPPO家族的表达模式进行了探索。
1 材料与方法
1.1 材料
挑选高粱品系BTx623籽粒大且饱满的种子,在室温下培养1周,提取总RNA,8种连有200~300 bp外源高粱多酚氧化酶基因的片段和一个Actin基因片段的pGEM-Teasy质粒作为模板,用每一质粒的特异引物进行扩增。
1.2 引物设计
利用软件Primer Premier 5在8个高粱籽粒多酚氧化酶基因和1个Actin基因的非保守区设计特异引物(表1)。

表1 特异引物
1.3 试剂
SYBR-Green购自Takara公司,Tripure购自罗氏公司,逆转录酶购自Promega公司。
1.4 质粒浓度稀释
将9种质粒分别先稀释到10-8ng/L。
分别各取2 μL质粒定容到20 μL,将质粒稀释到10-9ng/L。
同样的方法将9 种质粒分别稀释到 10-10,10-11,10-12ng/L。
1.5 荧光定量PCR反应体系
在灭菌的 Eppendorf管中加入1 μL 模板,然后分别加入正反向引物0.3 μL,SYBR 10 μL 和8.4 μL灭菌的双蒸水;以水为空白对照。
1.6 实时荧光定量PCR的扩增程序
根据荧光定量PCR仪(德国Hamburg公司Eppendorf5334型)的说明,设置35个实时荧光定量PCR反应循环和适应的退火温度。
反应程序:
步骤1 95℃预变性 2 min
步骤2 95℃变性 15 s
步骤3 合适的退火温度 15 s
步骤4 回到步骤2 35个循环
步骤5 68℃ 20 min
以公式E=Power(10,-1/slope)-1计算引物的扩增效率。
1.7 总RNA提取与cDNA第一链的合成
1.7.1 应用Tripure法提取总RNA 整株幼苗置于放有钢珠的2 mL管中,加入液氮迅速用组织研磨器磨碎。
加入1 mL Tripure试剂,室温放置5~10 min。
4℃,12 000 g离心10 min,取上清。加入200 μL氯仿,充分混匀,室温放置5 min。
4℃,12 000 g离心10 min,取上清。加入500 μL异丙醇,轻轻上下混匀,室温放置10 min。
4℃,12 000 g离心10 min,弃上清,体积分数为0.70的乙醇洗涤沉淀2次,室温干燥。
加入50 μL DEPC处理过的ddH2O,溶解沉淀。
检测RNA的质量,合格的RNA用于后续试验。
1.7.2 cDNA第一链的合成 在灭菌的Eppendorf管中顺序加入6 μL总RNA和3 μL oligo(dT)18(10 mmol/L)。
70℃水浴10 min,然后迅速置于冰上冷却。
顺序加入以下溶液:12 μL 5×逆转录缓冲液,6 μL dNTPs(10 mmol/L),补水至总体积58 μL。
37℃温育2 min。
加入2 μL M-MLV逆转录酶,混匀,37℃反应1 h。
反应结束后,将离心管取出,70℃处理15 min灭活逆转录酶。
反应合成的cDNA第一链可用作PCR反应的模板。
2 结果与分析
2.1 9对引物的标准曲线
9对引物分别扩增对应一系列浓度梯度模板,以模板浓度拷贝数的对数值为横坐标,以达到设定荧光阈值的循环数为纵坐标绘制9对引物的标准曲线(图1),该曲线可用于实时荧光定量PCR样品中目的拷贝数的计算中。在本试验中,其斜率可用于计算引物的扩增效率。
2.2 9对引物的扩增效率
不同的试验前提下,对real-time PCR引物的扩增效率要求不同。9对引物的扩增结果以公式E=Power(10,-1/slope)-1计算引物的扩增效率(表2)。在相对定量中要求引物的扩增效率与内参引物的扩增效率都接近于1,且相差不超过5%,可将PCR扩增效率默认为100%,这样将相对定量的计算公式就简化为2-ΔΔCt。本试验中引物1,引物4,引物7的引物扩增效率均接近于1,可以很好的用于下游试验。
2.3 总RNA的质量
各取1 μL RNA在紫外分光光度计下检测OD260/280,OD260/230,排除基因组DNA和蛋白的污染。本试验中OD260/280,OD260/230的比值均小于2.0,保证试验结果的真实可靠(表3)。
在试验中,RNA的降解会直接导致试验结果的失真。各取1 μL RNA样品,进行琼脂糖凝胶电泳,3条目的条带清晰可见为质量合格RNA,所提总RNA中未出现降解(图2)。
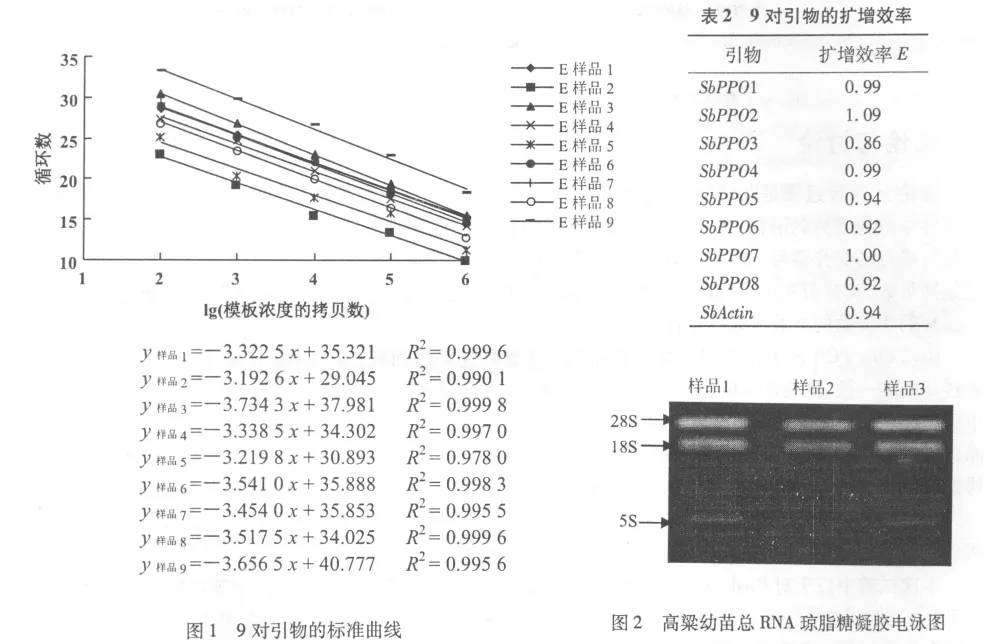

表3 高粱幼苗总RNA的纯度检测
2.4 BTx623幼苗中多酚氧化酶基因的表达
本研究选用上述9对引物,以高粱看家基因SbActin(NCBI登录号:X79378)的表达量为参照因子,利用计算公式2-ΔΔCt,幼苗中 SbPPO 的表达研究中发现:SbPPO2,SbPPO5和SbPPO6的表达量较高;SbPPO3,SbPPO4,SbPPO8的表达量很低(图3)。
本次试验验证了基因在功能上的分化,这与前人在研究其他物种的PPO的表达模式的结论相一致,即PPO一般以基因家族的形式存在,PPO的表达具有时间和空间上的特异性,同一物种中不同PPO家族成员的表达量也不相同。本次试验严控幼苗的生长环境,保证无虫害损伤等环境压力。SbPPO2,SbPPO5和SbPPO6可能在幼苗的生长过程中起到重要的作用,需要进一步的试验证明。
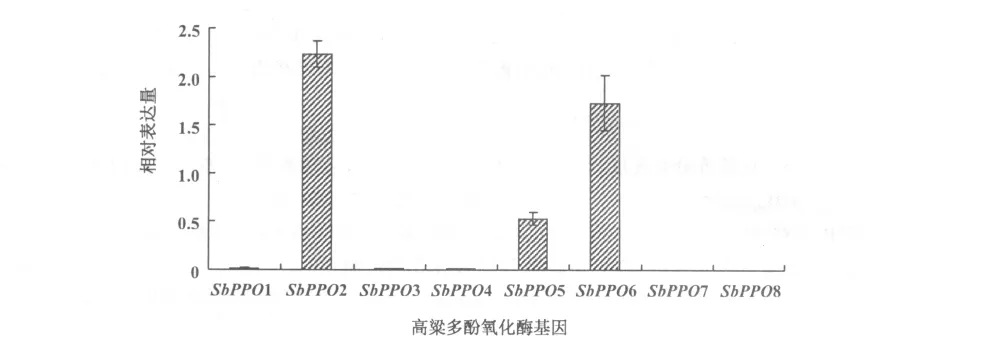
图3 SbPPO在高粱BTx623幼苗中的相对SbActin表达量
3 结论与讨论
理论上PCR过程是以2n(n代表PCR反应的循环数)方式进行扩增。但在实际反应过程中,随着反应体系中各成分的消耗(主要是由于聚合酶活力的衰减)使得反应并非按指数方式扩增,因此起始模板量与终点的荧光信号强度间没有可靠的相关性。为了能准确判断样品中某基因转录产物(mRNA)的起始拷贝数,实时荧光定量PCR采用新的参数——Ct值(循环数),定量的基本原理是Ct值与样品中起始模板的拷贝数的对数成线性反比关系。
Real-time PCR技术在使用过程中经常会出现重复性差的问题,这与很多因素有关,诸如SYBR或者样品的均一性,反应体系的污染、PCR仪未经校正、引物的特异性差以及扩增效率低等各种原因。其中引物的扩增效率是影响Real-time PCR重复性高低的重要因素。本次试验以十倍稀释法制备均一样品,严格遵守试验操作避免样品污染,试验数据3次重复,并根据质粒样品的分子量大小计算出样品的拷贝数,用Excel处理数据。
本次研究中采用SYBR Green产生的荧光信号进行样品定量,在试验前要求设计高质量的特异性引物,在PCR反应程序中增设融解曲线,可以较好的判断引物的特异性。
本次试验中以9对Real-time PCR特异性引物分别扩增不同的质粒模板,检测到引物1,引物4和引物7的扩增效率较好,接近于1;建立了一套较完备的检测Real-time PCR引物扩增效率的体系。本次试验中的数据均为3次独立重复试验的结果。结果证明本次试验中的9对引物为特异性较好引物。
在前人的研究中发现PPO存在诱导及潜伏性[12],本次试验中发现在幼苗生长的早期SbPPO2,SbPPO5和SbPPO6的相对表达量较高,这可能是由于他们在高粱苗期中起到重要作用。前人研究发现多酚氧化酶一般存在于植物正在发育的幼嫩组织及分生组织中,其同一基因家族的每一个基因也有各自不同的时空表达模式,表明这些基因的功能不完全相同[12]。同时,这3个基因可能是高粱苗期的组成型PPO[13,14],其它SbPPO可能是诱导型PPO。一般情况下,诱导型PPO充当防御性抗营养蛋白的功能,而组成型PPO具有防御昆虫进攻的作用[15]。Goodman等对其克隆的4个香蕉多酚氧化酶基因BPO1,BPO11,BPO34,BPO35做了表达分析,Northern杂交表明BPO1的表达量最高并且存在于果肉发育早期,而果皮中未检测到;BPO1在未伸展的叶、花、根、茎中高度表达但在成熟叶片中检测不到。BPO11只在幼龄的果肉中有mRNA信号,BPO34,BPO35在发育果实中无转录,在花和根中有微弱的信号,成熟叶片中只有BPO34表达。对其他植物PPO研究中也发现类似的现象[16,17,18],与笔者的研究结果一致。
[1]MORRISON T,WEIS J J,WITTER C T.Quantification of low-copy transcripts by continuous SYBR Green I monitoring during amplification[J].Biotechniques,1998(24):954-962.
[2]MICHAEL W P.A new mathematical model for relative quantification in real-time RT-PCR[J].Nucleic Acids Research,2001(29):2 002-2 007.
[3]JO V,KATLEEN D P,FILIP P,et al.Accurate normalization of real-time quantitative RT-PCR data by geometric averaging of multiple internal control genes[J].Genome Biology,2002,3(7):0034.1-0034.11
[4]HEID C A,STEVENS J,LIVAK K J,et al.Real time quantitative PCR[J].Genome Res,1996(6):986-994.
[5]ANNAPAULA G,LUT O,DIRK V,et al.An overview of real-time quantitative PCR:applications to quantify cytokine gene expression[J].Methods,2001(25):386-401.
[6]KENNETH J L,THOMAS D S.Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCt[J].Method,2001,25:402-408.
[7]MAYER A M.Polyphenol oxidases in plants and fungi:Going places? [J].A review Phytochemistry,2006,67:2 318-2 331.
[8]QUEIROZ C,LOPES M L M,FIALHO E,et al.Polyphenol oxidase:Characteristics and mechanisms of browning control[J].Food Rev Int,2008,24:361-375.
[9]YU Y,TANG T,QIAN Q,et al.Independent losses of function in a polyphenol oxidase in rice:differentiation in grain discoloration between subspecies and the role of positive selection under domestication[J].Plant Cell,2008,20:2 946-2 959.
[10]TAKETA S,MATSUKI K,AMANO M,et al.Duplicate polyphenol oxidase genes on barley chromosome 2H and their functional differentiate on in the phenol reaction of spikes and grains[J].J Exp Bot,2010,61:3 983-3 993.
[11]PARK S J,HUANG Y H,AYOUBI P.Identification of expression profiles of sorghum genes in response to greenbug phloem-feeding using cDNA subtraction and microarray analysis[J].Planta,2006,223:932-947.
[12]吴瑜凡,卢亚萍,汪瑾.植物和真菌多酚氧化酶的分子生物学研究进展[J].现代农业科技,2008(18):14-17.
[13]BUCHELI S.Polyphenol oxidase is induced by chilling and wounding in pineapple[J].Australian Journal of Plant Phsiology,2001,28(3):181.
[14]HARUTA.Polyphenol oxidase and herbivore defense in trembling aspen(Populus tremuloides)[J].Physiologia Plantarum,2001,112(4):552.
[15]CONSTABEL C P.A survey of wound-and jasmonate-induced leaf polyphenol oxidase in crop plants[J].Phytochemistry,1998,47(4):507.
[16]GOLDMAN M H S,SEURINK J,MARINS M.A tobacoo flower specific gene encodes a polyphenol oxidase[J].Plant Mol Biol,1998(36):479-485.
[17]BOSS P K,GARDNER R C,JANSSEN B J,et al.An apple polyphenoloxidase cDNA is up-regulated in wounded tissues[J].Plant Mol Biol,1995(27):429-433.
[18]DRYIB L,ROBINSON S P.Molecular cloning and characterization of grapeberry polyphenol oxidase[J].Plant Mol Biol,1994(26):495-502.

