镉胁迫对茶园土壤中养分和微生物区系及生理群的影响
窦昭敏,丁 芳,李祥祥,程东华,王世强
(黄山学院生命与环境科学学院,安徽 黄山 245041)
镉(Cd)是一种稀有分散元素,被视为土壤环境中的最有害的重金属元素之一。近年来,全球范围酸沉降日益严重,加上酸性肥料,农药及农用污泥在农业中的大量使用,大大加速了土壤和沉淀物中Cd2+的释放[1];同时Cd2+的释放又刺激植物根系有机酸的分泌从而加速土壤的酸化[2]。Cd2+还具有致突变作用,可导致DNA断裂[3]。土壤中的Cd2+可被土壤微生物所富集或被植物吸收,抑制植物生长并导致其死亡;研究发现茶树对Cd2+有较强的富集能力[4-6],且可通过食物链进入人体,对人体健康造成威胁。
目前,有关Cd2+对土壤中微生物生态特征变化、种群演变及土壤酶活性影响的研究甚少,试验通过在茶园土壤中添加不同量的Cd2+,探讨土壤重金属Cd2+污染对土壤养分、微生物种群数量的影响及其相互关系,旨在为土壤环境指标的确定和以微生物活性作为茶园土壤重金属Cd2+污染程度的早期预测预报指标提供基础资料,也可为Cd2+污染茶园土壤的生物修复提供依据。
1 材料与方法
1.1 土样采集
茶园土壤于2011年7月采自安徽休宁商山乡,植茶年限约40 a。取样时铲去土表层4~5 cm,采样深度5~20 cm。土壤装入黑色无菌大塑料袋中,及时带回实验室前处理和测定土壤理化性质。
1.2 土壤处理
土壤装在无菌塑料袋中,经反复搓揉粉碎、混合;测得混合土壤pH值为4;除一部分留作土壤背景化学性质测定用外,其余土壤在无菌室中分装入12个带盖的无菌塑料桶中,每桶装2 kg。12个桶平均分为两组,一组将土壤pH值调节到5,另一组pH值不变,然后以喷雾方式加入不同添加量的Cd2+,搅拌均匀后,于25℃室温下培养10 d分别取样,测其pH值、养分含量、微生物各生理群数量。以不添加Cd2+的土壤为对照。
1.3 土壤化学性质分析
将土样风干后测定其化学性质,其中pH值用酸度计法;有机质用重铬酸钾外加热法测定;速效氮用碱解扩散法测定;速效磷用NH4F-HCl法测定;速效钾用醋酸铵浸提—原子吸收法测定。
1.4 土壤稀释液的制备
称取土壤10 g,加入装有玻璃珠的90 mL无菌水中,振摇20 min,制成10-1g/mL土壤稀释液,再分别稀释得到 10-2、10-3、10-4、10-5、10-6、10-7g/mL 土壤稀释液,每个稀释度设3个重复。所有操作在超净工作台上以无菌操作的方式进行。
1.5 土壤微生物区系及微生物生理类群的测定
微生物数量测定采用稀释涂布菌落计数法,其中细菌采用牛肉膏蛋白胨培养基;真菌采用马丁氏孟加拉红培养基;放线菌采用高氏1号培养基。细菌在30℃培养3 d计数,真菌在28℃培养5 d计数,放线菌28℃培养7 d计数;亚硝化细菌采用亚硝酸细菌分离培养基,反硝化细菌采用反硝化细菌分离培养基,这两类菌的数量采用液体分离法在30℃下培养14 d后计数,结果以3次重复数量指标表计算其数量[7-8]。
2 结果与分析
2.1 Cd2+添加量对土壤化学性质的影响
从表1可知:茶园土壤pH值从4调节至5时,土壤碱解氮、有效磷和速效钾均降低,而有机质变化不大。随Cd2+添加量的增加,土壤pH值呈降低趋势,在pH值为4的土壤环境中Cd2+添加量从0增加到1 g/kg,土壤pH值只降低0.11个单位;在pH值为5的土壤环境中Cd2+添加量从0增加到1 g/kg,土壤pH值降低0.58个单位。随着Cd2+添加量增加,有效磷和速效钾整体呈下降趋势。
2.2 Cd2+添加量对土壤中微生物数量的影响

表1 Cd2+添加量对土壤化学性质的影响
2.2.1 Cd2+添加量对土壤中细菌数量的影响 细菌是土壤中数量最多的微生物种类,绝大多数细菌喜中性偏碱环境,在茶园酸性土壤环境下,细菌的数量相对较少。从图1可见,随着Cd2+添加量的升高,两种pH值环境下的细菌都呈下降趋势,但pH=5的土壤下降趋势比较明显,说明细菌对环境pH比较敏感[9]。当Cd2+添加量升高到0.8 g/kg时,与对照组相比,pH=5的土壤细菌数量下降幅度较大,仅为对照组的细菌数量1/10,此后随Cd2+添加量的继续升高细菌数量下降趋势减缓。说明茶园土壤中绝大数细菌对Cd2+是非常敏感的,但也有一部分耐镉细菌的存在。Roane等[10]通过DNA系列分析,分别对受Cd2+污染及无污染的土壤中的微生物进行检测,结果发现,Cd2+污染的土壤中分离出抗性微生物(节杆菌、芽孢杆菌属和假单孢菌)。在茶园土壤高浓度的Cd2+胁迫下,这些细菌可能通过自身代谢酶的调整来耐受较高浓度的Cd2+。
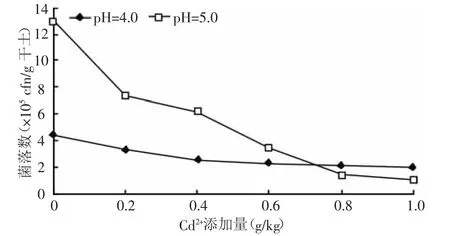
图1 不同的Cd2+添加量对土壤中细菌数量的影响
2.2.2 Cd2+添加量对土壤中真菌数量的影响 茶园土壤中的真菌主要是霉菌,也是土壤中生物量最大的部分,真菌生理上喜欢中性偏酸性环境。从图2可以看出:在两种不同pH条件下,Cd2+添加量从0~0.4 g/kg,真菌数量呈上升的趋势,但pH=4的土壤上升趋势比较明显;随Cd2+添加量的继续升高,真菌数量呈下降趋势,且此时数量只略低于不添加Cd2+的对照组。说明Cd2+在低浓度对某些霉菌的生长有促进作用,高浓度下则起抑制作用,但真菌在高浓度下能够生活,其结果与Baath[11]等研究结果相符,Baath等认为可能是初级真核生物对环境的适应力和抗逆性要强于细菌和放线菌这些原核生物所致。
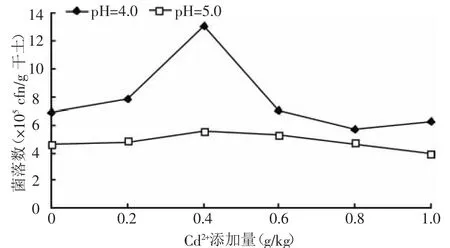
图2 不同的Cd2+添加量对土壤中真菌数量的影响
2.2.3 Cd2+添加量对土壤中放线菌数量的影响土壤中的放线菌有利于某些难分解组分的分解与腐殖质的形成,在微生物的拮抗作用和土壤生物群体组成的控制方面起着重要的作用,许多放线菌分泌的抗菌素和激素类物质对各种植物病害有一定的抑制作用。由图3可见,Cd2+添加量从0~0.4 g/kg,土壤中放线菌的数量不断上升,说明Cd2+在低添加量下对放线菌有促进作用;当Cd2+添加量继续增大时,放线菌数量又明显下降。可见低浓度下Cd2+能够促进土壤放线菌的生长,而高浓度的Cd2+则抑制放线菌的生长,这与尹军霞[12]的研究结果相符。

图3 不同的Cd2+添加量对土壤中放线菌数量的影响
2.2.4 不同的Cd2+添加量对土壤中亚硝化菌数量的影响 土壤中的硝化作用是由亚硝化细菌和硝化细菌共同完成的,土壤中亚硝化细菌的数量直接反映了硝化细菌的数量。由图4可见,随着Cd2+添加量的升高,土壤中的亚硝化细菌数量呈急剧下降趋势,显示出Cd2+对亚硝化细菌和硝化细菌的生长和繁殖有强烈的抑制作用,该作用使得土壤氮素循环受阻,导致土壤生物活性降低,土壤生物功能遭破坏,因此亚硝化细菌可以作为监测土壤Cd2+污染较好的指示生物。在土壤pH=4环境下,当Cd2+添加量>0.4 g/kg,亚硝化细菌几乎不能成活,而pH=5环境下,亚硝化细菌失活的Cd2+添加量临界值为0.8 g/kg,该差异可能与不同pH环境下有效Cd2+添加量差异有关。

图4 不同的Cd2+添加量对土壤中亚硝化细菌数量的影响
2.2.5 不同的Cd2+添加量对土壤中反硝化菌数量的影响 反硝化细菌是一类兼性厌氧微生物,与硝化细菌一样都是氮素转化的重要菌群,但反硝化细菌能造成土壤肥力的损失,对农业不利。由图5可知:在pH=5的土壤中,Cd2+添加量 0.2~0.4 g/kg,能刺激反硝化细菌的生长;但随添加Cd2+添加量进一步增加,反硝化细菌数量呈急剧下降的趋势。在pH=4环境反硝化细菌数量极少,Cd2+胁迫作用不明显。
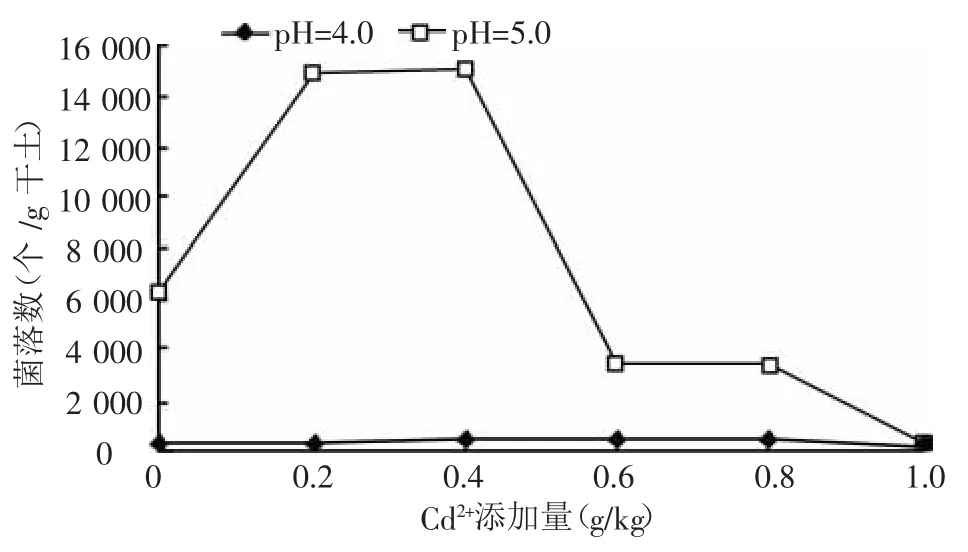
图5 不同的Cd2+添加量对土壤中反硝化细菌数量的影响
3 结论与讨论
(1)随Cd2+添加量的增加,土壤pH呈降低的趋势,有机质含量略有增高,碱解氮变化不明显,Cd2+添加量从0~1 g/kg,有效磷和速效钾整体呈下降趋势。
(2)茶园土壤中的不同微生物种类对Cd2+的敏感性不同,Cd2+添加量升至0.4 g/kg时,放线菌、真菌的数量有增加的趋势,而细菌、亚硝化细菌数量呈快速下降趋势;Cd2+添加量升至0.8 g/kg时,亚硝化细菌几乎不能成活,真菌、放线菌的数量略低于不添加Cd2+的对照组的数量。这说明适当浓度的Cd2+能刺激放线菌、真菌的生长;真菌、放线菌能忍耐较高浓度Cd2+的胁迫。
(3)在不同pH环境添加同等添加量的Cd2+,显示微生物种群数量受抑制程度及变化趋势的不同,说明了土壤的pH值降低有助于各种化学形态Cd向可交换Cd转化,导致土壤活性Cd浓度的升高,土壤pH值的升高有助于降低Cd的生物毒性[13]。随着茶园植茶年限的增加,茶树根系分泌的有机酸、茶树落叶、氮肥施入等直接导致茶树根际土壤的酸化[14],日积月累,使得茶树根际微生物数量向种群变少、数量变少、活性变弱的方向发展。因此,改良茶园土壤酸性环境是提高茶园土壤微生物数量和土壤酶活性,缓解重金属Cd污染的较好方法。
(4)Cd2+污染引起茶园土壤各微生物区系和生理类群的变化和其他类型的土壤不同,本研究反映了茶园土壤的重金属Cd2+污染的生态特征,可为茶园土壤的Cd2+污染评价提供依据和参考。
[1]廖万有.我国茶园土壤的酸化及其防治 [J].农业环境保护,1998,17(4):178-180.
[2]林海涛,史衍玺.铅、镉胁迫对茶树根系分泌有机酸的影响[J].山东农业科学,2005,(2):32-34.
[3]陈素华,孙铁珩,周启星,等.微生物与重金属间的相互作用及其应用研究[J].应用生态学报,2002,13(2):239-242.
[4]吴永刚,姜志林,罗 强.公路边茶园土壤与茶树中重金属的积累与分布[J].南京林业学学报(自然科学版),2002,26(4):39-42.
[5]Yamagata N,Shigematsu I.Cd2+Pollution in Perspective[J].Bulletin Institute of Public Health Bull Inst Public Health,1970,19(1):1-27.
[6]刘国胜,童潜明,何长顺.土壤镉污染调查研究[J].四川环境,2004,23(5):8-10.
[7]徐光辉,郑洪元.土壤微生物分析方法手册[M].北京:中国农业出版社,1986.102-125.
[8]鲍士旦.土壤农化分析(第三版)[M].北京:中国农业出版社,2005.30-86,106-163.
[9]王世强,胡长玉,程东华,等.调节茶园土壤pH对其土著微生物区系及生理群的影响[J],土壤,2011,43(1):76-80.
[10]Roane T M,Pepper I L.Microbial responses to environmentally toxic cadmium[J].Microbiology Ecology,1999,38(4):358-364.
[11]Baath E.Effects of heavy metals in soilson microbial processes and populations(a review)[J].Water,Air,and Soil Pollution,1989,47:335-379.
[12]尹军霞,陈 瑛,郑 丽.Cd2+胁迫下油菜土壤微生物区系及主要生理类群研究 [J].农业环境科学学报,2006,25(6):1529-1534.
[13]陈 媛.土壤中镉及镉的赋存状态研究进展[J].广东微量元素科学,2007,14(7):7-12.
[14]毛 佳,徐仁扣,黎星辉.氮形态转化对豆科植物物料改良茶园土壤酸度的影响[J].生态与农村环境学报,2009,25(4):42-45.

