大肠癌组织中CDK6、Ki67表达及其与临床病理因素的关系
刘寿行,刘 展,谢雪飞,方 圆,喻 宏
(湖南师范大学第一附属医院,湖南省人民医院,湖南 长沙 410005)
大肠癌是大肠的恶性上皮性肿瘤,为常见的消化道肿瘤之一,是大肠粘膜上皮在遗传和环境等多种致癌因素作用下发生的恶性改变的渐进过程,近年来发病率不断提高[1]。
目前研究认为肿瘤发生的本质可能是细胞周期调节失控,细胞呈自主的、无限制的增殖。细胞周期进程的实现依赖于细胞周期的内源性调控,主要是通过磷酸化和去磷酸化为基础的周期素、周期素依赖性激酶(CDKs)、CDK抑制剂途径实现的,其核心机制是CDKs活性的表达和调控。CDK6是G1期的重要调控分子之一。它能够特异性地与周期蛋白D结合形成复合物[2]。Ki67抗原是应用广泛的增殖细胞标记之一[3],是评估人类各种组织增殖组分的可靠和简单的方法,常用Ki67标记指数来表示。但是关于CDK6和Ki67在大肠癌组织中表达联合检测的相关研究尚未见报道。本研究拟探讨大肠癌组织中CDK6、Ki67蛋白的表达及与其大肠癌病理因素的关系及二者之间的相关性。
1 材料与方法
1.1 材料
收集2011年1月~2011年11月湖南省人民医院普外科经手术切除的结、直肠癌标本组织84例及相匹配的距肿瘤大于5cm以上的手术切缘正常大肠组织标本48例(均经术后病理证实);同时收集患者同期相关临床资料,所有患者术前均未行放、化疗。患者男性54例,女性30例,年龄21~82岁,平均年龄60.33岁,结肠癌50例,直肠癌34例。
1.2 方法
84例大肠癌标本及匹配的切缘正常大肠粘膜组织标本48例,经10%中性福尔马林固定、脱水、透明、浸蜡、包埋制成石蜡块。设定切片厚度为4 μm,行连续切片形成3个蜡带,分别用于HE染色、CDK6、ki67免疫组化染色,HE染色后按照世界卫生组织肿瘤学分类[4]标准将大肠癌按组织学分级标准分为:低度恶性组59例(高分化3例+中分化56例)、高度恶性组25例(包括低分化腺癌18例、印戒细胞癌1例,粘液腺癌6例),结合患者临床资料进行Dukes分期:按我国大肠癌协作组方案[5]分为A期13例、B期27例、C期23例、D期21例。
免疫组织化学染色方法按照即用型非生物素免疫组化ElivisionTM Super检测试剂盒说明书进行,以0.01M PBS代替一抗作为阴性对照,用已知多次对照有效的乳腺癌阳性切片作为阳性对照。非生物素免疫组化检测试剂盒、二氨基联苯胺(DAB)显色剂及Ki67即用型兔抗人单克隆抗体均购自福州迈新生物技术有限公司,CDK6浓缩型兔抗人多克隆抗体(工作浓度1:200)购自北京博奥森生物技术有限公司。
1.3 结果判定
采用双盲法,由两名有经验的病理医师分别阅片,如有分歧则经讨论之后达成一致,CDK6蛋白及Ki67蛋白表达以细胞核内可见淡黄色至棕黄色颗粒为阳性,单纯细胞质着色或细胞核细胞质均无着色为阴性,参考Kawasaki[6]和Sinicrope[7]的方法制定免疫组化半定量积分标准:染色强度和阳性细胞数所占的百分率两项评分指标相乘。
阳性细胞数所占的百分率计分标准:低倍镜下观察着色的大肠癌上皮区域;高倍镜下每张切片随机选择10个完整而不重叠的视野,观察阳性细胞数占整格肿瘤细胞的百分数比例(每格高倍视野计数100个肿瘤细胞中的阳性细胞数,计算其平均数)。分为5组:<5%计为O分,5%-25%为1分,26%-50%为2分,51-75%为3分,>75%为4分。染色强度计分标准:无着色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分。两项积分相乘,所得乘积分为4个级别,0分记"-"为阴性,1-4分记"+"为弱阳性,5-8分记"++"为阳性,9-12分以上记"+++"为强阳性。
1.4 统计学处理
采用SPSS 17.0统计软件包进行统计学处理,率的比较采用χ2检验、χ2检验的校正公式和Fisher精确概率法,等级资料的相关性分析采用Spearman等级相关检验,检验水准为α=0.05,P<0.05为差异具有统计学意义。
2 结果
2.1 CDK6在大肠癌组织和切缘大肠正常组织中的表达情况
共分析了84例大肠癌组织和48例切缘正常大肠组织中CDK6的表达,结果显示,CDK6主要在细胞核内表达,胞浆也部分表达,如图1所示。大肠癌组织中CDK6表达的阳性率为88.1%(74/84),切缘正常大肠组织中CDK6表达的阳性率为10.4%(5/48)。大肠癌组织中CDK6表达的阳性率比切缘正常大肠组织中高,差异具有统计学意义(χ2=76.7,P<0.005)。 见表 1。
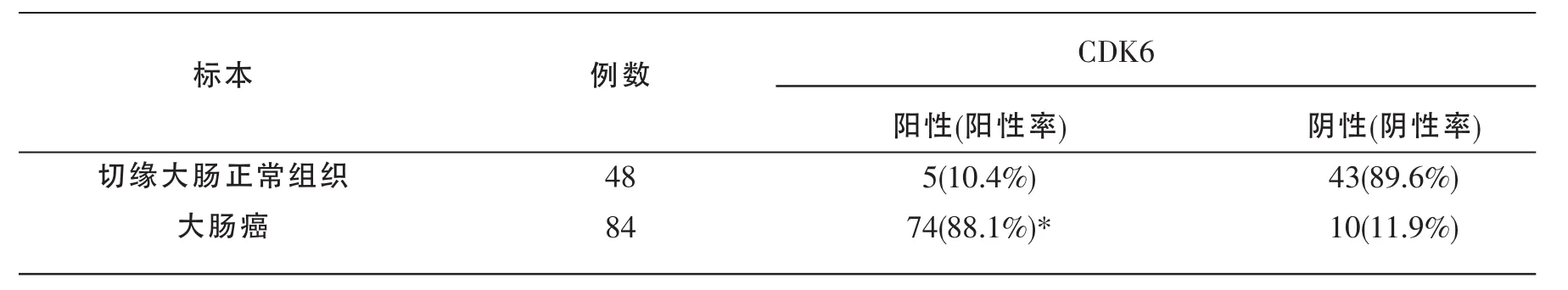
表1 大肠癌组和切缘正常大肠粘膜组中CDK6表达情况
2.2 Ki67在大肠癌组织和切缘大肠正常组织中的表达情况
结果显示,Ki67在细胞核内表达,如图2所示。大肠癌组织中Ki67表达的阳性率为92.9%(78/84),切缘正常大肠组织中Ki67表达的阳性率为20.8%(10/48)。在大肠癌组织中Ki67表达的阳性率比切缘正常大肠组织中高,差异具有统计学意义(χ2=71.304,P<0.005)。 见表 2。
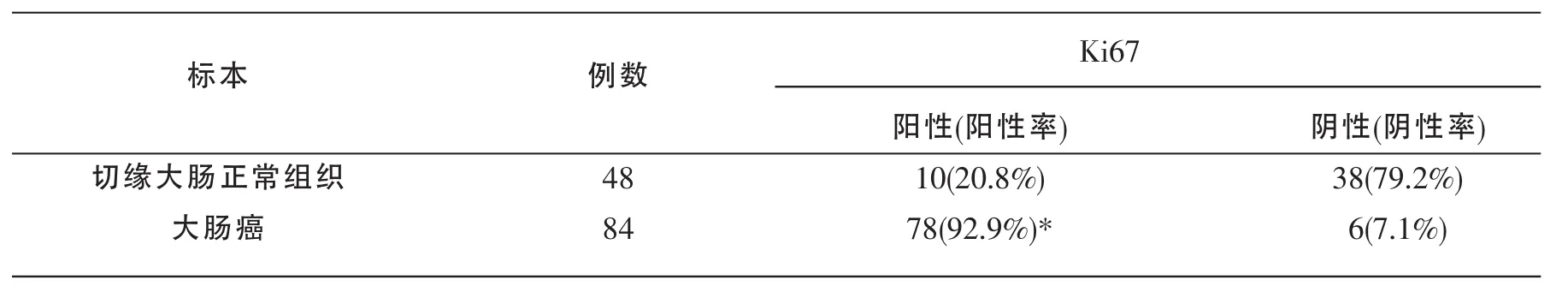
表2 大肠癌组和切缘正常大肠粘膜组中Ki67表达情况
2.3 CDK6、Ki67表达与大肠癌临床病理因素的关系
由表3可见,CDK6蛋白表达阳性率与肿瘤浸润深度、Dukes分期、淋巴结转移、肿瘤分化程度有关,差异具有统计学意义(P<0.05);与患者年龄、性别、肿瘤发生部位、肿瘤大体类型无关 (P>0.05)。Ki67蛋白表达与患者年龄、性别、肿瘤部位、肿瘤大体形态、浸润深度、Dukes分期、肿瘤分化程度及淋巴结转移之间无明显相关性(P>0.05)。
2.4 CDK6与Ki67在大肠癌组织中表达的相关关系
84例大肠癌中CDK6及Ki67的表达如下表所示,双变量的等级资料之间的相关关系分析属于非参数统计方法,采用Spearman秩相关分析,使用等级相关系数r来说明CDK6及Ki67两个变量间直线相关关系的密切程度与相关方向。经统计学分析,CDK6与Ki67在大肠癌中的表达呈正相关关系 (r=0.581,P=0.000),在大肠癌组织中Ki67蛋白表达的强度随CDK6表达强度的增强而升高。结果见表4。
3 讨论
大肠癌是胃肠道常见的恶性肿瘤,其发病率呈逐渐增长趋势。随着2001年的诺贝尔医学和生理学奖授予了发现细胞周期调节蛋白依赖激酶(cyclin dependent kinases,CDKs)和细胞周期调节蛋白(Cyclins)及其有关分子的科学家,CDKs和Cyclins及其相关分子成为了目前细胞周期调控研中的热点[8]。1994年,研究者发现人类脊椎动物cdc-2相关激酶家族的一个新成员:CDK6[9]。CDK6基因位于人类七号染色体上,包含7个外显子,编码40kDa的蛋白质。CDK6是G1期 的重要调控分子之一,近年来,CDK6与肿瘤发生发展之间的密切关系得到了一些研究。研究发现CDK6在多种肿瘤细胞中过量表达,郑美蓉[10]等用原位分子杂交技术研究了肝癌组织中CDK6mRNA表达情况进行检测,发现CDK6mRNA在肝细胞癌组织中呈弱阳性表达,而在正常肝细胞中不表达,说明CDK6可能参与肿瘤的发生、发展。研制CDK6抑制剂,可作为肿瘤治疗的新靶点[11]。也可将CDK6作为诊断工具,通过测定细胞内的CDK6水平确定细胞是正常还是已发生癌变。
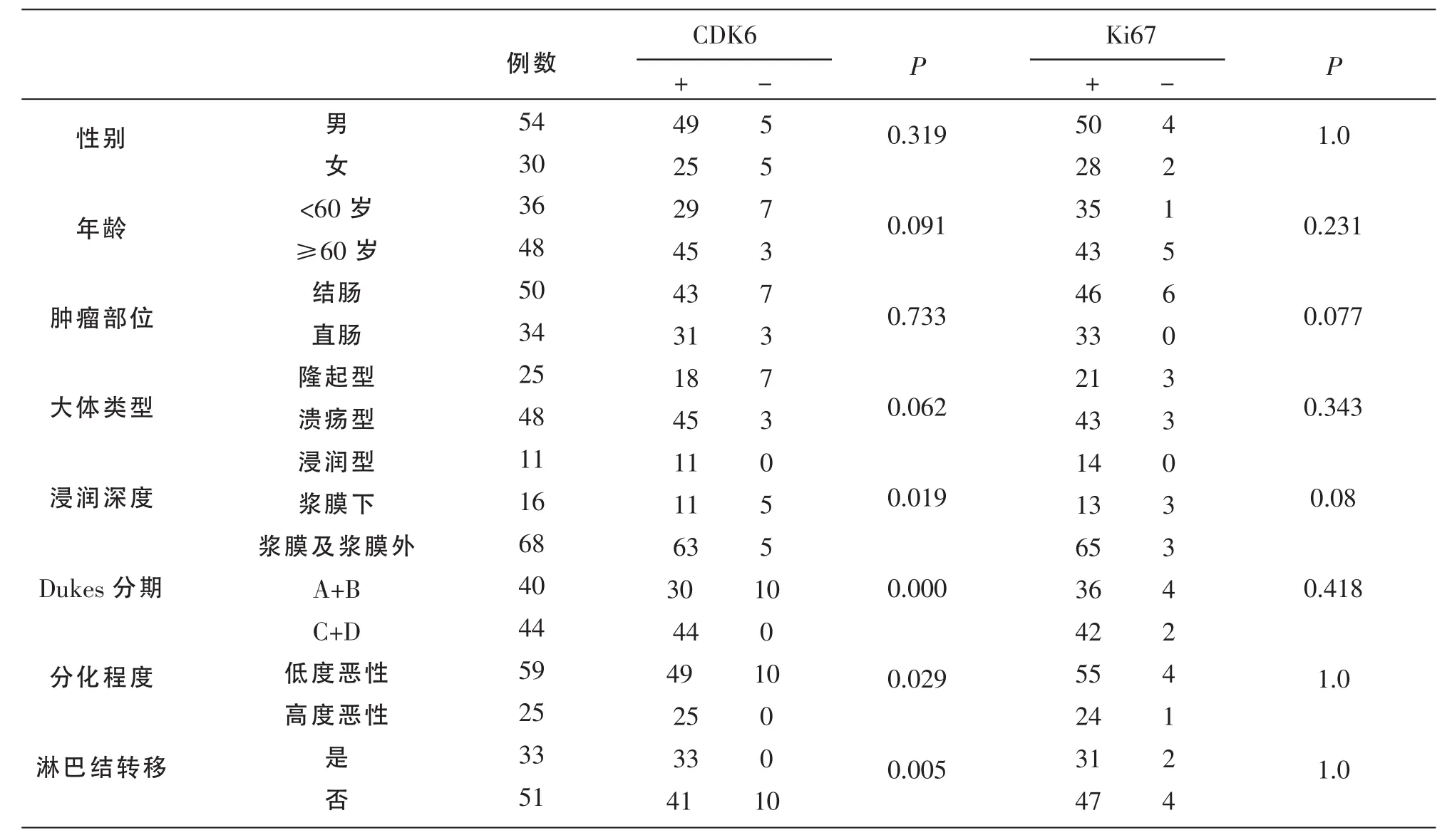
表3 CDK6、Ki67表达与大肠癌临床病理因素的关系
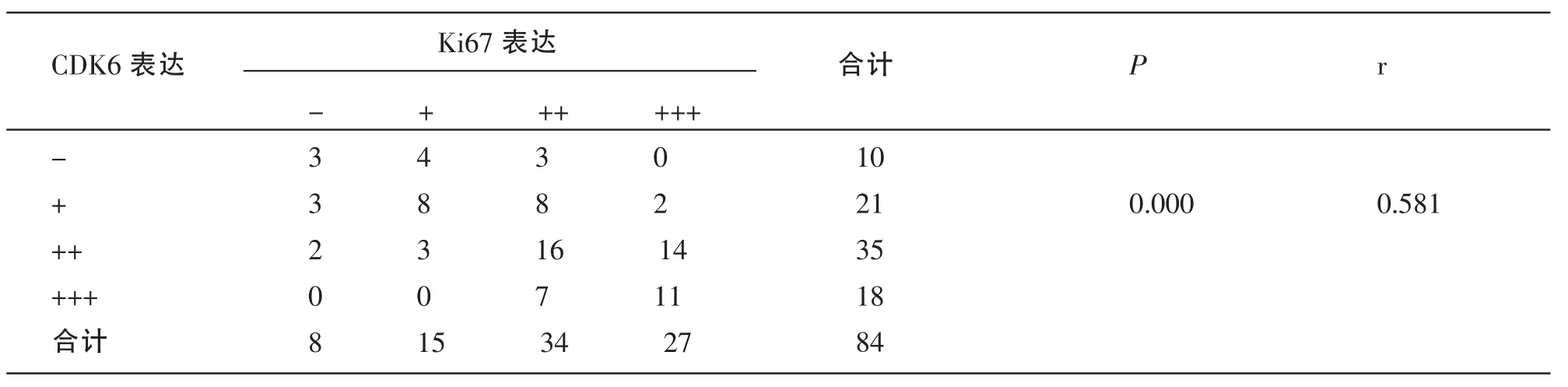
表4 CDK6与Ki67在大肠癌中表达的关系
细胞核相关抗原(Ki67)的人类基因定位于第10号染色体的长臂上,是调节细胞周期必不可少的组成部分,其表达因细胞周期不同时相而异,与细胞增殖密切相关,可作为评价细胞生长分数的指标[12]。
本研究显示,CDK6蛋白主要在细胞核内表达,胞浆也部分表达,在大肠癌组织中CDK6蛋白的阳性表达率较切缘正常大肠粘膜阳性率明显升高,CDK6蛋白表达与肿瘤浸润深度、Dukes分期、淋巴结转移、分化程度相关。提示CDK6可能参与了大肠癌发生发展,与大肠癌预后有关。Ki67蛋白定位在细胞核,在大肠癌组织中Ki67蛋白的阳性表达率较切缘正常大肠粘膜阳性率明显升高,本研究显示Ki67表达与肿瘤浸润深度、Dukes分期、淋巴结转移、肿瘤分化程度之间无明显相关关系。提示Ki67可能是大肠癌发生中的早期分子事件。
采用Spearman秩相关分析双变量(CDK6、Ki67)等级资料之间的相关关系,使用等级相关系数r来说明CDK6及Ki67两个变量间直线相关关系的密切程度与相关性。发现CDK6与Ki67在大肠癌中的表达呈正相关关系。
本研究结果提示检测大肠癌组织中CDK6及Ki67表达可以更加有依据说明组织是否发生了癌变,与组织细胞形态学相结合,应用于大肠癌的辅助诊断。CDK6、Ki67蛋白参与了大肠癌的发生、发展过程,发挥了癌基因的作用,CDK6在评价大肠癌患者预后中具有一定的价值。
[1]Jemal A,Siegel R,Ward E,et al.Cancer statistics,2008[J].CA Cancer J Clin,2008,58(2):71-96.
[2]Takaki T,Fukasawa K,Suzuki-Takahashi I,et al.Preferences for phosphorylation sites in the retinoblastoma protein of D-type cyclin-dependent kinases,Cdk4 and CDK6,in vitro[J].Biochem,2005,137(3):381-386.
[3]Schlüter C,Duchrow M,Wohlenberg C,et al.The cell proliferation-associated antigen of antibody Ki-67:a very large,ubiquitous nuclear protein with numerous repeated elements,representing a new kind of cell cycle-maintaining proteins[J].J Cell Biol,1993,123(3):513-522.
[4]Stanley R.Hamilton Lauri A.Aaltonen.Pathology and Genet-ics in tumours of the Digestive System[M].北京:人 民 卫 生出版社,2006.124-131.
[5]中国抗癌协会编.新编常见恶性肿瘤诊治规范大肠癌分册[M].北京医科大学,中国协和医科大学联合出版社,1999.
[6]Kawasaki H,Altieri DC,Lu CD,et al.Inhibition of a PoPtosis by survivin Prediets shorter survival rates in colorectalcancer[J].Cancer Res,1998,58(22):5071-5074.
[7]SinicroPe FA,Ruan SB,Cleary KR,et al.Bcl-2 and P53 oncoprotein expressionduring colorectal tumorigenesis[J].Cancer Research,1995,55(2):237-241.
[8]Duman-Scheel M,Weng L,Xin S,et a1.Hedgehog regulates cell growth and proliferation by inducing cyclin D and cyclin E[J].Nature,2002,417(6886):299-304.
[9]Meyerson M,Harlow E.Identification of G1 kinase activity for cdk6,a novel cyclin D partner [J].Mol Cell Biol,1994,14(3):2077-2086.
[10]郑美蓉,阮庆大,程玲,等.cyclinD1、cyclinE、CDK6 在原发性肝细胞癌中的表达 [J].临床肝胆病杂志,2006,22(1):49-51.
[11]Cam EJ,Liu BD,Bjeldanes LF,et al.Indole-3-carbinol inhibits CDK6 expression in human MCF-7 breast cancer cells by disrupting Sp1 transcription factor interactions with a composite element in the CDK6 gene promoter[J].J Biol Chem,2001,276(25):22332-22340.
[12]Iolota V,Batistatou A,Tsamandas AC,et al.Immunohistochemiocal expression of TGF-betal,p21WAF1,p53,Ki67,and angiogenesis in gastric carcinomas:a clinicopathologic study[J].Int J Gastrointest Cancer,2002,32(2-3):83-89.

