活性氧介导紫花牡荆素诱导卵巢癌HO-8910细胞调亡
唐 敏 ,夏 红 ,何丽华 ,杨小红 ,谢宛玉
(1.南华大学第一附属医院,湖南 衡阳 421001;2.南华大学肿瘤研究所,湖南 衡阳 4210012;3.湖南师范大学医学院,湖南 长沙 410013)
紫花牡荆素(5,3'-dihydroxy-3,6,7,4'-tetramethoxyflavone,casticin,CAS)是一种具有广泛药理活性的多甲基黄酮类化合物,近年来文献报道CAS对多种肿瘤细胞有抑制增殖和诱导凋亡的作用[1],引起了人们的广泛关注。在我们的前期实验研究中,已证实CAS具有诱导人卵巢癌HO-8910细胞凋亡作用,且其诱导细胞凋亡可能是通过caspase-3级联而实现的[2]。本研究通过检测CAS处理HO-8910细胞内活性氧生成和细胞膜电位改变,并行抗氧化剂N-乙酰半胱氨酸(NAC)干预实验,探讨CAS诱导HO-8910细胞凋亡作用是否涉及活性氧介导的线粒体膜去极化作用。
1 材料与方法
1.1 实验材料
CAS由湖南师范大学药物工程实验室曹建国教授惠赠。人卵巢癌HO-8910细胞株购自中南大学湘雅医学院细胞中心。RPMI-1640(Gibco公司);新生小牛血清 (杭州四季青);DMSO (Amresco公司); NAC、H2DCFH-DA 试剂盒、Rh123(Beyotime)和AnnexinⅤ/PI双染试剂盒购自南京凯基公司。
1.2 实验方法
1.2.1 细胞培养
用含10%小牛血清的RPMI-1640培养基于37℃、5%CO2饱和湿度下培养。细胞贴壁生长于培养基中,取对数生长期细胞用于实验。
1.2.2 AnnexinⅤ/PI双染色FCM分析
参照文献[3]方法,取同步化处理24 h的HO-8910细胞,用含不同受试物的10%小牛血清的培养基继续培养,使CAS终浓度为2,4 μg/mL;溶媒对照组终浓度为0.2%DMSO;NAC对照组终浓度为 10 mmol/L NAC;NAC(mmol/L)干预组则取 NAC 10 mmol/L预孵育1 h后再加入CAS终浓度为2,4 μg/mL共孵育48 h。 收集细胞,用冰PBS洗2遍,1000r/m,5min离心,弃上清,按Annexin V-FITC细胞凋亡检测试剂盒使用说明书步骤进行Annexin V-FITC及碘化丙啶避光染色,半小时内上流式细胞仪检测。以上实验重复3次。
1.2.3 Rh123探针FCM分析
[4]方法,Rh123探针用无血清培养液稀释,使其终浓度为 10 μmol/L,用1.5mL的 EP管分装备用,收集处理后细胞,预冷 PBS洗涤细胞2次,1000r/m,5min离心,弃上清,将细胞重悬于稀释的Rh123溶液中,置细胞培养箱内孵育 (37℃,30min)。取无血清培养液洗涤细胞3次,上机检测,激发波长 488nm,发射波长 525nm。
1.2.4 H2DCFH-DA探针FCM分析
参考文献[5]方法,取无血清培养基将H2DCFH-DA探针按1:1000稀释成终浓度为10 μmol/L溶液,分装于1.5 mL的 EP管中待用。收集处理后各组细胞,取预冷后PBS洗涤 2次,1000rpm×5min离心,弃上清,将细胞悬浮于稀释的DCFH-DA溶液中,37℃细胞培养箱内孵育 30 min,取无血清培养液洗涤细胞 3次,流式细胞仪检,激发波长 488nm,发射波长 525nm。以上实验重复3次。
1.3 统计学处理
实验数据用mean±SD表示,SPSS 13.0软件行统计分析,组间均数比较用One-Way ANOVA分析,以P<0.05为差异有统计学意义标准。
2 结果
2.1 CAS对卵巢癌HO-8910细胞凋亡率的影响
Annexin V/PI双染色FCM分析结果显示CAS(2和4 μg/mL)处理HO-8910细胞48小时的细胞凋亡率分别为 :9.46±0.95%,14.47±1.47%(P<0.01),而经NAC(10 mmol/L)预处理后细胞凋亡率下降到 (4.63±0.57%,5.30±0.50%)(P<0.01);说明CAS具有诱导HO-8910细胞凋亡作用,并提示该作用至少部分依赖于细胞内活性氧生成(图1)。
2.2 CAS对卵巢癌HO-8910细胞活性氧生成的影响
H2DCFH-DA荧光探针FCM分析结果表明CAS(2和 4 μg/mL)处理 48小时的HO-8910细胞H2DCFH-DA平均荧光强度分别为:36.73±1.52,57.53±2.83;联合 NAC(10 mmol/L)预处理细胞的平均荧光强度分别为:13.63±1.25,14.63±1.60(P<0.05)。说明CAS诱导HO-8910细胞活性氧生成,并证实NAC具有阻断CAS诱导HO-8910细胞活性氧生成作用(图2)。
2.3 CAS对卵巢癌HO-8910细胞膜电位的影响
Rh123探针标记FCM分析细胞内线粒体膜电位结果表明,CAS(2和 4 μg/mL)处理 48h的 HO-8910细胞Rh123平均荧光强度分别为 12.73±1.25、18.20±1.49,明显低于NAC预处理组平均荧光强度 (56.20±2.73,59.7±1.79),及溶媒对照组(84.67±3.73)(P<0.01 )。 说明 CAS诱导细胞线粒体膜去极化,而抗氧化剂NAC能有效阻止该过程中的线粒体膜去极化作用(图3)。
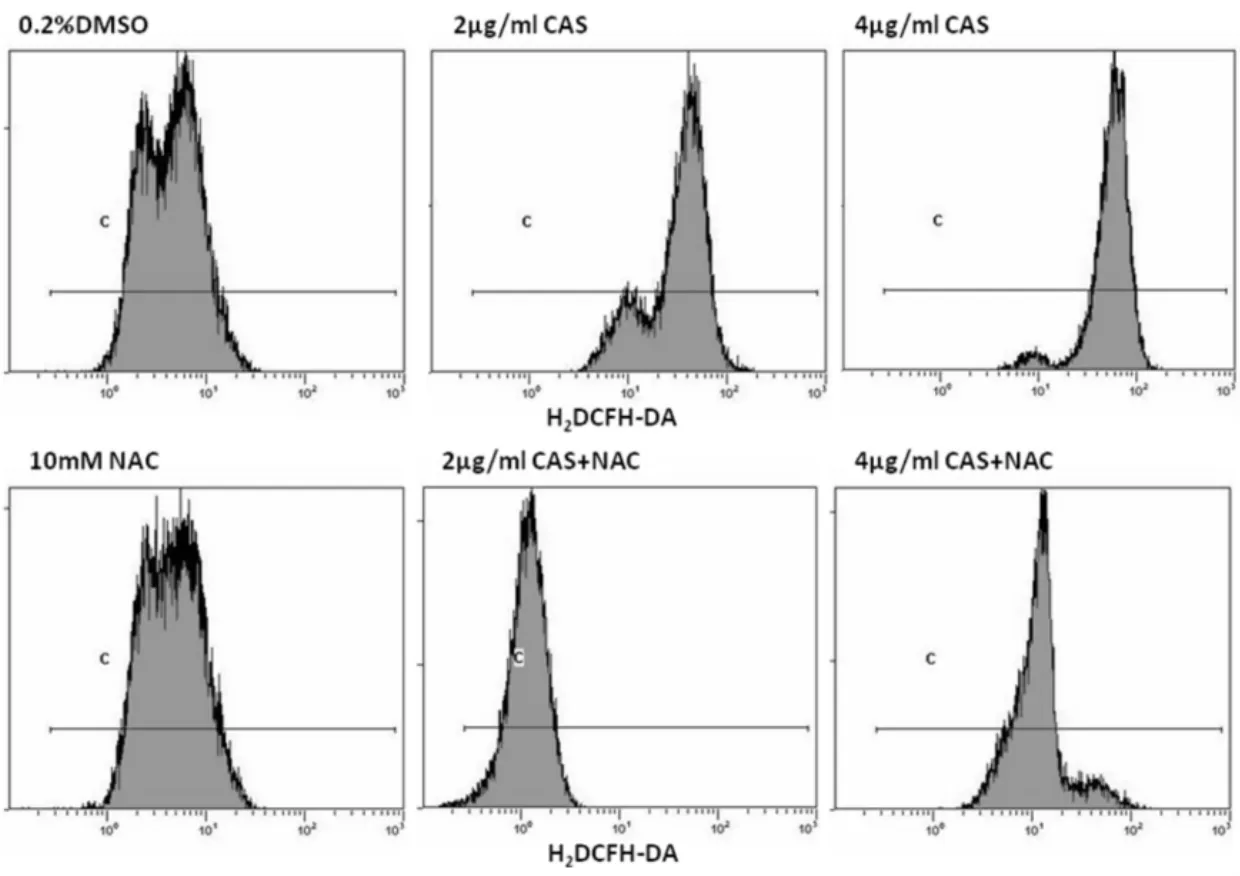
图2 H2DCFH-DA荧光探针FCM检测HO-8910细胞活性氧生成
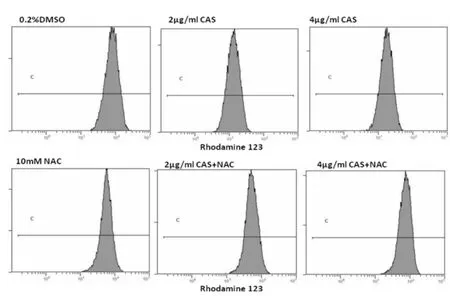
图3 Rh123探针标记FCM检测HO-8910细胞线粒体膜电位
3 讨论
卵巢癌是妇科肿瘤中致死率最高的肿瘤,近年来呈上升和年轻化趋势[6]。如何提高卵巢癌的诊治水平,改善治愈率,是函待解决的问题。因此,研发具有选择性诱导癌细胞凋亡,而毒副作用小的卵巢癌治疗药物具有重要的临床意义。
CAS是一种从蔓荆子(Vitex trifolia L)中提取的具有广泛药理活性的多甲氧基黄酮类化合物,近年来研究表明CAS对正常细胞增殖无影响或影响较小,对人白血病、乳腺上皮癌、口腔鳞状细胞癌、人结肠癌、人大肠癌、人肺癌、人纤维肉瘤、前列腺癌、卵巢癌等癌细胞株的增殖具有抑制活性[7]。在我们的前期研究中,论证了CAS对HO-8910细胞的增殖抑制作用以及诱导凋亡效应,并对CAS对抑制人卵巢癌HO-8910细胞增殖和诱导凋亡的效应以及分子生物学机制进行了初步的探讨[2]。
众所周之,细胞产生活性氧的部位是线粒体,其产生的速率与线粒体跨膜电位Δψm的相关。细胞受到外来应激刺激后,在ROS升高的同时,可检测到 Δψm的下降、线粒体膜通透性转换孔的开放、Cyt C的释放,激活线粒体凋亡途径[8]。最近,亦有研究提出CAS抗肿瘤机制可能通过线粒体功能紊乱或是代谢增加使得ROS水平相对升高,细胞谷胱甘肽水平降低,导致肿瘤细胞的氧化应激有关[9]。在本文的研究中,我们再次证实CAS诱导HO-8910细胞凋亡,并呈浓度依赖性。值得注意的是氧自由基清除剂N-乙酰半胱氨酸(NAC)有效降低细胞内的ROS水平,NAC预孵育减弱CAS诱导HO-8910细胞凋亡作用。同时用Rh123探针FCM检测线粒体膜电位和H2DCFH-DA探针测定细胞中ROS的生成量,结果显示CAS诱导细胞凋亡过程中存在ROS增高及线粒体膜电位去极化,NAC预孵育能有效阻止该过程中的存在ROS生成及线粒体膜电位去极化,说明CAS诱导细胞凋亡的过程中同时存在ROS升高和线粒体膜电位的降低,并且依赖于ROS的生成。与此前文献报导的CAS抗肿瘤机制可能通过线粒体功能紊乱或是代谢增加使得ROS水平相对升高,导致肿瘤细胞的氧化应激相符合。
总而言之,本文再次验证了前期实验中CAS对人卵巢癌HO-8910细胞凋亡效应,CAS可引起HO-8910细胞内活性氧增加和线粒体膜电位下降,可能涉及氧化应激触发线粒体诱导凋亡途径激活。说明CAS可能是治疗卵巢癌等恶性肿瘤的有效药物,具有开发价值。然而CAS刺激氧化应激的作用机制,还有待于我们进一步研究。
参考文献:
[1]Shen JK,Du HP,Yang M,et al.Casticin induces leukemic cell death through apoptosis and mitotic catastrophe[J].Ann Hematol,2009,88(8):743-52.
[2]白军,谢宛玉,曹建国,等.紫花牡荆素体外抑制人卵巢癌HO-8910细胞增殖和诱导凋亡的研究 [J].现代妇产科进展,2010,(04):265-269.
[3]张景红,冯汗青,李红玉.雄黄微生物提取液诱导K562/ADM细胞凋亡的作用机制研究 [J].中华中医药学刊,2010,(03):533-537.
[4]Cai SB,Zhang X,Chen ZX,et al.Medicated serum prepared with Chinese herbal medicine Zhizhen Recipe down-regulates activity of nuclear factor-kappaB and expression of P-glycoprotein in human colorectal cancer multidrug-resistant cell line HCT-8/VCR[J].Zhong Xi Yi Jie He Xue Bao,2011,9(12):1353-1359.
[5]Yang XH,Zheng X,Cao JG,et al.8-Bromo-7-methoxychrysin-induced apoptosis of hepatocellular carcinoma cells involves ROS and JNK [J].World J Gastroenterol,2010,16(27):3385-3393.
[6]何健荣,高曦,任泽舫.全球女性乳腺癌和卵巢癌最新发病分布特征[J].中国肿瘤,2009,(03):169-172.
[7]Haidara K,Zamir L,Shi QW,et al.The flavonoid Casticin has multiple mechanisms of tumor cytotoxicity action[J].Cancer Lett,2006,242(2):180-190.
[8]Lass A,Sohal RS.Comparisons of coenzyme Q bound to mitochondrial membrane proteins among different mammalian species[J].Free Radic Biol Med,1999,27(1-2):220-226.
[9]Chen D,Cao J,Tian L,et al.Induction of apoptosis by casticin in cervical cancer cells through reactive oxygen species-mediated mitochondrial signaling pathways[J].Oncol Rep,2011,26(5):1287-1294.

