紫花牡荆素通过线粒体凋亡途径诱导人宫颈癌HeLa细胞凋亡
田 莉,周 蓓,盛习锋,杨小红,曹建国
(湖南师范大学医学院,湖南 长沙 410013)
紫花牡荆素(5,3′-二羟基-3,6,7,4′-四甲氧基黄酮类化合物,Casticin,CAS)是一种多甲氧基黄酮类化合物。C-3′和C-5羟基以及C-3和C-4′甲氧基是黄酮类化合物具有强效细胞毒作用所必需的基团[1],紫花牡荆素含有这些活性必需基团。有研究报道紫花牡荆素能抑制包括人宫颈癌HeLa细胞在内的多种肿瘤细胞增殖和生长[2-5]。线粒体在调节包括药物诱导细胞凋亡等各种凋亡过程中具有重要的作用。本文旨在研究CAS是否通过线粒体凋亡途径诱导HeLa细胞凋亡。
1 材料和方法
1.1 细胞与细胞培养
人宫颈癌HeLa细胞购自中国典型培养物保藏中心(中国武汉市),用含10%小牛血清的RPMI-1640培养基,加100 U/mL青霉素,100 U/mL链霉素,置于37℃,5%CO2饱和湿度的细胞培养箱内培养,2天传代一次,取对数生长期细胞用于实验。
1.2 药品与试剂
紫花牡荆素(CAS)(成都普瑞法科技开发公司产品);细胞凋亡ELISA检测试剂盒(罗氏公司出品);DNA Ladder检测凋亡试剂盒(北京博大泰克公司产品);碘化丙啶(PI;Sigma 公司);溴化乙锭(EB;Sigma公司);罗丹明-123(Rh123;Molecular Probes公司);Caspase-3/9活性检测试剂盒 (Millipore公司);鼠抗人 cyto C、Bax、Bcl-2、Bcl-xL、XIAP、β-actin 单克隆抗体和山羊抗鼠IgG抗体 (Santa Ceuz生物科技公司);辣根过氧化酶藕联抗鼠二抗(Cell Signaling技术公司)。
1.3 凋亡ELISA试剂盒测定组蛋白/DNA碎片
细胞消化成单细胞悬液,接种于96孔板中,每孔10000个细胞,培养24 h,分组加药,10%胎牛血清的RPMI-1640培养基培养24 h,PBS稀释细胞悬液。反复冻融使细胞破坏并放出细胞内成份。3000r/min离心20 min,收集上清作为待测样品。用蒸馏水将20倍浓缩洗涤液稀释成原倍的洗涤液。在标准品孔中加入标准品50 μL,待测样本孔中先加入待测样本 10 μL,再加样本稀释液 40 μL,空白对照孔不加,37℃水浴30 min。弃去液体,洗板。每孔加入酶标工作液50 μL,空白对照孔不加。37℃水浴30 min。弃去液体,洗板。每孔先加入显色剂A液50μL,再加入显色剂B液50 μL,手轻轻震荡混匀 30 s,37℃避光显色 15 min。加终止液 50 μL,终止反应。以空白孔调零,在终止后15 min内,用EXL-800型酶标仪405nm波长下测量各孔的吸光度值(A值)。
1.4 PI染色FCM分析Sub-G1细胞百分率
取对数生长期HeLa细胞,每瓶4×106个细胞接种于100 mL细胞培养瓶。培养24 h,吸除培养基,加入含受试物或对照药品和10%小牛血清的培养基,每个实验组1瓶,分别作用24 h。收集1×106个细胞,1000r/m离心10 min,4℃以上冷PBS洗一次。用4℃的75%乙醇固定24 h后,PBS洗3次后,经0.5g/L的RnaseA消化30 min,用终浓度65 mg/L的PI染色,轻轻混匀,冰浴避光放置1h。用EPICS-XL型流式细胞仪以488 nm为激发波长,630 nm测定Sub-G1细胞百分率。以上实验重复2次。
1.5 DNA琼脂糖凝胶电泳法
取对数生长期HeLa细胞,每瓶4×106个细胞接种于250 mL细胞培养瓶。培养24 h,待细胞贴壁,吸除培养基,加入含受试物或对照药品和10%小牛血清的培养基,作用48 h。收集细胞,用PBS液洗2遍,按凋亡细胞DNA ladder检测试剂盒说明书的步骤分别提取DNA,置于4℃冰箱过夜。将提取的 DNA 样品 8.5 μL 与 6×Buffer 1.5 μL 混匀后,加到2%琼脂糖凝胶(含EB)中进行电泳,电泳电压40V,最后在DBT-08凝胶图像分析系统观察并摄影。
1.6 caspase比色活性试剂盒检测caspase活性
采用Caspase-3/-9活性ELISA测定试剂盒检测细胞Caspase-3/-9活性。取未处理与受试物或对照药品处理48h的细胞4×106个,按Caspase-3/-9活性ELISA检测试剂盒说明书进行操作,用酶标仪在λ=405nm测定其吸光度A值。通过计算A(处理组)/A(DMSO对照组)的倍数来确定受试物或对照药品处理导致细胞caspase-3/-9活化的程度。以Lysis Buffer和Reaction Buffer混合物作为参比 (调零组)。
1.7 Rh123染色FCM检测细胞线粒体膜电位水平
细胞传代,培养24 h,贴壁后,吸除培养基,加入含受试物或对照药品和10%小牛血清的培养基,作用48 h。收集2.0×106个受试物处理后的HeLa细胞,PBS清洗三次,重悬于1mL的1μg/mL Rh123中,37℃暗室孵育30 min。PBS洗涤细胞三次,用EPICS-XL型流式细胞仪以507 nm为激发波长,529 nm为发射波长测定细胞内的荧光强度。
1.8 Western blot分析
细胞传代,培养24 h,吸除培养基,加入含受试物或对照药品和10%小牛血清的培养基,作用48 h。收集受试物处理后的细胞4×106,用冰预冷的PBS洗两次,尽量吸净残留的PBS,加适量蛋白抽提Lysis Buffer到细胞中,置于1.5 mL EP管中,冰上放置30 min。 12000 r/m,4℃离心30 min,收集上清,即为细胞总蛋白,分装成小管,-80℃保存。BCA法测定蛋白浓度。SDS-聚丙烯酰胺凝胶凝胶电泳。取下凝胶,用转移缓冲液浸泡数分钟,用蛋白湿转移装置4℃将蛋白转移到PVDF膜上 (转膜条件80mA、135 min,适用于小分子量蛋白),取下PVDF膜。用含5%脱脂奶粉的TBST液封闭2h,加入适当浓度一抗(浓度1:1000),37℃孵育 1h,然后用TBST漂洗膜3次,每次5 min。加入二抗 (浓度1:1000)37℃孵育1h,TBST洗3次,每次15 min。ECL试剂盒进行化学发光检测。X光片压片、显影、定影。薄层扫描仪 (日本产,型号CS-930)扫描,Alphazmager2200软件测定印迹区带的光密度值。以βactin为内参照标化,计算目的条带的相对密度。
1.9 统计学处理
各组实验数据均用mean±SD表示,采用SPSS15.0软件,进行单因素方差分析,两两比较采用LSD检验。P<0.05为统计学意义显著性标准。
2 结果
2.1 CAS对宫颈癌HeLa细胞组蛋白/DNA碎片水平的影响
图1显示,1.0、2.0和4.0 μM的CAS处理后的A405明显大于对照组(P<0.05),并且A405以浓度依赖性方式升高(P<0.05)。说明CAS能浓度依赖性诱导HeLa组蛋白/DNA碎片水平增加。
2.2 CAS对宫颈癌HeLa细胞凋亡率的影响
FCM分析结果表明,1.0、2.0和4.0 μM的CAS处理导致HeLa细胞Sub-G1细胞百分率增加 (P<0.05)(图2A),时效研究的结果显示,CAS以时间依赖性方式使Sub-G1细胞百分率升高 (P<0.05)(图2B)。说明CAS能浓度依赖性和时间依赖性诱导HeLa细胞凋亡。
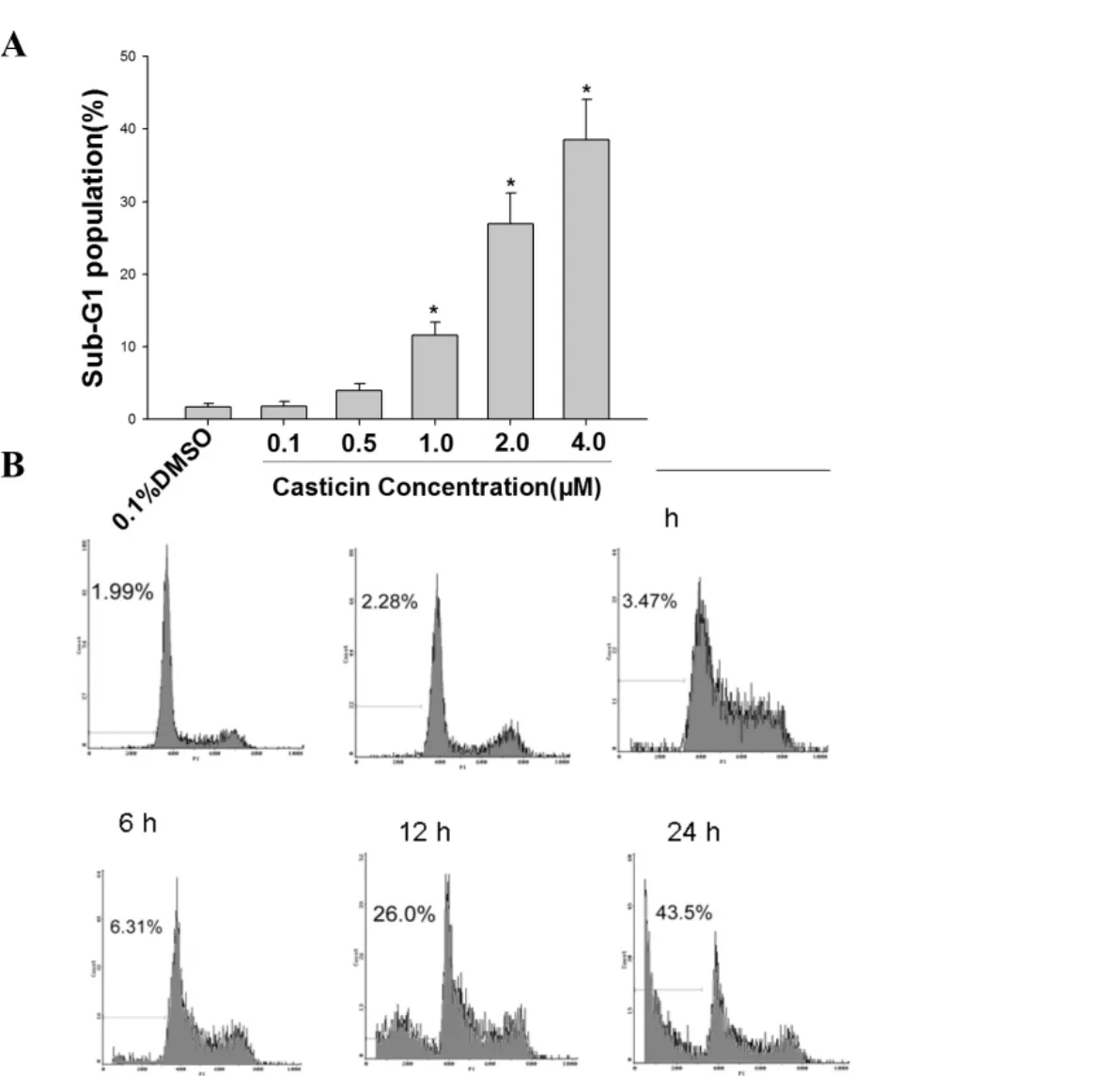
图2 CAS诱导宫颈癌HeLa细胞凋亡率增高(mean±SD,n=3)与溶媒组比较,*P<0.05。
2.3 CAS对宫颈癌HeLa细胞DNA断裂的影响
图3示:2.0和 4.0 μM的CAS处理细胞 48 h,出现典型DNA梯形条带。说明CAS能有效诱导HeLa细胞DNA核小体间断裂。
2.4 CAS对宫颈癌HeLa细胞caspase-3/-9活性的影响
图4A 表明,0.5、1.0、2.0和 4.0μM 的 CAS处理
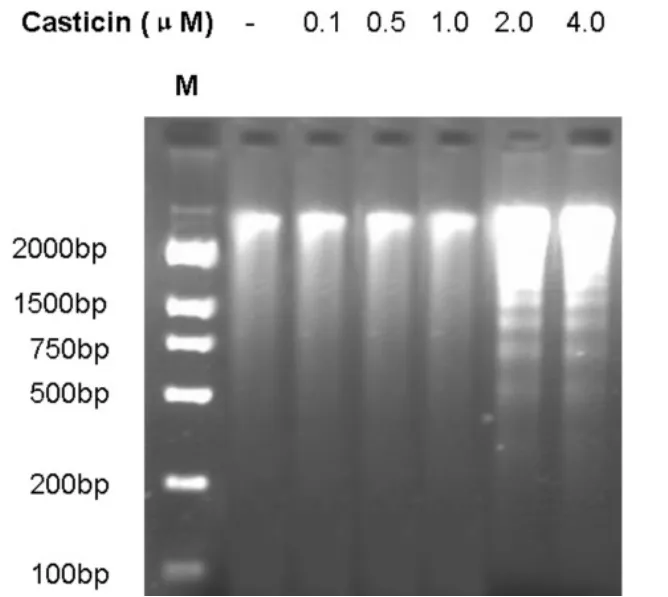
图3 DNA琼脂糖凝胶电泳图谱
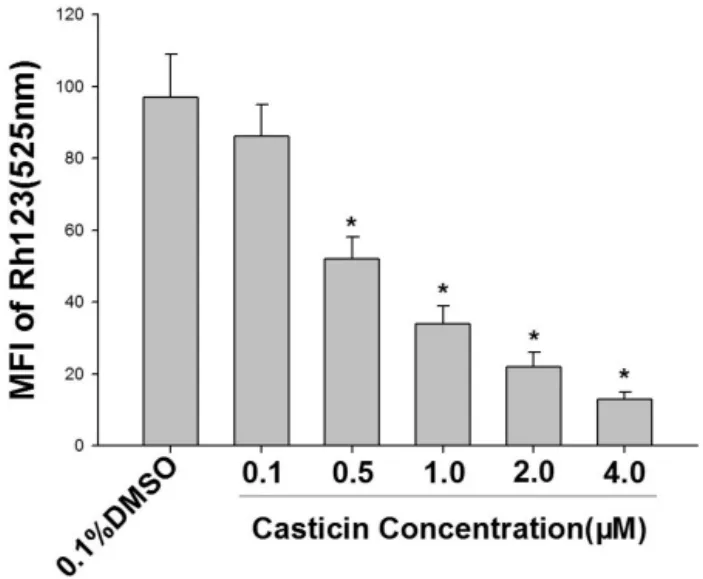
图4 CAS降低宫颈癌HeLa细胞线粒体膜电位(mean±SD,n=3)与溶媒组比较,*P<0.05。
2.5 CAS对宫颈癌HeLa细胞线粒体膜电位的影响
Rh123染色FCM检测细胞线粒体膜电位的结果证实,不同浓度CAS处理后,线粒体荧光强度以浓度依赖方式降低(P<0.05),4μM CAS组荧光强度是对照组的1/4(图5)。说明CAS具有降低宫颈癌HeLa细胞线粒体膜电位的作用。
2.6 CAS对宫颈癌HeLa细胞线粒体凋亡途径相关蛋白表达的影响
Western blot结果显示,细胞色素C和Bax蛋白随着CAS浓度升高表达升高,而Bcl-xL和XIAP的表达却依次降低(图6),这些结果提示CAS激活引起宫颈癌HeLa细胞caspase-3和-9活性增高(P<0.05),且呈浓度依赖性。说明CAS浓度依赖性活化HeLa细胞caspase-3和caspase-9。同时分别给予caspase抑制剂zVAD-fmk和zLEHD-fmk,再用4μM CAS处理HeLa细胞,细胞凋亡率显著降低(P<0.05)(图4B)。这表明,CAS诱导HeLa细胞凋亡依赖于CAS对caspase-3和caspase-9的活化作用。HeLa细胞线粒体凋亡途径。有趣的是Bcl-2的表达并未受到CAS处理的影响。
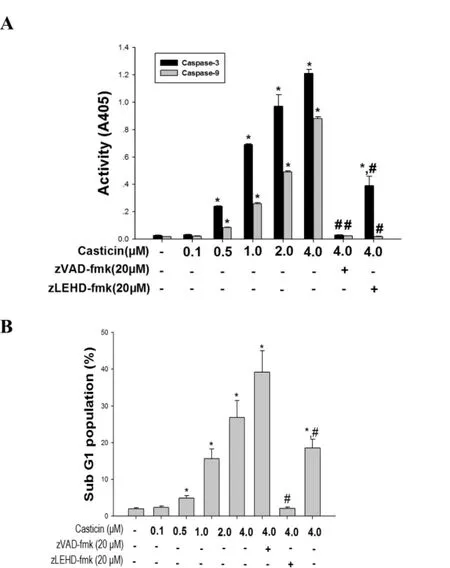
图4 CAS激活宫颈癌HeLa细胞caspase-3和-9(mean±SD,n=3)与溶媒组比较,*P<0.05;与单用 4.0μMcasticin处理比较,#P<0.05。
3 讨论
CAS是蔓荆子中的一种多甲氧基黄酮类化合物,作为一种中药抗炎剂广泛用于民间[1],据报道其能抑制多种肿瘤细胞的增殖[1-5]。Csupor-Loffler等证实CAS能显著抑制人子宫颈癌HeLa细胞系的增殖[1]。本研究首次证实CAS通过线粒体凋亡途径,剂量依赖性诱导人宫颈癌HeLa细胞凋亡。

图6 CAS调节宫颈癌HeLa细胞线粒体凋亡途径相关蛋白表达
细胞凋亡时会释放出核小体,而核小体由组蛋白和DNA片段组成。我们采用ELISA检测核小体的释放,CAS能浓度依赖性诱导HeLa组蛋白/DNA增加(图1)。凋亡细胞的细胞膜通透性增加,PI染料通过细胞膜,使核DNA染色。凋亡细胞核酸内切酶活化,使DNA降解,细胞DNA分子量减小,因此在G0/G1峰前出现亚二倍体峰(Sub-G1)。Sub-G1细胞百分率也代表细胞凋亡百分率。PI染色FCM结果说明CAS能剂量依赖性和时间依赖性导致Sub-G1百分率升高(图2A和B)。细胞发生凋亡时,DNA发生断裂,小分子量DNA片段增加,高分子DNA减少,琼脂糖凝胶电泳后会形成典型DNA梯形条带。浓度为2.0和4.0μM的CAS处理细胞后,出现了典型DNA梯形条带(图3)。综合以上,我们证明了CAS诱导人宫颈癌HeLa细胞凋亡。
线粒体在各种凋亡过程中起着重要的调节作用,包括药物诱导细胞凋亡[6]。Bcl-2家族成员调控线粒体死亡途径,而Bcl-2家族是通过调节促凋亡和抗凋亡分子之间的相互作用,来决定细胞命运[7,8]。Bax是Bcl-2家族中的一种促凋亡蛋白,它的上调表明有线粒体的参与,因Bax在线粒体外膜形成通道以促进细胞色素c的释放[9,10]。线粒体通透性转变的活化是使得细胞色素c完全释放所必需的[11]。我们的结果表明,CAS并没有改变Bcl-2的表达水平,而是下调Bcl-xL和上调Bax表达水平。Bax/Bcl-xL比例的增加是否在CAS诱导宫颈癌细胞凋亡方面起着重要作用,还有待阐明。据报道,细胞色素c从线粒体释放至细胞质,是凋亡体聚集以及随后的caspase-3/-9的活化所必需的,Apaf-1分子构象改变并促使pro-Cas-9与其结合形成凋亡小体,caspase-9被激活,被激活的caspase-9能水解pro-Cas-3,激活caspase-3等,从而诱导细胞凋亡。在caspase-9/-3活化的同时,XIAP下调,使得caspase从抑制形态释放出来[9,12]。
我们的研究结果表明,CAS通过线粒体死亡途径诱导人宫颈癌细胞凋亡。我们首次证明了CAS降低ΔΨm、上调Bax表达促进细胞色素c释放、下调Bcl-xL和XIAP、活化caspase-9和caspase-3。此外,广谱性caspase抑制剂zVAD-FMK阻断CAS细胞凋亡作用,而caspase-9抑制剂zLEHD-fmk有抑制作用。因此,我们得出这样的结论:在人宫颈癌细胞系,CAS引起线粒体功能障碍,并能触发依赖于caspase的细胞凋亡。
[1]Csupor-Loffler B,Hajdu Z,Zupko I,et al.Antiproliferative effect of flavonoids and sesquiterpenoids from Achillea millefolium s.l.on cultured human tumour cell lines[J].Phytother Res,2009,23(5):672-676.
[2]Ono M,Yanaka T,Yamamoto M,et al.New diterpenes and norditerpenes from the fruits of Vitex rotundifolia[J].J Nat Prod,2002,65(4):537-541.
[3]Diaz F,Chavez D,Lee D,et al.Cytotoxic flavone analogues of vitexicarpin,a constituent of the leaves of Vitex negundo[J].J Nat Prod,2003,66(6):865-867.
[4]Ko WG,Kang TH,Lee SJ,et al.Polymethoxyflavonoids from Vitex rotundifolia inhibit proliferation by inducing apoptosis in human myeloid leukemia cells[J].Food Chem Toxicol,2000,38(10):861-865.
[5]Shen JK,Du HP,Yang M,et al.Casticin induces leukemic cell death through apoptosis and mitotic catastrophe[J].Ann Hematol,2009,88(8):743-752.
[6]Cory S,Adams JM.The Bcl-2 family:regulators of the cellular life-or-death switch[J].Nat Rev Cancer,2002,2(9):647-656.
[7]Brunelle JK,Letai A.Control of mitochondrial apoptosis by the Bcl-2 family[J].J Cell Sci,2009,122(4):437-441.
[8]Leibowitz B,Yu J.Mitochondrial signaling in cell death via the Bcl-2 family[J].Cancer Biol Ther,2010,9(6):417-422.
[9]Gogada R,Prabhu V,Amadori M,et al.Resveratrol induces p53-independent,X-linked inhibitor of apoptosis protein(XIAP)-mediated Bax protein oligomerization on mitochondria to initiate cytochrome c release and caspase activation[J].J Biol Chem,2011,286(33):28749-28760.
[10]Pucci B,Bertani F,Karpinich NO,et al.Detailing the role of Bax translocation,cytochrome c release,and perinuclear clustering of the mitochondria in the killing of HeLacells by TNF[J].J Cell Physiol,2008,217(2):442-449.
[11]Kumarswamy R,Seth RK,Dwarakanath BS,et al.Mitochondrial regulation of insect cell apoptosis:evidence for permeability transition pore-independent cytochrome-c release in the Lepidopteran Sf9 cells[J].Int J Biochem Cell Biol,2009,41(6):1430-1440.
[12]Denault JB,Eckelman BP,Shin H,et al.Caspase 3 attenuates XIAP (X-linked inhibitor of apoptosis protein)-mediated inhibition of caspase 9[J].Biochem J,2007,405(1):11-19.

