苯并噻二唑对漂浮育苗烟草白粉病的诱导抗性及其对烟苗安全性研究
汪汉成, 杨双剑, 许冬青, 陈兴江, 胡向丹, 商胜华, 石俊雄*
(1.贵州省烟草科学研究所,贵阳 550081;2.中国农业大学农学与生物技术学院,北京 100193;3.贵州省烟草公司,贵阳 550001;4.黔西南州烟草公司技术中心,兴义 562400)
由烟草白粉病菌(Erysiphe cichoracearum DC.)引起的烟草白粉病(tobacco white powder)是烟草生产上危害性很强的气传真菌性病害[1],其寄主范围广,危害性强。它主要发生在南非、欧洲东部、中东地区和亚洲等烟草种植区,在中国以华南、西南和华中烟区最为普遍,发病株率可达100%,发病叶率一般在10%~20%,严重的可达80%以上[2]。随着我国烟草集约化育苗的发展,烟草白粉病在我国西南局部烟区的危害越发严重,造成烟苗素质下降并严重影响了烟苗的适时移栽,给烟农造成严重的经济损失。
烟草白粉病的防治主要是利用抗病品种和化学药剂;然而,兼具优良品质和烟草白粉病抗性的品种并不多见,而化学药剂防治不但严重影响烟草的安全性,而且还会带来抗药性、环境污染等方面的问题。利用植物的诱导抗性来防治植物病害是近年来非常热门的研究领域。苯并噻二唑(benzothiadiazole)是先正达公司开发的一种植物抗病诱导剂,已有报道其对马铃薯、番茄、大豆、烟草等作物的多种病害都有较好的诱抗效果[3-5],但能否诱导烟草幼苗对烟草白粉病产生抗性则鲜有报道。为了评价其防治烟草白粉病的可行性,笔者就苯并噻二唑对漂浮育苗烟草白粉病的诱导抗性及其对烟苗的安全性进行了初步研究,现将结果报道如下。
1 材料与方法
1.1 供试菌株
从烟草漂浮育苗温室大棚内采集烟草白粉病标本,用毛刷将单个病斑的分生孢子刷入4℃冷水中,转接于离体无病烟草叶片正面。在培养皿中垫湿润滤纸,于25℃,12h光照(10 000lx),12h黑暗交替条件下培养,每隔9d在新鲜离体烟草叶片正面转代培养1次。为了得到大量新鲜分生孢子供活体接种使用,采用手动喷雾器将分生孢子悬浮液均匀地喷雾在隔离培养的烟草叶片正面,培养9d后,待叶片正面产生密集、菌龄基本一致的烟草白粉病菌分生孢子,备用。本试验采用同一株烟草白粉病菌。
1.2 供试药剂
98%苯并噻二唑原药,安徽合肥丽巴奥物理化学科技有限公司生产。将其用甲醇(分析纯)配成1×103μg/mL的母液,4℃低温保存,待用。活体试验时用含0.01%吐温80的蒸馏水稀释母液。50%苯并噻二唑水分散粒剂,先正达(中国)投资有限公司生产;10%苯醚甲环唑水分散粒剂,先正达(中国)投资有限公司生产。
1.3 苯并噻二唑对烟草白粉病的诱导抗性
采用小苗法测定。将烟草(品种:‘K326’)种植于装有草炭和蛭石(质量比为4∶1)的烤烟育苗专用苗盘(160孔/盘)中,每穴种植1株,待烟苗长至40d苗龄时备用。将苯并噻二唑母液稀释成如下系列浓度:0、0.98、1.95、3.90、7.80、15.60、31.25μg/mL。利用小型手动喷雾器,将药液均匀喷雾处理烟草叶片的正面,直至有药液开始流失为止,每个浓度处理30株烟草苗。24h后喷雾接种烟草白粉病菌分生孢子悬浮液(分生孢子浓度2×105个/mL),自然风干后将漂盘置于温室内苗床上,于15~28℃、自然光照和湿度条件下培养。9d后调查病情[6],计算各处理的病情指数和药剂的相对防效。根据系列药剂浓度的对数值和防效几率值之间的线性回归关系,求出苯并噻二唑对烟草白粉病菌的EC50、EC90和相关系数R。
1.4 苯并噻二唑在烤烟漂浮育苗上的持效期测定
试验设50% 苯并噻二唑水分散粒剂用量为11.50、23、46g/hm2,对照药剂10%苯醚甲环唑水分散粒剂45g/hm2和清水对照共5个处理,每处理处理1漂盘烟苗(30株),在烟苗(品种:‘K326’)4叶期第1次用药,一周后第2次用药,使用小型手动喷雾器按药液量750kg/hm2常规喷雾。喷药后的烟苗放置于有白粉病烟苗的温室内,自然条件下培养(15~28℃,40%~70%RH,自然光照),按照漂浮育苗规程进行剪叶和养分管理。分别于第2次用药后10、20、30d,每苗盘五点取样随机调查10株烟苗,参照烟草白粉病药效试验准则[6]的分级标准调查,计算病情指数和防效。同时,注意观察新长出烟叶的发病情况和发病时间,分析药剂的持效期。
1.5 苯并噻二唑对漂浮育苗烤烟安全性测定
试验设50% 苯并噻二唑水分散粒剂用量为11.90、23.80、47.50、95、190、380g/hm2,和清水对照共7个处理,每处理处理30株漂盘烟苗(品种:‘K326’)。烟苗4叶期时,采用小型手动喷雾器按药液量750kg/hm2常规喷雾,直至流失。药后烟苗按照常规育苗方式管理,各处理分别于药后5、10、20、30d五点取样随机调查10株烟苗,观察药剂对烟苗的危害情况;并于药后30d五点取样,称量和记录10株烟苗的鲜重、茎围和根长值。
2 结果与分析
2.1 苯并噻二唑对烟草白粉病菌的诱导抗性
烟草小苗法测定结果(表1)表明,苯并噻二唑对烟草白粉病菌具有很强的诱导抗性,其毒力回归方程为y=2.551 5x+3.677 1,EC50、EC90值分别为3.30μg/mL 和 10.49μg/mL,相 关 系 数 R 为0.989 5。随着药剂浓度的增加,烟苗获得的抗性逐渐加强,31.25μg/mL苯并噻二唑处理的烟苗能够完全抵御烟草白粉病菌的侵染。
2.2 苯并噻二唑在漂浮育苗烤烟上的持效期
持效期试验结果如表2所示,漂浮育苗在温室自然发病情况下,药后10d,空白对照已经发病,苯并噻二唑所有处理均未发病;20d后,50% 苯并噻二唑水分散粒剂11.50g/hm2处理的烟苗才开始发病;30d后,50% 苯并噻二唑水分散粒剂23g/hm2和46g/hm2处理的防效仍然达到100%,显著优于45g/hm2苯醚甲环唑的处理(93.99%)。这表明苯并噻二唑在漂浮育苗烟苗上有30d以上的持效期。此外,50% 苯并噻二唑水分散粒剂11.50、23g/hm2和46g/hm2喷雾处理4叶期的烟苗,均会诱导烟苗新生叶片对烟草白粉病菌的抗性。
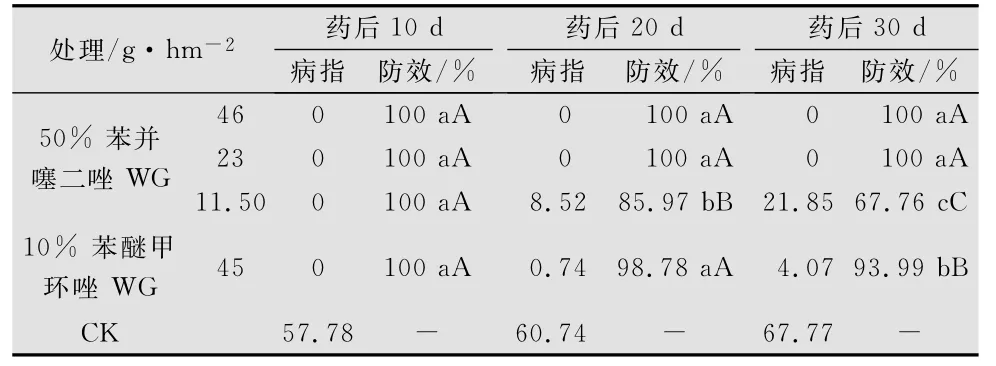
表2 50%苯并噻二唑水分散粒剂防治烟草白粉病的持效期1)
2.3 苯并噻二唑对漂浮育苗烤烟的安全性
安全性试验结果如图1所示,50%苯并噻二唑水分散粒剂95、190、380g/hm2喷雾处理4叶期烟苗会产生严重的药害,症状主要表现为:叶片变黄,叶缘枯死,烟苗矮化、发育迟缓。随着药剂浓度的增加,药害程度逐渐加重。药后30d烟苗的农艺性状如图2、3所示,50%苯并噻二唑水分散粒剂0、95、190g/hm2和380g/hm2处理烟苗的平均鲜重分别为15.98、8.49、5.36g/株和4.56g/株,茎围分别为1.83、1.57、1.44cm 和1.07cm,随着苯并噻二唑药剂浓度的增加,烟苗的鲜重和茎围均逐渐降低,各处理间存在显著差异;在漂浮育苗情况下,苯并噻二唑不同浓度喷雾处理在烟苗根长上不存在差异。

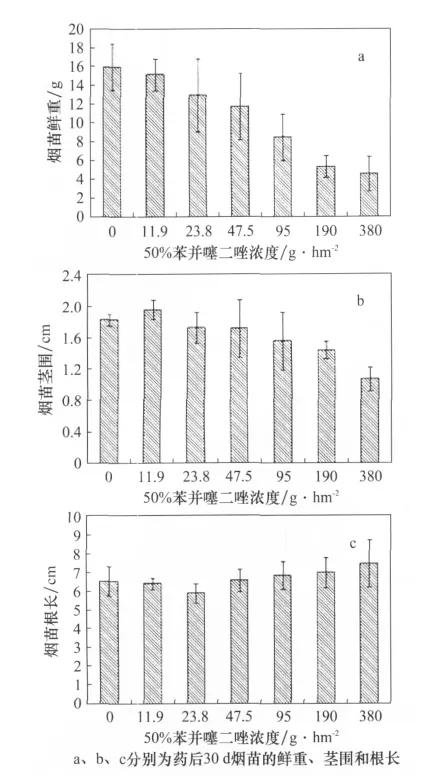
图3 50%苯并噻二唑水分散粒剂不同浓度处理对烟苗农艺性状的影响
3 讨论与结论
已有的研究表明,苯并噻二唑25μg/mL处理离体烟草能够诱导烟草抵抗青枯病,150μg/mL的处理会对烟苗造成药害[7];同时发现该药剂150μg/mL喷雾处理十字期烟苗,可以推迟盆栽烟草普通花叶病的显症发生,并减轻病害程度[8];Cole研究表明苯并噻二唑有效剂量0.05~0.1g/m2喷雾处理烟苗可以减轻烟草火疫病(Pseudomonas syringae Van hall)的危害,也可以诱导烟草对叶斑病[Thanatephorus cucumeris(Frank)Donk]和蛙眼病(Cercospora nicotianae Ell.et Ev.)产生抗性,同时也发现轻微药害现象[9];Nischwitz和 Mandal等研究发现苯并噻二唑可以诱导烤烟对番茄斑萎病毒的抗性[10-11]。本研究进一步证实了苯并噻二唑能够诱导烟苗产生抗性,并补充了其防治烟草白粉病的生物活性,研究结论同以上报道类似。然而,其能否在大田自然条件下诱发烟草产生系统抗性以及这种系统抗性在田间预防白粉病的效果还有待进一步研究。除烟草之外,苯并噻二唑还可诱发拟南芥、黄瓜、番茄、棉花、玉米、大麦、水稻等多种双子叶和单子叶植物产生对真菌、细菌和病毒病害的系统抗性,且对植物本身毒性较低,因而已经作为一种农药产品(商品名为Bion)投放市场已有多年[12-15]。
本研究采用烟草漂浮育苗的试验表明,苯并噻二唑喷雾处理4叶期烟苗可以诱导烟苗对烟草白粉病菌产生抗性,且具有30d以上的持效期,它具有同10%苯醚甲环唑水分散粒剂45g/hm2处理同样优秀的防治效果;苯并噻二唑可以很好地被烟草叶片吸收,输送到烟草生长点和新生烟草叶片内,这进一步证实了该药剂对植物的系统诱导活性[16-17];在本试验剂量范围内,50%苯并噻二唑水分散粒剂在>95g/hm2使用剂量下会对烟苗产生药害,影响烟苗发育,因此,苯并噻二唑在烤烟漂浮育苗上的安全使用剂量为47g/hm2,它可以预防苗期烟草白粉病的危害。
[1] Cole J S.Powdery mildew of tobacco(Erysiphe cichoracearum DC.)[J].Annual of Apply Biology,1964,54(3):291-301.
[2] Darvishzadeh R,Alavi R,Sarrafi A.Resistance to powdery mildew (Erysiphe cichoracearumDC.)in oriental and semi-oriental tobacco germplasm under field conditions[J].Journal of Crop Improvement,2010,24(2):122-130.
[3] Rogério S B,Correa,Jair C,et al.Silicon and acibenzolar-SMethyl as resistance inducers in cucumber,against the whitefly Bemisia tabaci(Gennadius)(Hemiptera:Aleyrodidae)biotype B[J].Neotropical Entomology,2005,34(3):429-433.
[4] Huang Y,Deverall B J,Tang W H,et al.Foliar application of acibenzolar-S-methyl and protection of postharvest rock melons and Hami melons from disease[J].European Journal of Plant Pathology,2000,106:651-656.
[5] Pradhanang P M,Ji P,Momol M T,et al.Application of acibenzolar-S-methyl enhances host resistance in tomato against Ralstonia solanacearum[J].Plant Disease,2005,89:989-993.
[6] GB/T 23222-2008.烟草病虫害分级及调查方法[S].北京:中国标准出版社,2008.
[7] 王涛,陈泽鹏,万树青,等.苯并噻二唑(BTH)诱导烟草抗青枯病活性与抗病机理研究[J].中国烟草学报,2008,14:29-32.
[8] 李钠钾,马啸,杨超,等.苯并噻二唑处理对漂浮育苗烟草TMV抗性的影响[J].江苏农业科学,2011,39(4):90-93.
[9] Cole D L.The efficacy of acibenzolar-S-methyl,an inducer of systemic acquired resistance,against bacterial and fungal diseases of tobacco[J].Crop Protection,1999,18:267-273.
[10] Nischwitz C,Csinos A S,Mullis S W,et al.Effect of transplant age,tobacco cultivar,acibenzolar-S-methyl,and imidacloprid on tomato spotted wilt infection in flue-cured tobacco[J].Plant Disease,2008,92:1524-1528.
[11]Mandal B,Mandal S,Csinos A S,et al.Biological and molecular analyses of the acibenzolar-S-methyl-induced systemic acquired resistance in flue-cured tobacco against Tomato spotted wilt virus[J].Phytopathology,2008,98:196-204.
[12] Hideo I,Yasunori T,Takeshi H,et al.Induced resistance of acibenzolar-S-methyl(CGA 245704)to cucumber and Japanese pear diseases[J].European Journal of Plant Pathology,1999,105:77-85.
[13] Toal E S,Jones P W.Induction of systemic resistance to Sclerotinia sclerotiorumby oxalic acid in oilseed rape[J].Plant Pathology,1999,48:759-767.
[14] Doubrava N S,Dean R A,Kuc J.Induction of systemic resistance to anthracnose caused by oxalate and extracts from spinach and rhubarb leaves[J].Physiological and Molecular Plant Pathology,1988,33:69-79.
[15] Moshe R,Vladimir A,Reuven R.A foliar spray of micronutrient solutions induces local and systemic protection against powdery mildew in cucumber plants[J].European Journal of Plant Pathology,1997,103:581-588.
[16] Sonnemann I,Finkhaeuser K,Wolters V.Does induced resistance in plant affect the belowground community[J].Applied Soil Ecology,2002,21:179-185.
[17] Franco G.Systemic acquired resistance in crop protection:from nature to a chemical approach[J].Journal of Agricultural Food Chemistry,2003,51(16):4487-4503.

