他克莫司对肾小管上皮细胞转分化早期CTGF、VEGF表达的影响
闵亚丽,赵冬慧,于 黔
(贵阳市第一人民医院肾内科 550004)
他克莫司对肾小管上皮细胞转分化早期CTGF、VEGF表达的影响
闵亚丽,赵冬慧,于 黔
(贵阳市第一人民医院肾内科 550004)
目的探讨不同剂量的他克莫司(FK506)对肾小管上皮细胞(HKC)转分化的作用及其对早期结缔组织生长因子(CTGF)、血管内皮生长因子(VEGF)表达的影响。方法以体外培养的HKC为研究对象,分4组:(1)对照组;(2)转化生长因子-β1(TGF-β1)(8ng/mL)组;(3)FK506(10、30、60ng/mL)组;(4)TGF-β1(8ng/mL)加 FK506(10、30、60ng/mL)组。应用形态学、免疫组化技术、和半定量反转录PCR(RT-PCR)观察FK506对TGF-β1诱导的HKC转分化的作用及对α-SMA、CTGF、VEGF表达的影响。结果与对照组比较,48h后TGF-β1组HKC细胞呈现出长梭形外观,α-平滑肌肌动蛋白(α-SMA)、CTGF、VEGF的表达明显增多(P<0.01),FK506组α-SMA、VEGF及CTGF的表达差异无统计学意义(P>0.05)。TGF-β1加FK506组比TGF-β1组α-SMA、VEGF及CTGF随FK506的浓度增加表达明显降低(P<0.05)。结论FK506对TGFβ1诱导的肾小管上皮细胞转分化早期可能通过下调VEGF、CTGF的表达起抑制作用。
他克莫司;肾小管;细胞转分化;血管内皮生长因子类;结缔组织生长因子
肾间质纤维化是指由多种原因引起的细胞外基质成分在肾间质内过度沉积,是各种慢性肾脏疾病进行性发展的共同最终通路[1]。由于肾小管上皮细胞向肌成纤维细胞转化(EMT)在肾间质纤维化变化中的重要性已经为人们认识,所以积极探索有效的预防、抑制甚至逆转EMT的发生对治疗肾间质纤维化进展有重要意义[2]。转化生长因子-β1(TGF-β1)是非常重要的促纤维化因子,结缔组织生长因子(CTGF)是TGF-β1发挥作用的下游效应因子。VEGF是血管新生的主要促进因子[3]。大量表达的VEGF可加重平滑肌细胞增生及血管壁增厚,促进细胞外基质成分在内皮细胞外堆积,导致肾脏纤维化。FK506临床主要应用于器官移植排斥反应等的治疗,近年开始用于免疫性肾脏疾病、结缔组织病等的治疗,但FK506对肾小管上皮细胞转分化中的作用如何研究甚少。本实验的目的在于观察FK506对TGF-β1诱导的体外培养的肾小管上皮细胞转分化的早期影响,并对其可能的作用机制进行探讨。
1 材料与方法
1.1 实验细胞 人类肾小管上皮细胞购自中国典型培养物保藏中心。
1.2 试剂 他克莫司由安斯泰来公司惠赠;DMEM/F12购自美国Gibico公司;0.25%胰蛋白酶购自Thermo公司;辣根过氧化物酶标记的羊抗兔IgG、胎牛血清(FBS)购自北京中山公司;人重组TGF-β1购自Peprotech公司;兔抗人CTGF多克隆抗体,兔抗人VEGF多克隆抗体购自山海天呈公司;TRIzol购自Invitrogen公司;RT-PCR逆转录试剂盒购自Formentas公司;CTGF、VEGF及α-平滑肌肌动蛋白(α-SMA)引物合成(上海生工)。
1.3 方法
1.3.1 HCK细胞形态学观察 HKC细胞培养于DMEM/F12,5%FBS、100U/mL青霉素及100μg/mL链霉素培养基中,于37℃、5%CO2培养箱中孵育,细胞传代采用0.25%胰蛋白酶消化。将细胞按照1×106C个/孔接种于孔板中,细胞生长至70%~80%,换用无血清培养基同步化24h。以未处理的 HKC为对照组,以 TGF-β1(8ng/mL)单独处理48h的HKC为TGF-β1组,以不同浓度FK506单独处理细胞48h为FK506(10、30、60ng/mL)组,以8ng/mL TGF-β1加不同浓度的FK506共同处理细胞48h为 TGF-β1加 FK50(10、30、60 ng/mL)组。然后每4小时在倒置显微镜下观察1次细胞形态。48h后拍照,收集爬片及细胞分别进行以下实验,所有实验重复3次。
1.3.2 细胞免疫组化方法测定各组 HKC细胞CTGF及VEGF蛋白的表达 获得细胞爬片后,以冷PBS洗涤3次,4%多聚甲醛固定20min后吸干,加入PBS水化。0.1%Tritonx-100室温30min,0.3%H2O2室温20min封闭内源性过氧化物酶,5%山羊血清血清室温30min,封闭非特异性抗原,分别加兔抗人CTGF及VEGF多克隆抗体(1∶200、1∶150)4℃过夜。再分别与辣根过氧化物酶标记的羊抗兔IgG二抗37℃孵育40min,DAB显色,苏木素复染,常规脱水、透明、树脂封片;用PBS替代一抗做空白对照,显微镜下观察并照相。
1.3.3 RT-PCR测定细胞mRNA水平的表达 按TRizol说明书提取细胞中的总RNA,紫外分光光度机对RNA定量,用Oligo(dT)引物进行样品RNA(200ng)的反转录,得到cDNA。α-SMA上游5′-GCT CAC GGA GGC ACC CCT GAA-3′下游5′-CTG ATA GGA CAT TGT TAG CAT-3′。CTGF上游5′-CGG CTT ACC GAC TGG AAG AC-3′下 游 5′-CGT CGG TAC ATA CTC CAC AG-3′。VEGF上游5′-ACC ATG AAC TTT CTG CTG TC-3′下游5′-TCA CCG CCT CGG CTT GTC AC-3′。GAPDH 上 游 5′-CAA GGT CAT CCA TGA CAA CTT TG-3′下游5′-GTC CAC CAC CCT GTT GCT GTA G-3′(上海生工)。Real-Time PCR反应体系为:10×PCR缓冲液2.5μL;MgCl2溶液3μL;dNTP混合液3μL;Taq聚合酶3 μL;20μmol/L的PCR特异性上游引物0.5μL;20μmol/L的PCR特异性下游引物0.5μL;cDNA 2μL;加水至总体积为25 μL。反应体系置于Real-Time PCR仪上。分别反应条件:(1)94℃变性3min;35个PCR循环:94℃变性30s;58℃退火30 s;72℃延伸60s。(2)95℃变性1min;45个PCR循环:95℃变性10s;60℃退火1s;72℃延伸10s。(3)94℃变性3min;35个PCR循环:94℃变性30s;58℃退火30s;72℃延伸45 s。(4)94℃变性3min;35个PCR循环:94℃变性30s;58℃退火30s;72℃延伸45s。扩增产物用1%琼脂糖凝胶100V 50min,结果用凝胶成像系统及分析软件进行电泳条带分析,α-SMA基因的浓度除以GAPDH基因的浓度,即为α-SMA基因校正后的相对含量。CTGF基因的浓度除以GAPDH基因的浓度,即为CTGF基因校正后的相对含量。VEGF基因的浓度除以GAPDH基因的浓度,即为VEGF基因校正后的相对含量。
1.4 统计学处理 用SPSS 12.0软件对结果中的数据进行统计学处理,所有数据以x±s表示,组间比较采用单因素方差分析,两两比较用LSD检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 细胞形态的观察 对照组及FK506各浓度组HKC细胞生长6d后,形成融合的单层上皮细胞,呈椭圆形的铺路石样的形态学特征。加TGF-β1培养48h后细胞呈现成纤维细胞样梭形外观,且细胞生长排列紊乱,细胞发生了转分化。同时加入不同剂量的FK506和TGF-β1共同作用组,观察到部分细胞形态维持正常的细胞形态,仍存在部分发生形态改变的细胞,似成纤维细胞样。
2.2 FK506对α-SMA mRNA表达的影响 对照组少量表达α-SMA mRNA,不同浓度FK506作用48h后,较对照组α-SMA mRNA表达量变化差异无统计学意义(P>0.05),TGF-β1干预48h后,较对照组α-SMA mRNA表达量显著上升(P<0.05),FK506可以减少 TGF-β1诱导的 α-SMA mRNA表达,且随着FK506剂量的增加抑制作用逐渐增强,并呈剂量依赖性(P<0.05),见图1、表1。
2.3 FK506对CTGF及VEGF表达的影响
2.3.1 细胞免疫组化SP法检测CTGF及VEGF表达的变化将每张片在×100高倍镜下,顺时针盲法计算15个高倍视野中,阳性细胞百分率=总阳性细胞数/总细胞数,每组实验重复3次。对照组和FK506各浓度组CTGF阳性细胞占总HKC细胞的面积比值均很低(3.21%~4.13%),各组之间差异无统计学意义(P>0.05),TGF-β1组见大量细胞质中呈棕黄色,为CTGF表达阳性,阳性细胞占总HKC细胞的面积比值是15.42%,与对照组和FK506各浓度组差异有统计学意义(P<0.05),与 TGF-β1 组 比 较,加 入 FK506(10、30、60 ng/mL)共同作用48h后,CTGF阳性细胞占总HKC细胞的面积比值分别为11.83%、9.25%、6.54%,呈剂量依赖性(P<0.05)。见封3图2。对照组VEGF阳性细胞占总HKC细胞的面积比值7.54%,FK506各浓度组(7.2%~7.6%)与对照组比较差异无统计学意义(P>0.05),TGF-β1组见大量细胞胞质中呈棕黄色,为VEGF表达阳性,阳性细胞占总HKC细胞的面积比值是23.07%,与对照组和FK506各浓度组差异有统计学意义(P<0.01),与 TGF-β1组比较,TGF-β1加 FK506(10、30、60ng/mL)组作用48h后,VEGF阳性细胞占总 HKC细胞的面积比值分别为17.28%、14.25%、10.21%,呈剂量依赖性(P<0.05)。见封3图3。
2.3.2 RT-PCR定量检测 对照组少量CTGF mRNA的表达,TGF-β1干预48h后,较对照组CTGF mRNA表达量显著上升(P<0.05),FK506各浓度组作用48h后,较对照组CTGF mRNA表达量差异无统计学意义(P>0.05),但 TGF-β1加FK506(10、30、60ng/mL)组作用48h后可减少 TGF-β1诱导的CTGF mRNA表达,且随着FK506剂量的增加抑制作用逐渐增强,并呈剂量依赖性(P<0.05),见图4、表1。
表1 FK506对各组细胞α-SMA mRNA、CTGF mRNA及VEGFF mRNA含量的变化(±s,%,n=3)
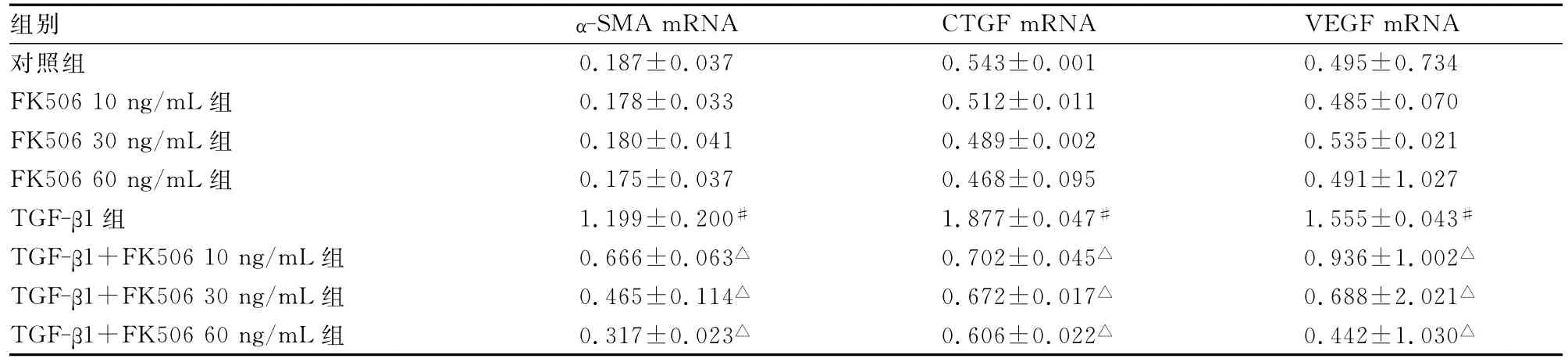
表1 FK506对各组细胞α-SMA mRNA、CTGF mRNA及VEGFF mRNA含量的变化(±s,%,n=3)
△:P<0.05,与TGF-β1组比较;#:P<0.01,与对照组比较。
组别α-SMA mRNA CTGF mRNA VEGF mRNA对照组0.187±0.037 0.543±0.001 0.495±0.734 FK506 10ng/mL组 0.178±0.033 0.512±0.011 0.485±0.070 FK506 30ng/mL组 0.180±0.041 0.489±0.002 0.535±0.021 FK506 60ng/mL组 0.175±0.037 0.468±0.095 0.491±1.027 TGF-β1组 1.199±0.200# 1.877±0.047# 1.555±0.043#TGF-β1+FK506 10ng/mL组 0.666±0.063△ 0.702±0.045△ 0.936±1.002△TGF-β1+FK506 30ng/mL组 0.465±0.114△ 0.672±0.017△ 0.688±2.021△TGF-β1+FK506 60ng/mL组 0.317±0.023△ 0.606±0.022△ 0.442±1.030△
对照组有基础量VEGF mRNA的表达,TGF-β1干预48h后,对照组VEGF mRNA表达量明显上升(P<0.05),不同浓度FK506作用48h后,较对照组VEGF mRNA表达量差异无统计学意义(P>0.05),但 TGF-β1加 FK506(10、30、60ng/mL)组作用后可减少TGF-β1诱导的 VEGF mRNA表达,且随着FK506剂量的增加抑制作用逐渐增强,并呈剂量依赖性(P<0.05),见图5、表1。

图1 RT-PCR测定不同组α-SMA及内对照GAPDH的mRNA表达

图4 RT-PCR测定不同组CTGF及内对照GAPDH的mRNA表达

图5 RT-PCR测定不同组VEGF及内对照GAPDH的mRNA表达
3 讨 论
大量研究已证实,在肾脏中TGF-β1可以活化成纤维细胞、促进小管上皮细胞转分化、刺激ECM合成,使肾小管上皮细胞表型发生改变,失去表达细胞角蛋白,钙粘蛋白等上皮细胞标记抗原,开始表达肌成纤维细胞标志物如α-SMA[4-5]。本实验使用TGF-β1作为直接的刺激因子,对 HKC作用48h后,细胞拉长、肥大呈现成纤维细胞样梭形外观,且细胞生长排列紊乱。CTGF是TGF-β1发挥致纤维化作用的下游效应因子,TGF-β1可通过Ⅰ型转化生长因子β受体(TβRI)/激活素受体样激酶5(ALK-5)依赖Smad2信号途径促进CTGF的表达。CTGF是TGF-β1的正反馈因子,放大TGF-β1的作用,而不影响其抗炎和免疫调节的作用,是一个更加理想的抗纤维化靶点[6-7]。
VEGF是维持血管内皮细胞生存、再生及其功能的重要因子[8]。在生理状态下,肾脏有基础量的VEGF的表达,对维持肾血管结构及正常生理功能是必需的[9]。大量表达的VEGF可介导肾小球系膜细胞和肾小球足突细胞产生细胞外基质而参与肾小球硬化的发生[10-11],增加肾小球滤过屏障的通透性、使多种炎症因子渗出和分泌,加剧炎性反应[12],促进肾脏纤维化。在近来的研究中,TGF-β1与VEGF关系的研究也取得了显著进展。TGF-β1可能通过蛋白激酶C途径上调近端小管上皮细胞VEGF的表达,增加单核细胞的趋化作用加重平滑肌细胞增生及血管壁增厚,管腔狭窄及闭塞等引起肾血流量减少,使毛细血管袢及管周毛细血管数量增加,毛细血管球通透性增加,促进细胞外基质成分在内皮细胞外堆积,促进炎细胞在间质的浸润,导致肾脏纤维化[13]。Kang等[14]在5/6肾切除大鼠慢性肾衰模型中观察到早期VEGF明显增加,随后随着肾小球VEGF表达下降,肾小球毛细血管损伤越重,肾小球硬化程度也越重。最近有研究报道VEGF可促进糖尿病小鼠肾小球新生血管生成,VEGF表达上调与糖尿病肾脏病变密切相关[15]。
本实验观察到,TGF-β1作用48h后CTGF及VEGF表达明显增加,说明早期CTGF、VEGF加重了TGF-β1诱导的肾小管上皮细胞转分化。TGF-β1及FK506共同作用48h检测到CTGF、VEGF mRNA均明显下调,说明在TGF-β1诱导的肾小管上皮细胞转分化的早期FK506下调CTGF、VEGF表达,抑制了肾间质纤维化的进展,且呈剂量依赖性。随着TGF-β1作用时间的延长,在慢性肾功能损伤的后期CTGF及VEGF的变化,及FK506对其的作用,在今后的实验中会进一步探讨。
综上所述,FK506可以抑制TGF-β1介导的肾小管上皮细胞致纤维化作用,其作用可能为下调转分化早期CTGF及VEGF的表达,保护肾组织血管床,维持肾小管上皮细胞正常的功能,为FK506临床上早期应用于慢性肾纤维化的防治提供了一定的理论依据。
[1]Nangaku M.Mechanisms of tubulointerstitial injury in the kidney:final common pathways to end-stage renal failure[J].Int Med,2004,43(1):9-7.
[2]Liu YH.Epithelial to mesenchymal transition in renal fibrogenesis:pathologic significance,molecular mechanism,and therapeutic intervention[J].J Am Soc Nephrol,2004,15(1):1-5.
[3]Cox CM,D′Agostino SL,Miller MK,et al.Apelin,the ligand for the endothelial G-protein-coupled receptor,APJ,is a potent angiogenic factor required for normal vascular development of the frog embryo[J].Dev Biol,2006,296(1):177-189.
[4]Schmierer B,Hill CS.TGF beta-SMAD signal transduction:molecular specificity and functional flexibility[J].Nat Rev Mol Cell Biol,2007,8(12):970-982.
[5]Bot tinger EP,Bitzer M.TGF2beta signaling in renal disease[J].J Am Soc Nephrol,2002,13(2):2600-2610.
[6]Phanish MK,Winn SK,Dockrell ME.Connective tissue growth factor-(CTGF,CCN2)-a marker,mediator and therapeutic target for renal fibrosis[J].Nephron Exp Nephrol,2010,114(3):83-92.
[7]Chen XM,Qi W,Pollock CA,CTGF and chronic kidney fibrosis[M].Front Biosci:Schol Ed,2009:132-141.
[8]Kang DH,Kanellis J,Hugo C,et al.Role of the microvascular endothelium in progressive renal disease[J].J Am SocNephrol,2002,13(3):806-816.
[9]Maharaj AS,Saint-Geniez M,Maldonado AE,et al.Vascular endothelial growth factor localization in the adult[J].Am J Pathol,2006,168(2):639-648.
[10]Wang L,Kwak JH,Kim SI,et al.Transforming growth factor-beta1stimulates vascular endothelial growth factor 164via3 -p38alpha mitogen-activated protein kinase andp38delta mitogen-activated protein kinase-dependent pathway in murine mesangial cells[J].Biol Chem,2004,279(32):33213-33219.
[11]Chen S,Kasama Y,Lee JS,et al.Podocyte-derived vascular endothelial growth factor mediates the stimulation of alpha3(IV)collagen production by transforming growth factor-1in mouse podocytes[J].Diabetes,2004,53(11):2939-2949.
[12]Kim NH,Oh JH,Se JA,et al.Vascular endothelial growth factor(VEGF)and soluble VEGF receptor FLT-1in diabetic nephropathy[J].Kidney Int,2005,67(1):167-171.
[13]Affleck DG,Bull DA,Bailey SH,et al.PDGF(BB)increases myocardial production of VEGF:shift in VEGF mRNA splice variants after direct injection of bFGF,PDGF(BB),and PDGF(AB)[J].J Surg Res,2002,107(2):203-209.
[14]Kang DH,Joly AH,Oh SW,et al.Impaired angiogenesis in the remnant kidney model(Ⅰ):Potential role of vascular endothelial growth factor and thrombospondin211[J].Am Soc Nephrol,2001,12(7):1434-1447.
[15]田河林,韦立顺,许忠新,等.糖尿病小鼠肾小球微血管密度与VEGF表达的研究[J].中国病理生理杂志,2012,28(2):358-361.
Effects of Tacrolimus on transdifferentiation and CTGF,VEGF early expression of human renal tubular epithelial cells
Min Yali,Zhao Donghui,Yu Qian
(Department of Nephrology,First People′s Hospital of Guiyang City,Guiyang,Guizhou550004,China)
ObjectiveTo explore different doses of tacrolimus(FK506)to renal tubular epithelial cells(HKC)transdifferentiation and its early action on connective tissue growth factor(CTGF),vascular endothelialgrowth factor(VEGF)expressing change.MethodsThe human kidney cells(HKC)were cultured for 48hours in different conditions:(1)Serum free as control,(2)Treated with TGF-β1(8ng/mL);(3)Treated with FK506at different concentration(10,30,60ng/mL);(4)Treated with FK506at different concentration(10,30,60ng/mL)plus TGF-β1(ng/mL).The expression ofα-SMA was assessed with RT-PCR,The expression of CTGF,VEGF was assessed with RT-PCR and immunohistochemistry after 48hours.ResultsCompared with the control group,The expression of CTGF,VEGF andα-SMA mRNA was markedly increased in HCK cultured with TGF-β1group(P<0.05),which were suppressed significantly in HKC cultured with TGF-β1plus FK506group(P<0.05).ConclusionThe inhibition of FK506on transdifferentiation of tubular epithelial cells may be related to the down-regulation of VEGF,CTGF.
tacrolimus;kidney tubules;cell transdifferentiation;vascular endothelial growth factors;connective tissue growth factor
10.3969/j.issn.1671-8348.2012.32.019
A
1671-8348(2012)32-3401-03
2012-04-07
2012-08-13)
·基础研究·

