三聚氰胺对鲤鱼组织SOD、POD和MDA含量的影响
吴红松
(菏泽学院,山东菏泽274015)
三聚氰胺(C3N5H6)是重要的有机化工中间产品,但由于其含氮量很高(66%),近年来作为一种提高饲料或食品中蛋白质检测指标的所谓“蛋白精”非法加入饲料或食品中采取暴利,产生了非常恶劣的影响。2007年,发生在美国的三聚氰胺混合于食物原料中所引起的宠物中毒事件,使这一化合物引起了广泛关注;2008年发生在中国的三聚氰胺奶粉事件,更使这个化合物成为食品公共安全的焦点。
黄河鲤鱼隶属于鲤形目、鲤科、鲤亚科、鲤属,国内年产量已达200多万吨,占淡水养殖总量的15%左右,在淡水养殖品种中列第4位。由于蛋白原料在水产饲料中所占的比例要远远大于其他动物饲料,因此,三聚氰胺对水产动物的影响更是不容忽视。有关三聚氰胺在哺乳动物中的毒性作用已有研究[1-6],但对鱼类的毒性研究目前仅限于急性毒性试验报道或鱼组织中三聚氰胺及其类似物的检测方法[7-9],而关于三聚氰胺对鱼类各组织结构的损伤程度如何还未见报道。
因此,本文以黄河鲤鱼为试验用动物,通过注射染毒,研究三聚氰胺对鲤鱼各器官中超氧化物歧化酶(SOD)和过氧化物酶(POD)活性及丙二醛(MDA)含量的影响,以期为三聚氰胺在水产饲料中的安全性评价提供基础数据。
1 材料与方法
1.1 材料
1.1.1 试验用动物 鲤鱼,购于菏泽东明黄河养殖场。体重46.25 g±7.81 g,体长18.15 cm±4.50 cm。在实验室暂养1周后,选取活泼、无病、体表无损伤的个体进行染毒试验。
1.1.2 主要试剂 三聚氰胺为北京国药集团化学试剂有限公司产品;邻苯三酚为天津市科密欧化学试剂有限公司产品;Tris为天津市科密欧化学试剂有限公司产品;EDTA为上海试剂一厂产品。
1.1.3 仪器设备 冰冻离心机,Gl-20G-723分光光度计,恒温箱,电子天平,玻璃匀浆器,水浴锅等。
1.2 方法
1.2.1 染毒方法 本试验共设5个处理组,1个对照组,每组10条鲤鱼,每个处理3个重复。依据急性毒性试验结果(预先对相同规格的鲤鱼进行急性毒性试验),设置三聚氰胺腹腔注射浓度为1、10、100、1 000、2 000 mg/L,剂量为1 mL/100 g。试验在50 L塑料水箱中进行,每箱内装30 L水,水温为15℃±1℃。
1.2.2 酶液的提取 处理48 h后,从各处理组随机各取鲤鱼3条,放在冰盘内迅速解剖,取出鲤鱼的脑、肝、肾、鳃,用预冷的6.5 g/L的生理盐水冲洗干净表面血迹,吸水纸吸干水分,电子天平上称重,并以 W(g)∶V(mL)=1∶4的比例加入预冷的6.5 g/L生理盐水,玻璃匀浆器匀浆,离心(4℃,2 000 r/min,20 min),取上清液,置于4℃冰箱备用,24 h内测量完成。
1.2.3 酶活性测定 SOD酶活性的测定采用邻苯三酚法[11],活力单位定义为每毫克蛋白,每分钟抑制邻苯三酚自氧化速率达50%时的酶量为1个活力单位。POD酶活性的测定参考张贵生[12]的方法,活力单位定义为每分钟OD 470nm变化0.01为1个过氧化物酶活力单位。MDA测定采用硫代巴比妥酸在532 nm处进行比色测定[13]。
1.2.4 统计处理 利用SPSS软件,求出平均值±标准偏差,并进行单因素方差分析(ANOVA),各试验组与对照组之间的两两比较采用最小显著差数法(LSD),取显著性水平为0.05。
2 结果
2.1 不同浓度的三聚氰胺对鲤鱼脑、肝、肾、腮中超氧化物岐化酶(SOD)活性的影响
由表1可见,在三聚氰胺作用下,鲤鱼脑、肝、肾、腮中SOD活性先表现为上升,且存在一定的剂量-效应关系,在10 mg/L浓度时各组织中SOD活性达到最高,除肝外均表现为显著诱导(P<0.05),此后酶活性开始下降,即在100、1 000、2 000 mg/L高浓度处理组,均表现为抑制,其中在肝、肾、腮中为显著抑制(P<0.05)。说明在三聚氰胺对各组织SOD活性表现出了组织差异性,对脑影响不显著,对肝、肾、腮表现出强烈抑制作用。
2.2 不同浓度的三聚氰胺对鲤鱼脑、肝、肾、腮中过氧化氢酶(POD)活性的影响
由表2可见,在三聚氰胺作用下,鲤鱼脑、肝、肾、腮中POD活性先表现为上升,且存在一定的剂量-效应关系,在10 mg/L浓度时肝、肾、腮中POD活性达到最高,而脑中POD活性在100 mg/L浓度下达到最高,但均表现为极显著诱导(P<0.01),此后酶活性开始下降,在1 000 mg/L、2 000 mg/L高浓度处理下,均表现为抑制,但均比对照组高。说明在注射浓度范围内,三聚氰胺对各组织中POD活性,均表现为低促高抑的特点,但诱导作用尤为明显。
2.3 不同浓度的三聚氰胺对鲤鱼脑、肝、肾、腮中丙二醛(MDA)含量的影响
表3显示,随着三聚氰胺浓度的升高,脑、肝、肾、腮中MDA含量存在一定的剂量-效应关系,与对照组相比,在1 mg/L处理浓度下,肾中MDA含量差异较脑、肝、腮中显著,在10 mg/L处理浓度下,各组织中 MDA含量差异显著(P<0.05),在100、1 000、2 000 mg/L高浓度下,各组织中 MDA含量差异极显著(P<0.01),说明试验注射三聚氰胺的剂量能明显地引起各组织细胞氧化损伤,破坏细胞膜的通透性和完整性。且表现出了组织差异性,对脑、肝、腮的损伤不如对肾的明显。

表1 三聚氰胺对鲤鱼不同组织中SOD活性的影响Table1 Effect of melamine on SOD activities in different tissues of C.carpio U/mg

表2 三聚氰胺对鲤鱼不同组织中POD活性的影响Table2 Effect of melamine on POD activities in different tissues of C.carpio U/mg
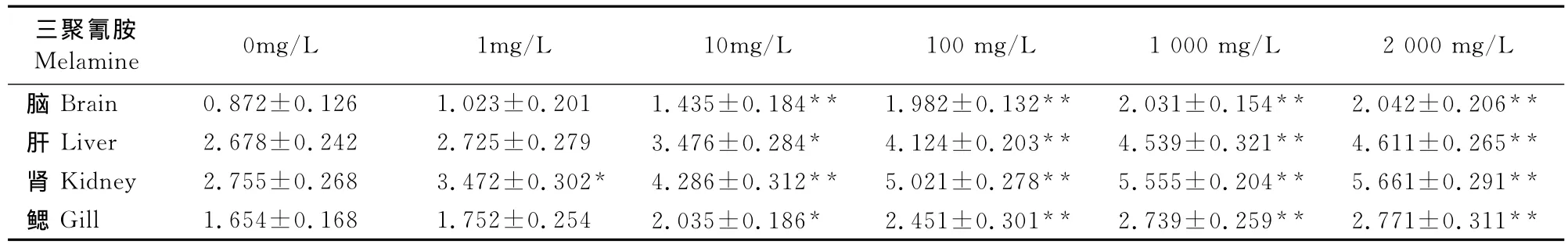
表3 三聚氰胺对鲤鱼不同组织中MDA含量的影响Table3 Effect of melamine on MDA content in different tissues of C.carpio μmol/mg
3 讨论
有机体由于新陈代谢和各种生物化学反应,不断产生自由基,如超氧阴离子(O2-·)、过氧化氢(H2O2)和羟自由基(OH-·)等,这些自由基可引起细胞成分发生化学变化和损害,而机体通过动员其抗氧化系统以对抗自由基的毒性作用。一旦外界因素引起自由基损伤系统和防御系统平衡失调时,产生的自由基不能及时被清除,则会引起细胞的损伤。
鱼体中SOD是一类金属酶含Cu、Zn原子,能催化超氧阴离子自由基(O2-·)转化为过氧化物,POD等酶类又进一步催化组织中低浓度的过氧化物氧化其他底物,清除过氧化物和H2O2,从而降低自由基对机体的损害作用。本试验表明,在腹腔注射1 mg/L、10 mg/L三聚氰胺时,各组织SOD活性显著高于对照组(P<0.05),表明少量三聚氰胺诱导机体产生免疫兴奋效应,激活相关酶类活性,导致有氧代谢旺盛,产生较多的自由基,自由基刺激SOD的mRNA高水平表达,提高了SOD活性;注射浓度为2 000 mg/L时,各组织SOD显著低于对照组(P<0.05),表明大量的三聚氰胺诱导机体产生自由基的量超过了机体的代偿能力,导致抗氧化酶出现消耗性降低,过量的自由基攻击细胞,破坏了SOD防御系统,SOD活性降低。
在注射浓度为1 mg/L、10 mg/L时,各组织中POD活性极显著高于对照组(P<0.01),表明少量三聚氰胺引起机体发生应激反应,刺激细胞合成大量POD酶,提高POD酶活性;注射浓度为1 000 mg/L、2 000 mg/L时,各组织中 POD 活性逐步降低,表明随着机体摄入三聚氰胺量的增加,机体在短时间产生的过量过氧化物无法及时被清除,长时间攻击细胞,破坏了抗氧化系统,抑制了POD酶的合成,导致POD酶活性降低。
丙二醛(MDA)是过氧化脂质的降解产物,能使蛋白质和核酸受损,导致细胞和组织损伤。其含量的高低反映机体细胞遭受自由基攻击的程度。本试验表明,在三聚氰胺作用下,各组织中MDA含量高于对照组,表明机体摄入大量三聚氰胺后破坏了机体抗氧化酶机制,抗氧化酶活性下降,过量的自由基无法被清除,导致大量脂质过氧化物降解,MDA含量增加。
综上所述,三聚氰胺对鲤鱼脑、肝、肾、腮中SOD、POD活性及MDA含量的改变,可能间接反映了各组织结构的损伤程度,但其代谢及残留情况如何等还有待进一步研究。
[1]刘 颖,丁 良,栗建辉,等.三聚氰胺对大鼠肾脏毒性损害的病理研究[J].中国中医药咨讯,2010,2(16):159-161.
[2]李建红,刘永杰,魏学良.三聚氰胺及其衍生物对比格犬肾脏和睾丸的毒性评价[J].中国农学通报,2010,26(11):7-12.
[3]邵静君,温家琪,徐世文.三聚氰胺毒理学研究进展[J].现代畜牧兽医,2007(12):52-54.
[4]Cianeiolo R E,Bischoff K,Ebel J G,et al.Clinicopathologic,histologic and toxicologic findings in 70 cats inadvertently exposed to pet food contaminated with melamine and cyanuric acid[J].J Ame Vet Med Ass,2008,233(5):729-737.
[5]Dobson R L,Motlagh S,Quijano M,et al.Identification and characterization of toxicity of contaminants in pet food leading to an outbreak of renal toxicity in cats and dogs[J].Toxicol Sci,2008,106(1):251-262.
[6]林祥梅,王建峰,贾广乐,等.三聚氰胺的毒性研究[J].毒理学杂志,2008,22(3):216-218.
[7]刘海燕,张 伟,薛 敏,等.三聚氰胺对花鲈的急性毒性实验研究[J].水生生物学报,2009,33(2):157-163.
[8]Reimschuessel R,Gieseker C M,Miller R A,et al.Evaluation of the renal effects of experimental feeding of melamine and cyanuric acid to fish and pigs[J].Amer J Vet Res,2008,69:1217-1228.
[9]Karbiwnyk C M,Andersen W C,Turnipseed S B,et al.Determination of cyanuric acid residues in catfish,trout,tilapia,salmon and shrimp by liquid chromatography-tandem mass spectrometry[J].Analytica Chimica Acta,2009,637:101-111.
[10]赵驱华,高向阳.生物化学实验技术教程[M].广东广州:华南理工大学出版社,2004:40-42.
[11]李永利,张 淼.邻苯三酚自氧化法测定SOD活性[J].中国卫生检验杂志,2000,10(6):673.
[12]张贵生.稀土元素对鲤鱼肝胰脏多种酶及MDA含量的影响[J].生物技术,2008,18(2):36-38.
[13]李合生.植物生理生物实验原理和技术[J].北京:高等教育出版社,2000:260-261.

