紫斑牡丹胚培养及幼苗生长的研究
王 莹,何桂梅,韩丽晓
(1.北京林业大学园林学院,北京 100083;2.北京市林业碳汇工作办公室,北京 100013)
紫斑牡丹(Paeonia rockii T.Hong et J.J.Li)是中国牡丹家族中的重要成员之一,以其作为主要遗传种质演化形成的西北(紫斑)牡丹品种群是目前中国牡丹中仅次于中原牡丹的第二大品种群[1]。紫斑牡丹植株长势强盛、开花繁茂、花头直立,具有抗寒、耐旱、抗病和耐瘠薄等优良特性[2],是我国牡丹育种和遗传改良极为珍贵的野生种质资源。自然栽培条件下紫斑牡丹属于专性有性繁殖[3],由于种子具有典型的上胚轴休眠现象导致其发芽率极低,幼苗质量不稳定[4],在很大程度上制约了牡丹的繁殖及育种工作。
胚培养技术现已在植物远缘杂交、克服顽拗种子休眠及发育生物学等研究方面得以广泛应用,对提高种子萌发率、缩短萌发时间、及时进行杂种胚拯救、加速育种进程都有重要意义[5]。目前,牡丹胚培养研究主要包括不同基因型离体胚培养、丛生苗诱导及植株再生、生长调节剂对离体胚萌发及生长的影响[6-12],而这些研究都没能建立高效稳定的成苗体系,紫斑牡丹的胚培养也鲜有报道。笔者先研究紫斑牡丹胚离体生长与成苗过程中的影响因素,确定适宜的培养基;再选择不同成熟度的种胚通过不同外植体类型进行试验,摸索出紫斑牡丹胚培养最适宜的采种时间以及外植体类型,旨在建立稳定的紫斑牡丹胚培养体系,并为胚培养技术辅助远缘杂交育种提供参考。
1 材料与方法
1.1 材 料
以紫斑牡丹(P.rockii hybrid)自然授粉花后约90 d 与120 d 的紫斑牡丹种子为试验材料(从北京林学会基地的健壮植株上采得)。外植体分为离体胚和带胚乳两种。试验在北京林业大学科研楼组培室进行,培养条件:温度20~25℃,光照强度为2 000~3 000 Lx,光照时间12 h/d。
1.2 试验方法
1.2.1 消毒与接种 种子剥出后用洗涤灵溶液将其表面漂洗干净,流水冲洗30 min 后置于超净工作台上。用70%酒精与10% 84 消毒液分别消毒种子3 min 与15 min。各次消毒后均用无菌水冲洗3次,每次浸泡3 min。接种于不同启动培养基上,每瓶(100 mL)接种3 个,3 瓶为一个处理,重复3 次。
1.2.2 启动培养基筛选 以1/2 MS 为基本培养基,附加不同浓度的PGRs(Plant growth regulators—植物生长调节剂),接种后35 d 调查种胚的萌发生长效果,筛选出最佳的启动培养基。在此基础上以1/2 MS+最适PGRs 为启动培养基。每周定期观察启动生长表现,继代周期35 d。
1.2.3 继代培养基筛选 以1/2 MS+0.05% AC 为基本继代培养基,附加不同浓度的IBA,将接种于附加不同浓度的PGRs 启动培养基上的幼苗进行继代,观察继代生长表现,从而筛选出最佳继代培养基。在此基础上以1/2 MS+0.05% AC+最适IBA为继代培养基,分别将生长于1/2 MS+最适PGRs启动培养基上的幼苗进行继代,每周定期观察继代生长表现。
2 结果与分析
2.1 不同培养基对紫斑牡丹种胚启动生长的影响
以1/2 MS 为基本启动培养基,通过PGRs 的不同种类及浓度的组合进行了启动培养基的筛选,发现PGRs 的应用使得各培养基上幼胚的胚轴普遍膨大,部分长出大量的愈伤组织(表1)。其中在3号培养基中胚轴膨大率最高为100%,胚轴膨大率较高的3、6、7、8 号与其他培养基的差异显著,胚轴膨大率较低的1、2、10 号三者之间没有显著差异,说明单一低浓度的BAP(0.5 mg/L)与GA3(0.5 mg/L)对胚轴的刺激作用不明显,二者与低浓度IBA(0.25 mg/L)混合使用也有相似效果。在9 号和7 号培养基中抽腋芽或分化叶状体率最高,除与1 号和6 号差异不显著外,与其他培养基均有显著差异。而在成苗率上5 号培养基为最高,与其余培养基差异显著。综合认为,1/2 MS+1.0 mg/L IAA+1.0 mg/L GA3(5 号培养基)为最适宜成苗的启动培养基。
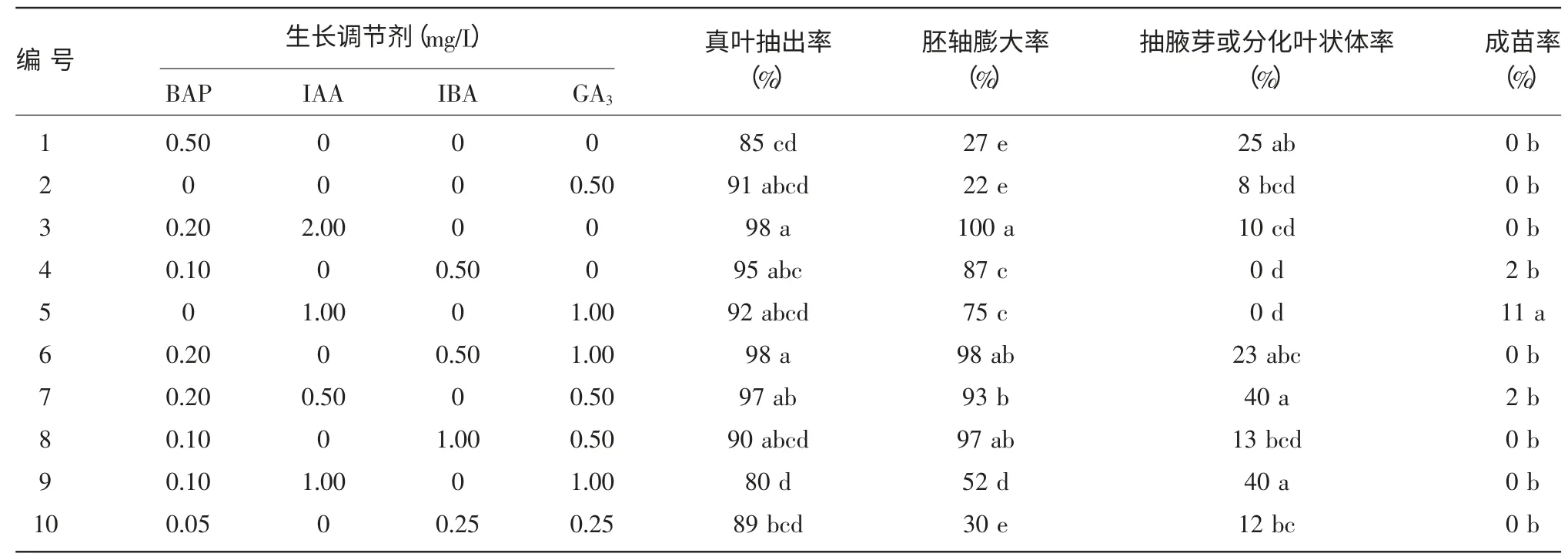
表1 培养基对紫斑牡丹种胚启动生长的影响(35 d)
2.2 不同培养基对紫斑牡丹种胚继代生长的影响
幼苗用3 水平的IBA(0.1、0.2、0.4 mg/L)进行10~15 d 短期根诱导后再继代至不含PGRs 的培养基中,共培养85 d 统计结果(表2)。发现仅4 号的生根率及成苗率与其他的差异显著,说明对于胚培养苗的继代生长而言,不含PGRs 的1/2MS 培养基已经可以达到较好的效果,成苗率均可达到50%。另外发现IBA 根诱导处理后,低浓度的IBA(0.1、0.2 mg/L)对幼苗生长差异不显著,高浓度的IBA(0.4 mg/L)反而抑制幼苗的生长。其中0.1 mg/L IBA 对幼苗的叶片数、生根率及成苗率等都有一定程度的提高,因此1/2 MS+0.05%AC+0.1 mg/L IBA为根诱导最佳培养基,1/2 MS+0.05% AC 为继代生长最佳培养基。
2.3 紫斑牡丹采种时间及外植体类型对启动生长的影响
以1/2MS+1.0 mg/L IAA+1.0 mg/L GA3为培养基,分别选择紫斑牡丹花后90 d 和120 d 采收种子,按外植体类型分为离体胚和去种皮带全部胚乳。研究表明(表3),从胚轴膨大率上可以看出,不论采收时间为何时,外植体为全部胚乳的表现明显好于离体胚,并且它们之间差异显著;从抽真叶率和抽茎率上可以看出,花后120 d 全部胚乳的处理最好,与其他处理间差异显著;而从叶柄长可以看出,花后90 d 离体胚的处理最好,与其他处理间差异显著。说明以全部胚乳为外植体对胚轴的膨大生长有一定作用,花后120 d 采收有助于种子的抽真叶与抽茎生长,而对于叶柄生长则以花后90 d 的离体胚处理效果最好。
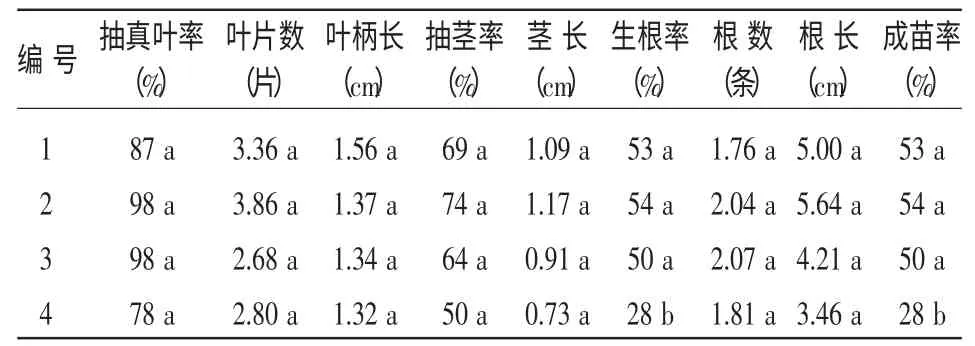
表2 培养基对紫斑牡丹种胚继代生长的影响(85 d)
2.4 紫斑牡丹采种时间及外植体类型对继代生长的影响
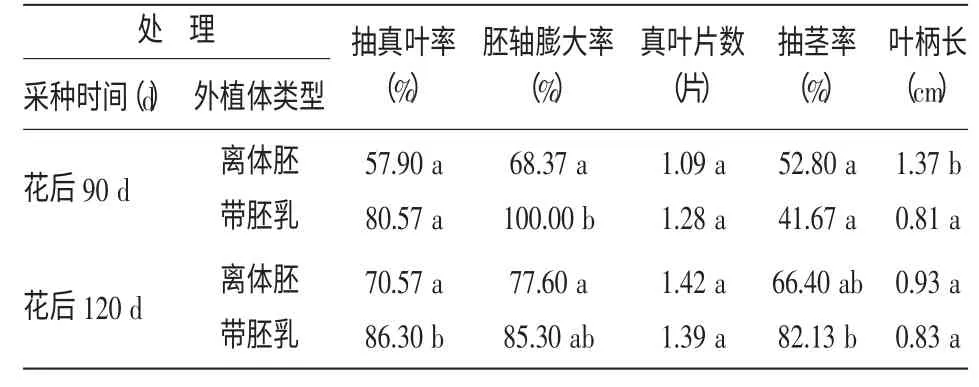
表3 紫斑牡丹的不同处理在启动培养基中的生长表现(30 d)
将启动培养基中的幼苗以1/2 MS+0.05% AC+0.1 mg/L IBA 为根诱导培养基进行短期培养,之后转入1/2 MS+0.05% AC 的继代生长培养基中。从启动培养到继代培养共85 d,结果表明(表4),从抽真叶率和抽茎率上可以看出不论采收时间为何时,外植体为全部胚乳的表现好于离体胚,并且差异显著;从叶柄长和茎长可以看出花后90 d 离体胚的处理生长要好于其他处理,并且在茎长上有显著性差异。说明由于外植体类型的不同,会导致植株生长在不同指标上表现出差异性。带全部胚乳的接种方式对抽真叶、抽茎等萌发生长有利,而离体胚的接种方式则对茎长、叶柄长等伸长生长有利。
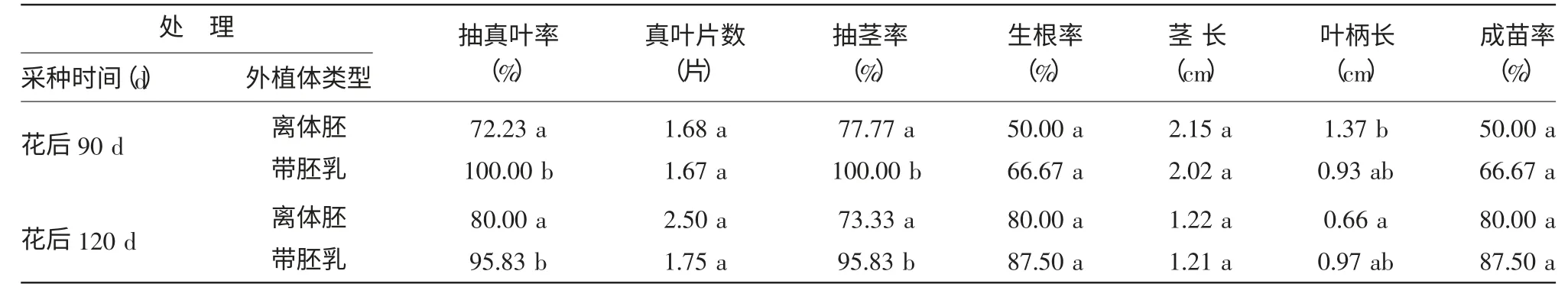
表4 紫斑牡丹的不同处理在继代培养基中的生长表现(85 d)
2.5 不同处理对紫斑牡丹胚培养幼苗生长的显著性分析
在启动培养阶段(表5),研究发现采种时间的不同对真叶片数、抽茎率、叶柄长有显著影响,其中对抽茎率有极显著影响;外植体类型对抽真叶率、胚轴膨大率、叶柄长有显著影响;其中对胚轴膨大率和叶柄长均有极显著影响;而采种时间*接种方式两者间的交互效应均对胚轴膨大率与叶柄长有显著影响,其中对叶柄长有极显著影响。

表5 紫斑牡丹的不同处理在启动培养基中的生长显著性分析(30 d)
在继代生长阶段(表6),采种时间的不同对真叶片数、叶柄长、茎长有显著影响,其中对叶柄长有极显著影响;外植体类型对抽真叶率及抽茎率有极显著影响;而采种时间*接种方式两者间的交互效应仅对茎长有显著影响。
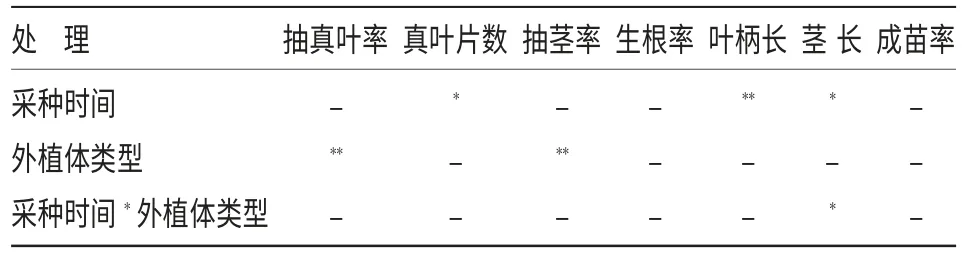
表6 紫斑牡丹的不同处理在继代培养基中的生长显著性分析(85 d)
综合认为在紫斑牡丹胚培养过程中,种子的采收时间对真叶片数、叶柄长、茎长等指标影响显著,说明种子成熟度的不同会影响幼苗的伸长生长;外植体类型对抽茎率、抽真叶率、胚轴膨大率等指标影响显著,说明胚乳存在与否直接影响种子的萌发情况。
3 讨 论
紫斑牡丹胚培养研究的目标是获得高质量幼苗,而种胚能否正常启动与启动培养基的成分密切相关。研究结果表明,以1/2 MS 为基本培养基,附加不同浓度的PGRs,其中单独使用BAP 可促进胚子叶增大、胚轴增粗,这与曹小勇[12]的观察结果相似。GA3能解除部分胚轴的休眠,促进茎的伸长,单独使用效果同BAP 相似,这与Buchheim[13]对芍药的研究结果相符合。IAA 与GA31∶1 配合时抽真叶率、生根率及成苗率都较高,因此筛选出最适宜种胚启动生长的培养基为1/2 MS+1.0 mg/L IAA+1.0 mg/L GA3。
目前牡丹组培快繁技术无法应用于生产的瓶颈主要在于组培苗生根困难,影响生根的因素主要包括前一次的继代时间、生根芽的类型及生根方法等[14]。对幼苗短期的根诱导处理发现,IBA 的浓度直接影响幼苗的继代生长情况,低浓度IBA(0.1 mg/L)可以促进幼苗生长,高浓度的IBA(0.4 mg/L)反而抑制幼苗生长,最适宜的根诱导培养基为1/2 MS+0.05%AC+0.1 mg/L IBA。研究还发现PGRs 对幼苗发育具有明显的致畸作用,因此对于生根后幼苗生长的培养基选择不含PGRs 的1/2 MS+0.05%AC。
紫斑牡丹为专性有性繁殖,实生苗一般需要3~5 a 才能开花,而从杂交授粉到一个优质新品种的选育过程至少需要10 a 以上的时间。在此过程中,由于种子具有上胚轴休眠特性,因此自然条件下其成熟与萌发也需要较长时间,并且萌发率与成苗率都不高,很难获得整齐一致的幼苗。本研究在已筛选出最适宜培养基的基础上,试图通过种子成熟度以及外植体类型来找到既能使种子快速萌发又能提高成苗质量的有效途径。虽然带全部胚乳的种子在生长上没有离体胚启动快[15],但是当全部胚乳接种长出胚根后,及时去掉胚乳再接回原培养基中,幼苗生长质量要优于离体胚的生长。由于紫斑牡丹胚乳中含有较高的还原糖及脂肪,为胚休眠、萌发提供了丰富的营养物质[16],种子萌发也具有明显的阶段性,在萌发过程中,需要胚乳提供营养,一旦胚乳完成此功能需及时去掉,否则会抑制幼苗生长。种子采收时间的不同,直接影响种子的成熟度,这就与胚乳提供营养的情况密切相关,目前关于还原糖、淀粉、粗脂肪可能在种子各个萌发阶段中的作用还不是很清楚,尚待进一步研究。
研究设计从启动培养到继代生长共85 d,获得的幼苗绝大多数具有多片真叶及抽茎或已生根,提前了发育时期,缩短了种子的萌发期。因此,一个可靠的快繁体系可能克服牡丹在繁殖及育种方面的问题[17],如果能将胚培养技术与牡丹远缘杂交育种相结合,一定会大大缩短育种周期,提高育种效率,从而加快牡丹育种进程。
[1]成仿云,李嘉珏,陈德忠,等.中国紫斑牡丹[M].北京:中国林业出版社,2005.44-46.
[2]Cheng F Y, Li J J.Paeonia rockii and its cultivars[J].Amer.Peony Soc.Bull.1994.291: 32-34.
[3]成仿云,李嘉珏,陈德忠.中国野生牡丹自然繁殖特性研究[J].园艺学报,1997,24(2):180-184.
[4]成仿云,杜秀娟.低温及赤霉素处理对凤丹种子萌发和幼苗生长的影响[J].园艺学报,2008,35(4):553-558.
[5]Raghavan V.One hundred years of zygotic embryo culture investigation[J].In Vitro Cell.Dev.Biol.-plant 2003,39:437-442.
[6]刘会超,贾文庆,王 坤.牡丹胚培养及丛生苗继代培养研究[J].北方园艺,2010,(6):172-174.
[7]杨红超,裴冬丽.牡丹种子胚营养研究[J].广西农业科学,2006,37(2):108-110.
[8]范小峰.3 种牡丹的胚培养及植株再生研究[J].林业实用技术,2009,(5):49-51.
[9]高昌永.牡丹胚离体培养的研究[J].安徽农业科学,2009,37(19):8844-8865.
[10]周仁超,姚崇怀.紫斑牡丹胚培养与植株再生(简报)[J].亚热带植物科学.2001,30(3):62.
[11]Wang H, Staden V J.Seedling establishment characteristics of Paeonia ostii var.lishizhenii[J].South African Journal of Botany.2002, 68: 386-389.
[12]曹小勇.濒危植物紫斑牡丹胚离体培养[J].氨基酸和生物资源,2003,25(2):3-35.
[13]Buchheim J A T, Len F B, Meyer M M, et al.Effect of exogenous gibberellic acid, abscisic acid, and benzylaminopurine on epicotyl dormancy of cultured herbaceous peony embryos[J].Plant cell, tissue and organ culture.1994, 36(1): 35-43.
[14]Harris A R, Mantell S H.Effects of stage Ⅱsubculture durations on the multiplication rate and rooting capacity of micropropageted shoots of tree paeony(Paeonia suffruticosa Andr.)[J].Journal of horticultural science.1991, 66(1): 95-102.
[15]曾端香,袁 涛,王莲英,等.两个牡丹杂交系种子胚培养技术研究[J].热带农业科学,2011,31(3):8-12.
[16]曹小勇.紫斑牡丹胚乳营养成分分析[J].植物生理学通讯,2003,39(3):248.
[17]Beruto M, Curir P.In vitro culture of tree peony through axillary budding[J].Protocols for Micropropagation of Woody Trees and Fruits, 2007,(3):447-497.

