关于光化学反应平衡常数的教学讨论
王新平 王旭珍 王新葵 程茜 杜艺 王晓晨
(大连理工大学化工与环境生命学部化学学院 辽宁大连 116024)
化学平衡是化学热力学的核心内容。由于该部分内容的重要性,它被贯穿于高中化学、本科生无机化学和物理化学的教学中。然而,由于现有教科书缺乏关于光化学反应平衡特殊性的总结,并缺失相应的教学内,导致学生在面对光化学反应的化学平衡问题时,往往会得出错误的结果。光化学反应是一类特殊的化学反应,它泛指吸收光能才能实际发生的化学反应[1]。该类反应的平衡与一般化学反应(称为热化学反应)的平衡相比有其独特的规律。笔者认为,将光化学反应平衡的特殊性纳入物理化学的教学内容是必要的。通过学习讨论其特殊性,不仅可使化学反应平衡知识模块完整化,更有利于学生在物理化学学习中形成以吉布斯判据为核心的化学热力学知识框架结构,将其融会贯通。
1 光化学反应平衡常数的推导
在定温、定压下,ΔrGm(T,p)>0的化学反应不能自发进行。但是,当环境对反应系统以合适的方式做非体积功,并达到ΔrGm(T,p) 热和功是系统和环境之间交换的两种能量形式。传热是系统和环境之间在微观粒子水平上无序程度改变的能量转移,而作功则是系统和环境间有序的能量转移。热机不可能从单一热源吸热将其完全转化为功而不引起其他变化。即,热机不能持续不断地从单一热源吸热将其完全转化为功。反之,功则可以持续不断地转化为热(例如电炉)。这就是说,热和功这两种能量形式存在“品位”之分。功这种具有“有序”特征的能量形式是高品位的,而热这种具有“无序”特征的能量形式则是低品位的[2]。能量可以从高品位形式持续不断地转化为低品位形式,反之则不能。 光能是一种具有“有序”特征的能量形式。光能可以连续地转变为电能。例如,人造地球卫星和宇宙飞船可持续地从太阳接受光能并转化为电能。反之,电能也可以持续地通过电灯转变为光能。也有很多实践证明,化学能和电能之间可以完全地相互转化。公式-ΔrGm(T,p)=-W′给出了定温、定压下系统自发的化学反应以可逆的方式进行时,将化学能转变为电能(-W′传给环境)的能量转换关系。公式ΔrGm(T,p)=W′则给出了环境向系统输入电能(W′)时,使非自发的化学反应以可逆的方式进行的能量关系。按照光化学第二定律[2],光能可完全转化为化学能。这些实践结果和认识表明,电能、光能是高品位的能量形式,而系统无论接受电能,还是接受光能,都是接受非体积功。 (1) 对于指定的光化学反应,现假设可被反应吸收的光量子为hν,则在定温定压下,由ΔrGm(T,p)≤W′有: ΔrGm(T,p)≤nhν(<0,不可逆;=0,可逆) 式中n为光子hν的物质的量。上式可变为: ΔrGm(T,p)-nhν≤0(<0,不可逆;=0,可逆) (2) 即: (3) 将式(3)代入式(2),有: 于是,在光照下反应达到平衡时,有: (4) 这就是在定温、定压下,光化学反应的平衡常数与被反应吸收的光量子数之间的关系式。显然,由该关系式可知,光化学反应的平衡常数只在一定光强下为一常数。当光强度改变时,它将随之而变[1]。 因为光化学反应要吸收定量的光量子才能进行,而光子具有物质的属性,因此将被反应消耗的光子视为“反应物”,在理论上也是成立的。极为有趣的是,从这一观点出发,便有: 这就是前面推导得到的式(4)。 通常,把光合作用描述为一种将光能转变为化学能的反应。 在光合反应后,光子这一物质并没有被放出得到复原,而是被反应吸收掉了(即转变成化学能被储存于产物中)。因此,不能把光化学反应理解为“光催化反应”。也就是说,不应将光子视为催化剂,而只能将其归结为反应吸收的高品位的能量[4],即非体积功。根据爱因斯坦狭义相对论(E=mc2),能量也是广义的物质。因此,也可将能量理解为广义上的“反应物”。 在定温、定压下,对于一个非自发反应,当环境向系统输入非体积功W′时,沿式(4)的推导过程,也可得到: (5) 式(5)表述环境向系统输入任何形式非体积功W′的情况下的平衡规律。环境对系统所作非体积功越多,反应的平衡常数就越大。 参 考 文 献 [1] 刘俊吉,周亚平,李松林.物理化学.第5版.北京:高等教育出版社,2009 [2] 胡英,吕瑞东,刘国杰,等.物理化学.北京:高等教育出版社,2007 [3] 傅献彩,沈文霞,姚天扬,等.物理化学.第5版.北京:高等教育出版社,2008 [4] 韩德刚,高执棣,高盘良.物理化学.北京:高等教育出版社,20011.1 光能的属性
1.2 光化学反应的平衡常数




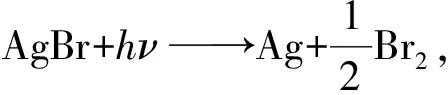
2 依靠非体积功进行的非自发反应
3 结论


