采油微生物发酵液中各组分对原油量测定的影响
王 佳 新, 张 丽 敏, 曹 方, 王 培 忠, 孙 玉 梅
( 大连工业大学 生物工程学院, 辽宁 大连 116034 )
0 引 言
随着世界经济的高速发展,对石油及石油产品的需求日益增加,原油开采已成为世界各国的重要研究课题。原油主要由烷烃、芳烃、非烃、沥青质四种族分组成,原油在紫外区的吸收主要由芳烃族分引起[1],芳烃在255 nm具有特征吸收峰[2-3],故可用芳香烃量间接表征原油量[4]。在微生物采油过程中,原油中的芳香烃可能被一定程度分解[5-6],原油的芳香烃含量也可反映原油组分的变化。因此可通过原油中芳香烃的测量计算微生物采油的采收率以及探究原油组分变化。
目前芳烃含量的测定方法主要是气相色谱法[7]、液相色谱法、紫外分光光度法[8]等。尽管气相色谱法和液相色谱法可以很好地分离原油组分并精确测定各组分含量,但是这两种方法对仪器、试剂、样品及操作要求均较高,且成本较高[9]。与这两种方法相比,紫外分光光度法具有快速、简单、准确、重复性好等优点[10],因此本文采用紫外分光光度法测定原油中芳烃含量,以表征原油采出量,并研究微生物采油发酵液成分对此方法测定结果的影响。
1 实 验
1.1 仪器与试剂
仪器:752 N 紫外可见分光光度计,上海精密科学仪器有限公司;CR21G 冷冻高速离心机,日本日立;JY 99-2D 超声波细胞粉碎机,宁波新芝科器研究所;PH-3C 精密pH计,上海雷磁仪器厂;HG303-4K 电热恒温培养箱,南京电器三厂制造。
试剂:环己烷,分析纯,北京化工厂;葡萄糖,分析纯,沈阳市新西试剂厂;硝酸钠,分析纯,华北地区特种化学试剂开发中心;磷酸二氢钾,分析纯,成都化学试剂厂;磷酸氢二钠,分析纯,天津市天河化学试剂厂。
1.2 材 料
1.2.1 原 油
实验所用的原油取自辽河油田。
1.2.2 菌 种
节杆菌属ZY-1,微球属ZY-2,芽孢杆菌属ZY-3、ZY-10、ZY-11、JY-6、JY-11以及JY-5均为本实验室从辽河油田原油中筛选的耐高温菌株。
1.2.3 培养基
原油复壮培养基(g/L):NaCl 3,NH4Cl 0.1,MgSO40.02,NaNO30.2,KH2PO40.1,K2HPO40.2,原油 10,蛋白胨 20,Tween 80 1,琼脂 20。
斜面种子培养基(g/L):NaCl 5,牛肉膏 5,蛋白胨 10,琼脂 20,pH 7.0[6]。不加琼脂为液体种子培养基。
液状石蜡发酵培养基(g/L):KH2PO43.4,NaH2PO41.5,NaNO34,MgSO4·7H2O 0.7,酵母粉 0.2,液蜡 17,pH 7.0[6]。
以上培养基均于121 ℃湿热灭菌20 min。
1.3 实验方法
1.3.1 细胞内含物提取
菌种保存及活化:将实验菌株于4 ℃冰箱保存,取保存菌株接于斜面种子培养基,于60 ℃活化培养24 h。
种子液制备:将2环斜面活化的菌体接入液体种子培养基中(100 mL三角瓶装液量为50 mL),于60 ℃静置培养24 h。
发酵液制备:在发酵培养基中(250 mL三角瓶装液量为100 mL)接种体积分数为5%种子培养液,于60 ℃静置培养。
超声破壁:
(1)分别取发酵液20 mL,移除发酵液上层油相,于4 ℃、10 000 r/min离心10 min,收集菌体沉淀,加20 mL去离子水,振荡制成菌悬液,在600 nm处测吸光值OD600。
(2)将菌悬液在冰浴中进行超声破碎,超声条件为400 W、超声10 s、间歇10 s、总工作时间10 min。
(3)将超声后的菌悬液于4 ℃、10 000 r/min离心20 min,取上清液。
1.3.2 原油标准曲线绘制
(1) 标准油储备液:准确称取0.025 g原油,溶于环己烷,配制成每毫升含1 mg原油的混合液,贮于4 ℃冰箱待用。
(2) 用上述标准油储备液分别配制质量浓度为5、10、20、30、40 mg/L的标准油使用液。以环己烷为空白,在255 nm测定吸光值OD255,绘制标准曲线[7]。
1.3.3 原油量的测定
影响原油量测定的成分选择:①葡萄糖溶液(3、0.3、0.03 g/L);硝酸钠溶液(4、0.4、0.04 g/L);磷酸二氢钾-磷酸氢二钠溶液(5、0.5、0.05 g/L),以及相应浓度水平的3种成分的混合液。②pH 5,pH 3和pH 1的盐酸溶液。③细胞内含物提取上清液。
在标准曲线的线性区域选取一浓度,配制石油-环己烷溶液(即标准油使用液),分别与上述①,②,③溶液等体积充分混合,静置分层1 h,以上层有机相为被测液,在255 nm测量吸光值OD255。以石油-环己烷溶液为空白,石油-环己烷溶液和水的混合液为对照。
2 结果与讨论
2.1 原油标准曲线的绘制
由图1可知,5~40 mg/L的石油-环己烷溶液在255 nm的吸光度呈良好的线性,R2=0.998 42。取质量浓度为15 mg/L的石油-环己烷溶液进行研究。
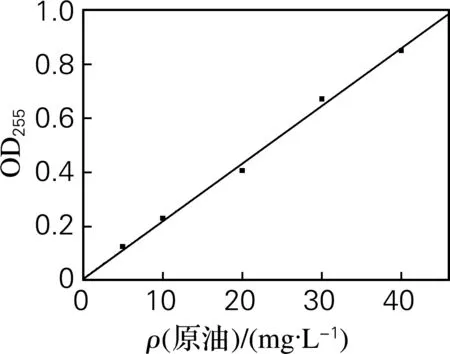
图1 原油标准曲线
2.2 发酵培养基对原油量测定的影响
如图2所示,以发酵培养基中每一组分(葡萄糖、硝酸钠、磷酸二氢钾-磷酸氢二钠)及其混合的全组分作为影响因素,测定原油量的结果基本一致,说明培养基组分对原油量测定的影响差异很小。
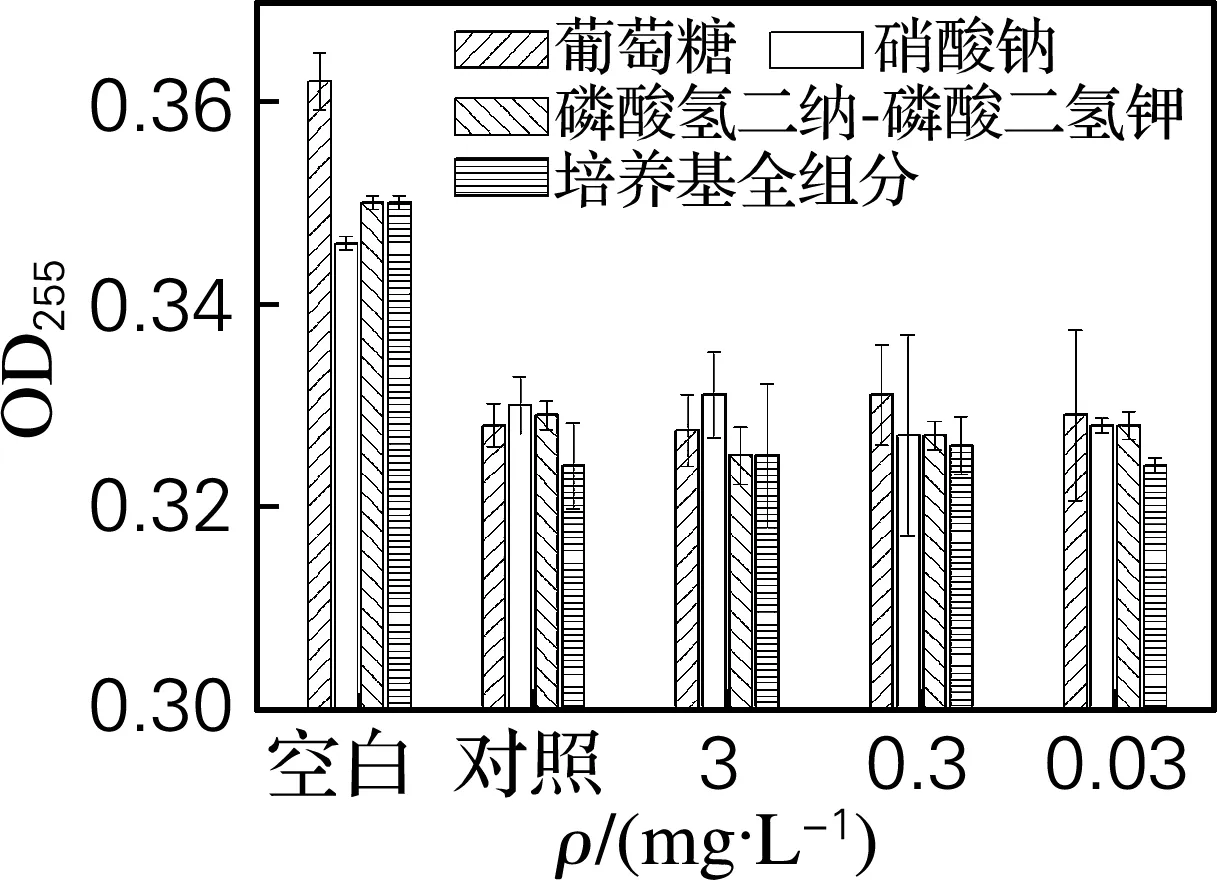
图2 发酵培养基的不同组分及质量浓度条件下测定的原油量
Fig.2 Determination of crude oil in the presence of different components and different concentration of components in fermentation medium
不同质量浓度发酵培养基组分的原油量测定结果基本一致,说明培养基组分及质量浓度对原油量测定的影响差异很小,即在微生物采油过程中原油量的测定不受发酵培养基组分浓度变化的影响。
以上测定条件的测定结果与对照的原油量测定结果基本一致,但是与空白的原油量测定结果差异较大,因对照为石油-环己烷溶液和水的混合液,空白为石油-环己烷溶液,前者只比后者多了水组分,所以作者认为水是引起测定结果有差异的主要原因。
2.3 pH 对原油量测定的影响
如图 3 所示,pH对原油量的测定基本没有影响,即在微生物采油过程中原油量的测定不受pH变化的影响,与“2.2”所述同理,水是造成这些结果与空白有差异的主要原因。
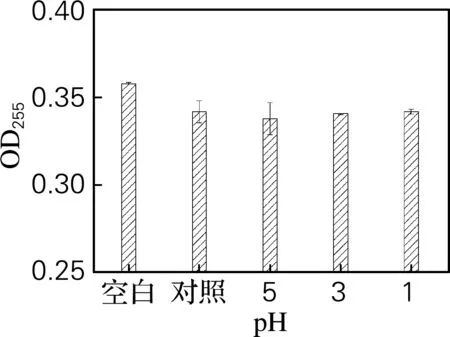
图3 不同pH条件下测定的原油量
2.4 水影响原油量测定的原因分析
由“2.2”和“2.3”的分析结果可知,水是造成各因素对原油量测定结果与空白有差异的主要原因。为了进一步分析水影响待测液原油量测定的原因,采用静止分离和离心分离待测液,并对两种方法的测定结果进行比较,结果见图 4。由图4可知,静止时间对原油量测定的结果有明显的影响。静止分离0~1 h,水对原油量测定的影响较大,随着静止分离时间的延长,试样与空白的原油量测定结果有接近趋势;当静止分离不少于1 h时,二者的测定结果基本一致。说明静止分离时间越长,分离效果越好,水对原油量的测定影响越小。静止分离1 h即可获得较好的分离效果,样品与空白的原油量测定结果基本一致。采用离心分离,试样与空白的原油量测定结果差异很小。
综上分析,试样的充分分离可消除水对原油量测定的影响。与静止分离相比,离心分离具有稳定、快速、分离效果好等优点,但实验操作较繁琐、设备要求较高,因此,采用静止分离1 h较经济适用。
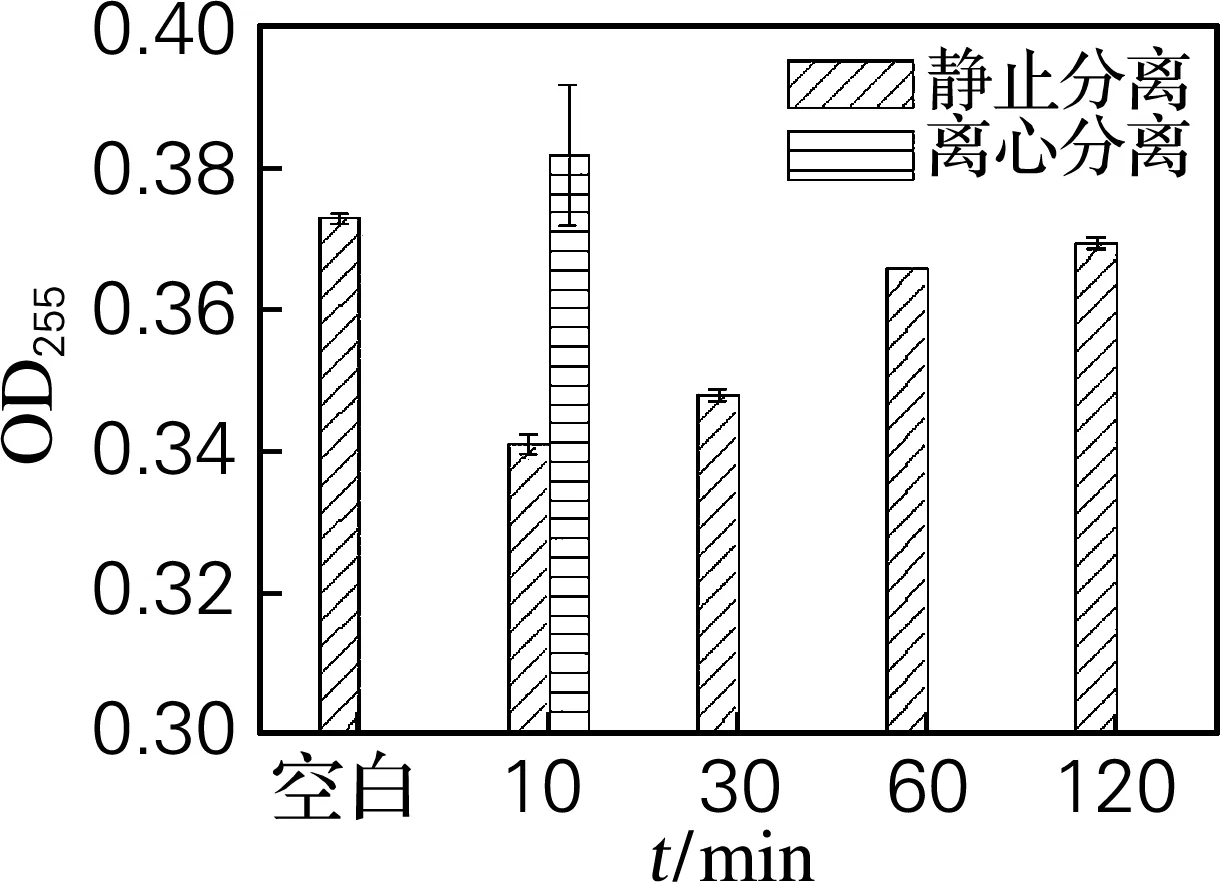
图4 不同的样品分离方法测定的原油量
Fig.4 Determination of crude oil by different separation methods of sample
2.5 发酵液中采油微生物细胞内含物对原油量测定的影响
2.5.1 实验菌株的生长测定
将实验菌株在发酵培养基中静置培养,不同培养阶段的菌体生长状态测定结果见图 5。
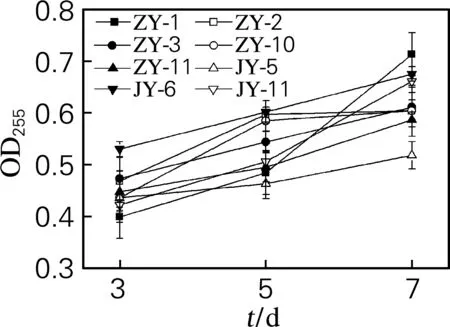
图5 实验菌株的生长状态
由图5可知,各实验菌株培养3~7 d的菌体密度均有明显上升,表明各菌株生长良好。
2.5.2 不同培养时间细胞内含物对原油量测定的影响
在微生物采油过程中,采油微生物会发生自溶,细胞内含物会进入发酵液中,而细胞内含物种类较多、结构复杂,为了研究细胞内含物对原油量测定的影响,测定不同生长状态的细胞内含物存在时的试样原油量,结果见图6。
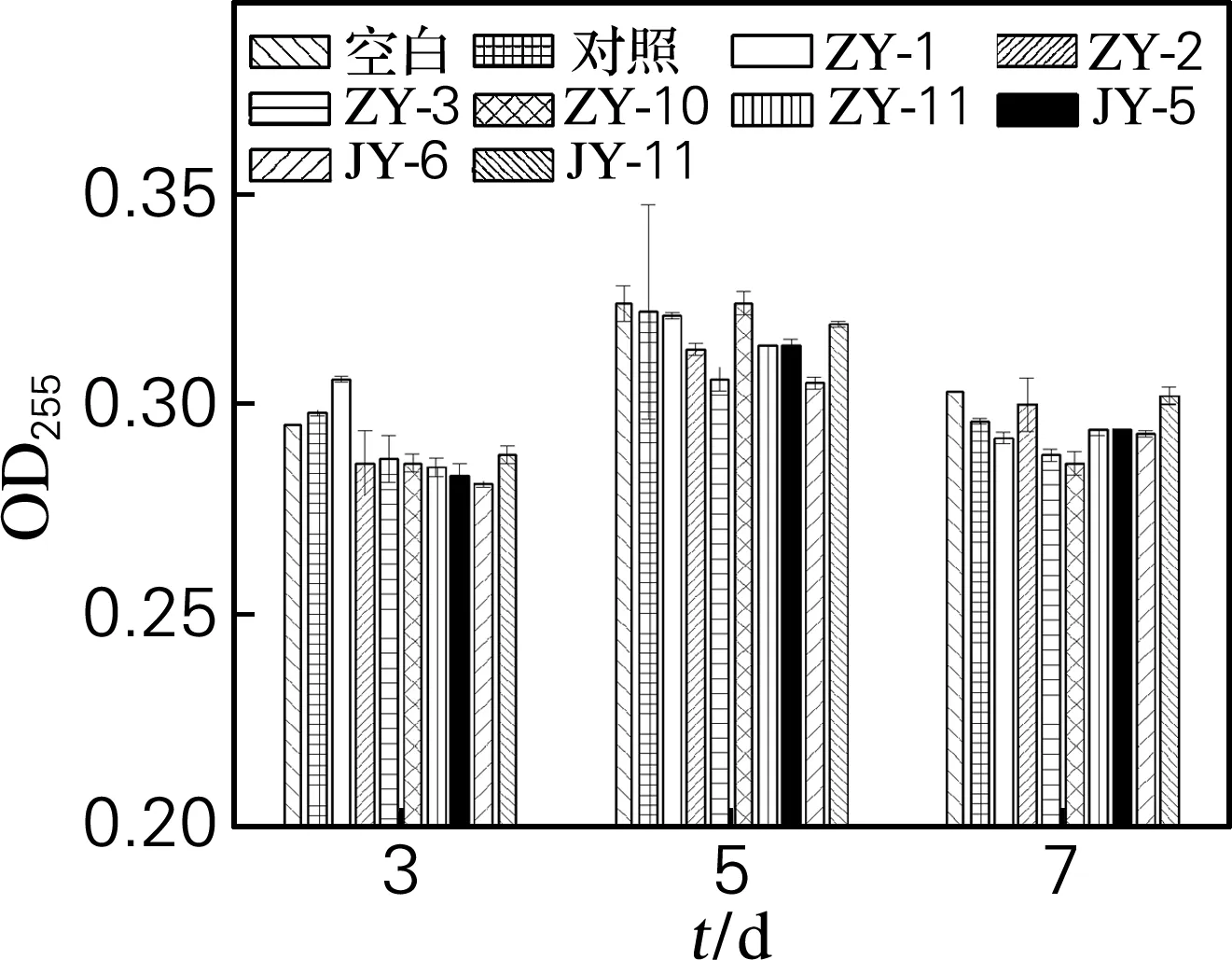
图6 不同生长状态的细胞内含物存在时测定的原油量
Fig.6 Determination of crude oil in the presence of cellular contents at different growth state
由图6可知,有不同生长状态的细胞内含物参与的试样与对照的原油测定量差异很小,因此,可以忽略细胞内含物对原油量测定的影响。
3 结 论
(1)采用紫外分光光度法测定原油量,操作简单、快速准确、稳定可行。适用范围至少可以在5~40 mg/L,此范围之外有待进一步研究。
(2)培养基各组分、pH以及实验菌株细胞内含物对此方法测定原油量影响较小,水是影响测定的主要原因。
(3)采用1 h以上的静止分离和离心分离均能使被测样品达到较好的分离效果,可使样品中水分得以彻底分离,消除水对此方法测定原油量的影响。
[1] 张子间,刘勇弟,孟庆梅,等. 微生物降解石油烃污染物的研究进展[J]. 化工环保, 2009, 29(3):193-198.
[2] 徐耀辉,陈丹,向廷生,等. 紫外光谱技术在油藏地球化学研究中的应用[J]. 天然气地球科学, 2007, 18(2):266-268.
[3] 董发昕,贾婴奇,袁红安,等. 紫外、荧光分光光度法测定化探样中痕量芳香烃[J]. 西北大学学报:自然科学版, 2006, 36(2):243-246.
[4] GIGER W, BLUMER M. Polycyclic aromativ hydrocarbons in the environment isolation and characterization by chromatography, visible, ultraviolet, and mass spectrometry[J]. Analytical Chemistry, 1974, 46(12):1663-1671.
[5] ANNWEILER E, RICHNOW H H, ANTRANIKIAN G, et al. Naphthalene degradation and incorporation of naphthalene-derived carbon ento biomass by the thermophile bacillus thermoleovorans[J]. Applied and Environmental Microbiology, 2000, 66(2):518-523.
[6] 刘蕊娜,黑花丽,向廷生. 原油经微生物降解后组分变化研究[J]. 长江大学学报:自然科学版, 2009, 6(2):42-45.
[7] 关亚风,赵景红,刘文民,等. 油品族组成的详细分析和燃油中芳烃的分析[J]. 色谱, 2004, 22(5):509-514.
[8] 崔树宝. 紫外分光光度法测定石油产品中的芳烃含量[J]. 天津化工, 2006, 20(6):51-52.
[9] 成前辉,杨麟科. 气相色谱法测定原油中的饱和烷烃组分[J]. 仪器分析, 2002(4):26-28.
[10] 郭春燕,马俊贺,佟钰. 紫外分光光度法测定液体石蜡中的芳烃[J]. 辽宁化工, 2003, 32(6):272-274.
[11] 侯百友,孙玉梅,杨冠科,等. 烃降解菌HB29产糖脂发酵条件的研究[J]. 中国酿造, 2009(2):83-85.
[12] 水利部. 油的测定(紫外分光光度法).SL 93.2-1994[S].1995.

