截短侧耳素类抗生素的研究进展
汤有志,远立国,刘雅红
(1.华南农业大学兽医学院 广东省兽药研制与安全评价重点实验室,广东 广州510642;2.华南农业大学兽医学院,广东 广州510642)
截短侧耳素(pleuromutilin,化合物1)是由担子菌产生的一种三环二萜类兽用抗生素,对革兰阳性菌和支原体有强抗菌活性[1]。自1950年发现以来,以截短侧耳素为先导化合物,已成功开发出泰妙菌素(tiamulin,化合物2)和沃尼妙林(valnemulin,化合物3)[2]两种动物专用半合成截短侧耳素类抗生素。有鉴于此,本文就截短侧耳素及其衍生物的研究进展做一简要综述,以期为新的动物专用半合成截短侧耳素类抗生素的研发提供参考。
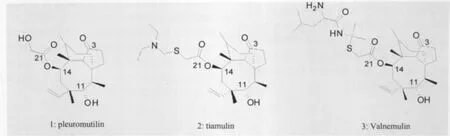
图1 截短侧耳素、泰妙菌素及沃尼妙林的结构式
1 截短侧耳素及其衍生物的抗菌机制
1974年,Hogenauer等即对截短侧耳素及其衍生物的抗菌机制进行过研究,结果表明,截短侧耳素类化合物能与细菌的原核核糖体结合,进而选择性抑制细菌的蛋白质合成[3]。后期Schluenzen等[4]的研究表明,截短侧耳素类化合物的三环骨架是该类化合物发挥抑菌作用的关键因素。
2007年,Davidovich等[5]发现,不仅截短侧耳素分子中的C21位羰基能与核糖体上G2061相互作用,而且分子中的C14侧链还能伸入核糖体中的疏水部分。在此基础上,他们提出截短侧耳素类化合物与细菌核糖体50s亚基之间的诱导契合作用,能使50s亚基发生重排,进而封闭截短侧耳素类化合物伸入核糖体内疏水部分的C14侧链,增强该类化合物与50s亚基的结合[5]。后续的研究表明,分子中的C14侧链也能影响截短侧耳素类化合物的抗菌活性[6]。
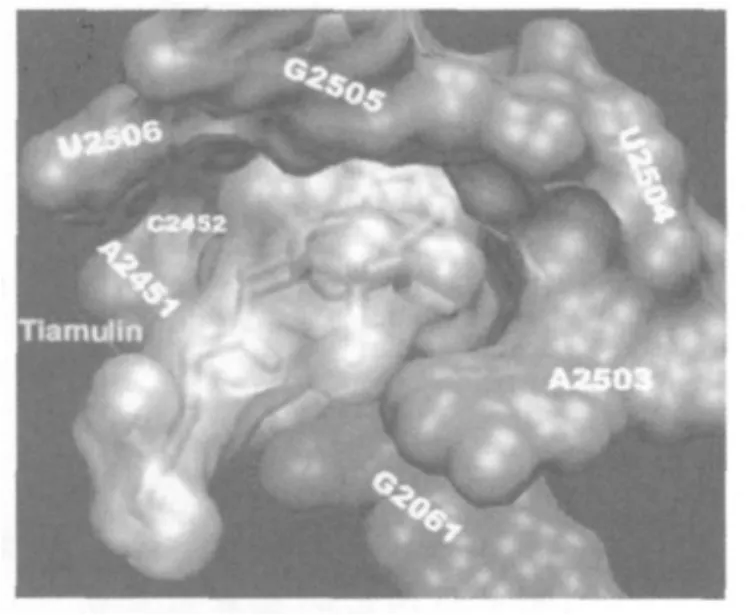
图2 泰妙菌素与核糖体50s亚基形成复合物晶体结构示意图[4]
这一现象的发现,对于新型抗菌药物的研发显得尤为重要。有研究表明,通过改变截短侧耳素类化合物C14侧链基团,增强其与肽转移酶的相互作用,有望得到具有优异抗菌活性的化合物[7]。随着对截短侧耳素类化合物抗菌机制的深入研究,结合现有该类化合物的研究数据及现代药物设计技术,相信在不久的将来,更多的截短侧耳素类动物专用抗生素会陆续出现。而对现有抗生素抗菌机制的深入研究,以及计算机模拟现代药物分子设计等技术在兽药研发中的应用,也会为动物专用抗生素的研发工作提供新的思路与方法。
2 截短侧耳素及其衍生物的构效关系
尽管截短侧耳素类化合物具有良好的抗菌活性,但该类化合物水溶性差、半衰期短等问题长期制约着该类药物在临床上的开发利用,因而药物研发人员一直尝试根据其代谢特性、针对其代谢位点,对该类化合物母核进行修饰,以期能得到水溶性增强、代谢稳定且具有优异抗菌活性的截短侧耳素类衍生物。迄今为止对于截短侧耳素类化合物的结构修饰位点包括C3位羰基、C11位羟基、C12位乙烯基、三环母核、C2位、C6位、C8位及C14位侧链。
1976年,Sandoz研究所的Egger等人对截短侧耳素衍生物进行过初步的构效关系研究[8],发现截短侧耳素三环母核中五元环上C3位羰基及八元环上C11位羟基为该类化合物抗菌活性的必需基团,而C14侧链的改变则能很好的改善该类化合物的抗菌活性及溶解性。Springer等人则发现,将截短侧耳素三环母核中的五元环进行适当结构修饰后能得到活性较好的化合物(如化合物5);而将母核中的八元环改造为七元环后,则会使所得的绝大多数化合物抗菌活性显著下降,仅少数化合物(如化合物6)具有较好抗菌活性[9]。
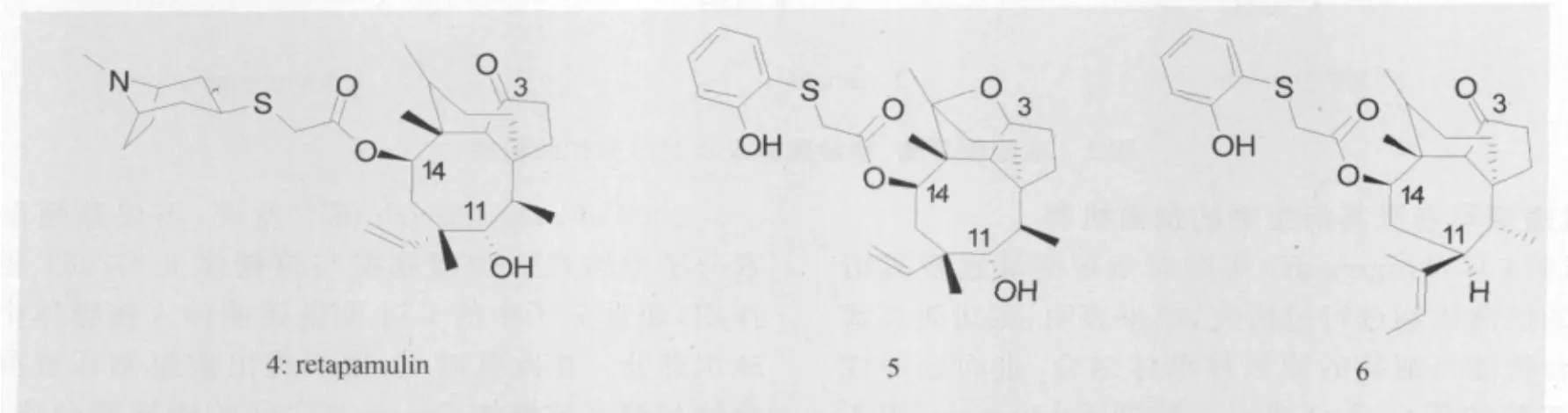
图3 retapamulin及两种截短侧耳素衍生物的结构式
对截短侧耳素类化合物进行的最多,也最为成功的当属对其三环母核上C14位酯基侧链的结构修饰。目前为止,成功上市的3种截短侧耳素类抗生素均为改造截短侧耳素C14酯基侧链而得到。
3 已上市的截短侧耳素类衍生物
3.1 泰妙菌素 泰妙菌素是第一个上市的截短侧耳素类抗生素[10],该化合物的水溶性和抑菌活性均有较大提高,具有毒性小、蓄积性弱、耐受性好等优点,是目前市场上常用的兽用抗菌药之一,对猪、禽类的支原体病、猪痢疾、鸡的葡萄球菌滑膜炎有良好疗效。Hampson等人[11]发现,泰妙菌素以25mg/kg体重的剂量连续给药5d以上,对种鸡和蛋鸡的家禽肠道螺旋体病有很好的疗效。Burch等人[12]的研究则表明泰妙菌素仅需以12.5mg/kg体重的剂量连续给药3d,即能改善多毛结肠螺旋体感染蛋鸡的临床症状。尽管上述研究结果在数据上略有出入,但无一例外证实了泰妙菌素对禽支原体病的良好疗效。
3.2 沃尼妙林 沃尼妙林是动物专用第二代截短侧耳素类抗生素,由Sandoz研究所在1984年以截短侧耳素为原料合成得到。沃尼妙林抗菌谱较广,对多种霉形体、细菌及螺旋体均有良好的抗菌活性。1999年,盐酸沃尼妙林被欧盟批准作为兽用处方药,用于预防与治疗由猪痢疾短螺旋体(Brachyspirahyodysenteriae)感染引起的猪痢疾及由肺炎支原体(Mycoplasmapneumoniae)感染引起的猪地方性肺炎,它也是欧盟批准的第一个兽用预混料[13]。2004年1月,沃尼妙林获欧盟批准用于预防由结肠菌毛样短螺旋体(Brachyspirapilosicoli)感染引起的猪结肠螺旋体病及治疗由胞内劳森菌(Lawsonia intracellularis)感染引起的猪增生性肠炎。
3.3 Retapamulin Retapamulin是第一个人用截短侧耳素类抗生素[13],由英国葛兰素史克(Glaxo Smith Kline)公司开发,2007年4月通过美国FDA审批,用于脓疱症的局部治疗及皮肤感染后的外伤性病变继发感染。Jones等[14]的研究表明,Retapamulin对目前临床常用抗生素如苯唑西林、红霉素、莫匹罗星等在内的多种耐药菌均具有良好的抗菌活性,此外,他们还发现Retapamulin与传统的抗菌药相比,更不易引起金黄色葡萄球菌的耐药性。Gentry等[15]在此后的研究中发现,金黄色葡萄球菌必须连续发生三步基因突变才能对Retapamulin产生明显的耐药性。该研究结果进一步证实了Jones关于Retapamulin不易引起金葡菌耐药的结论。
以上研究结果表明,截短侧耳素类抗生素所独有的抗菌机制,能使其区别于其他细菌蛋白质合成抑制剂,也能使其对目前出现的耐药菌产生良好的抑菌活性。因而,基于截短侧耳素进行新型抗菌剂的设计与研发,可为日益严重的细菌耐药性问题提供一种解决方案。

图4 研发中的截短侧耳素衍生物
4 展望
在细菌耐药性日益严重的今天,寻找具有良好抑菌活性、独特抗菌机制、不易与其他药物产生交叉耐药性、具有新结构的化合物显得尤为重要。Retapamulin的成功上市重新引起了药物研发人员对截短侧耳素类抗生素的关注。该类化合物抗菌机制的深入研究对于该类化合物的开发起着重要的指导作用。基于该类化合物的抗菌机制,以截短侧耳素为先导化合物,设计合成水溶性好、生物利用度高、抗菌活性优异的目标化合物无疑是该类抗菌药物研发的重点与难点。Nabriva therapeutics在截短侧耳素类抗生素方面的研发工作进行的较为成功,该公司开发的BC-3205与BC-7013已进入一期临床,此外该公司合成的化合物 BC-3004、BC-3080及BC-3291均具有较好的抗菌活性[6]。随着对截短侧耳素类化合物研究的不断深入,更多活性强、生物利用度高的化合物会不断出现。
[1] Kavanagh F,Hervey A,Robbins W J.Antibiotic substances from Basidiomycetes.8.Pleurotus-Multilus(Fr.)Sacc.and Pleurotus-Passeckerianus Pilat[J].Proc Natl Acad Sci USA,1951,37(9):570-574.
[2] Hannan P C T,Windsor H M,Ripley P H.In vitro susceptibilities of recent field isolates of Mycoplasma hyopneumoniae and Mycoplasma hyosynoviae to valnemulin(Econor),tiamu-lin and enrofloxacin and the in vitro development of resistance to certain antimicrobial agents in Mycoplasma hyopneumoniae[J].Res Vet Sci,1997,63(2):157-160.
[3] Hodgin L A,Hogenauer G.The mode of action of pleuromutilin derivatives.Effect on cell-free polypeptide synthesis[J].Eur J Biochem,1974,47(3):527-533.
[4] Schluenzen F,Pyetan E,Fucini P,etal.Inhibition of peptide bond formation by pleuromutilins:The structure of the 50Sribosomal subunit from Deinococcus radiodurans in complex with tiamulin[J].Mol Microbiol,2004,54(5):1287-1294.
[5] Davidovich C,Bashan A,Auerbach-Nevo T,etal.Induced-fit tightens pleuromutilins binding to ribosomes and remote interactions enable their selectivity[J].Proc Natl Acad Sci USA,2007,104(11):4291-4296.
[6] Rodger N,M S D.The pleuromutilin antibiotics:a new class for human use[J].Curr Opin Investig Drugs,2010,11(2):182-191.
[7] Long K S,Hansen L H,Jakobsen L,etal.Interaction of pleuromutilin derivatives with the ribosomal peptidyl transferase center[J].Antimicrob Agents Ch,2006,50(4):1458-1462.
[8] Egger H,Reinshagen H.New Pleuromutilin Derivatives With Enhanced Antimicrobial Activity 2.Structure-Activity Correlations[J].J Antibiot,1976,29(9):923-927.
[9] Springer D M,Goodrich J T,Luh B,etal.Antibacterial pleuromutilin derivatives based on alternate core structures:Arigoni and Birch chemistry revisited[J].Lett Drug Des Discovery,2008,5(5):327-331.
[10]Hunt E.Pleuromutilin antibiotics[J].Drugs Future,2000,25(11):1163-1168.
[11]Hampson D J,Oxberry S L,Stephens C P.Influence of infeed zinc bacitracin and tiamulin treatment on experimental avian intestinal spirochaetosis caused by Brachyspira intermedia[J].Avian Pathol,2002,31(3):285-291.
[12]Burch D,Harding C,Alvarez R,etal.Treatment of a field case of avian intestinal spirochaetosis caused by Brachyspira pilosicoli with tiamulin[J].Avian Pathol,2006,35(3):211-216.
[13]Hu C,Zou Y.Mutilins derivatives:from veterinary to humanused antibiotics[J].Mini-Rev Med Chem,2009,9(12):1397-1406.
[14]Jones R N,Fritsche T R,Sader H S,etal.Activity of retapamulin(SB-275833),a novel pleuromutilin,against selected resistant gram-positive cocci[J].Antimicrob Agents Ch,2006,50(7):2583-2586.
[15]Gentry D R,Rittenhouse S F,Mccloskey L,etal.Stepwise exposure of Staphylococcus aureus to pleuromutilins is associated with stepwise acquisition of mutations in rplC and minimally affects susceptibility to retapamulin[J].Antimicrob Agents Ch,2007,51(6):2048-2052.

