不同水平母源硒对黎城大青羊后代公羔睾丸组织抗氧化能力的影响
石 磊任有蛇 张春香朱晓敏施力光岳文斌 雷福林
(1.山西农业大学动物科技学院,山西太谷 030801;2.山西省黎城种羊场,山西黎城 047600)
母畜的妊娠期和哺乳期对后代的发育至关重要,在母畜的妊娠期,母体中的营养物质主要通过胎盘转移给后代,而到了哺乳期,乳汁又成为转移营养物质的主要载体。动物生殖器官的原始胚基在胚胎的发育早期就已经具备,随着胚胎的发育性腺逐渐完成分化。就雄性动物而言,生殖机能的发育主要经历出生前、出生后的发育,初情期和性成熟等几个阶段,雄性动物生殖器官在性成熟时基本发育完全。
硒元素是生物机体必需的微量元素之一,硒在生物体内最主要的功能就是其抗氧化作用。硒的摄入量不足时,导致抗氧化能力降低,活性自由基过度产生,细胞中过氧化产物堆积,可导致细胞功能下降。硒营养充分时可以增强机体抗氧化能力,从而抑制过氧化产物和自由基对细胞成分的氧化作用,保持细胞的完整性和正常功能[1-2]。在动物机体中,自由基的过度产生主要通过抗氧化和自由基防御系统来清除,酶组成的系统就是其主要的防御体系之一,其中包括GSHPx、SOD、CAT等。目前,研究者大多通过日粮中直接添加硒元素研究不同硒源对动物机体抗氧化能力的影响[3-5],然而在妊娠期和哺乳期母畜日粮中添加硒元素,来研究母源硒对后代公羔睾丸组织抗氧化酶活性影响报道却很少。
本试验以黎城大青羊妊娠母羊为研究对象,通过在妊娠母羊日粮中添加不同水平的酵母硒,来研究日粮中的酵母硒对妊娠期母羊外周血液中的主要抗氧化酶活性的影响,以探讨妊娠母羊血液中抗氧化酶活性和硒含量的变化规律,为从母源硒角度进一步提高后代羔羊的繁殖性能提供试验依据。
1 材料与方法
1.1 试验基础日粮
由于母羊在整个妊娠期的不同时间段所需的能量水平不同,故基础妊娠日粮分为妊娠早期与妊娠后期日粮。试验母羊从开始妊娠到妊娠期的第60 d饲喂妊娠早期日粮,从妊娠期的第60 d开始至产羔饲喂妊娠后期日粮,从羔羊出生到四月龄饲喂哺乳期日粮。日粮是以粉碎的玉米秸秆和苜蓿干草为主的粗饲料,玉米和豆饼等为主的精料,参照美国NRC(2007)妊娠期肉用山羊的饲养标准配合而成(见表1)。
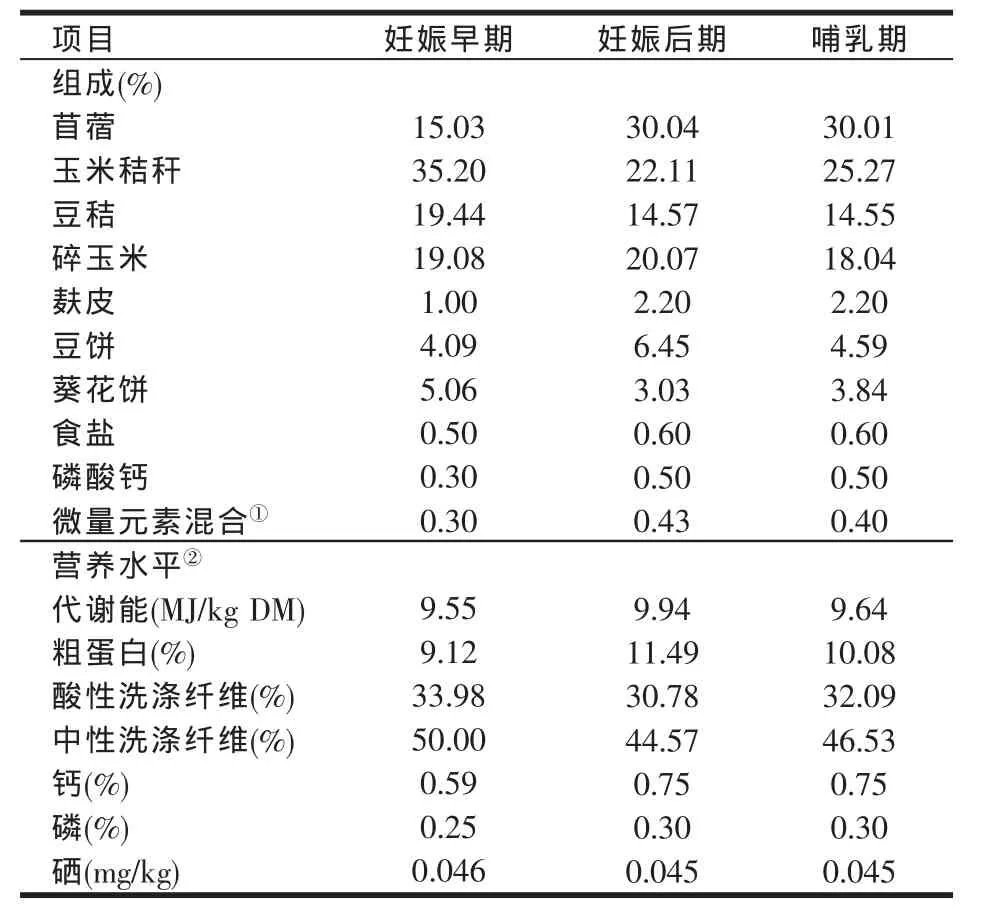
表1 母羊日粮组成及营养水平(干物质基础)
1.2 试验动物
本试验在山西省黎城种羊场进行。先预选体重相近,体况良好和胎次相近的黎城大青羊经产母羊160只,采用人工授精的方式进行配种,选择不再表现发情征兆的母羊作为正式试验羊只,按照平均体重相近的原则随机分为4组。本试验的研究对象为试验母羊所产的单胎公羔,羔羊的分组以试验母羊的分组为依据,分别为对照组 (n=13)、0.5 mg/kg(n=11)、2.0 mg/kg(n=17)和 4.0 mg/kg 组 (n=10)。
1.3 饲养管理
本试验的试验期共290 d,所有试验羊只在试验前进行驱虫,圈舍进行消毒。在预饲20 d后进入正式试验期,正式试验为期270 d,包括妊娠期和哺乳期两个阶段,从母羊产羔后开始饲喂哺乳期日粮,直到羔羊断奶。试验羊每日每只定量供给试验日粮,分别在早06:00和晚18:00分两次进行等量饲喂,先喂粗饲料,再喂精料,自由饮水。母羊产羔前对圈舍进行消毒,保持通风,并注意产圈的防寒保暖。母羊产羔后立即给羔羊逐只打耳号、标记和分组,并保证每只羔羊及时吃到初乳,羔羊在两周后训练采食。
1.4 样品采集与测定
羔羊初生后12 h内采集初乳,分别在羔羊1月龄以前,每隔10 d分别采集母羊的乳汁和血液,睾丸样品在同一天进行采集,采样时,首先用剪刀剪去阴囊皮肤上的羊毛,碘酒消毒后用手术刀割开阴囊皮肤,迅速摘取两侧睾丸,然后进行睾丸样品的采集。采集的样品均放置于冰箱中冷冻保存。
硒含量的测定采用简化的酸消化法进行处理,用移液管准确移取1 ml抗凝血于三角瓶中,加入5 ml浓硝酸,盖小漏斗冷消化过夜,次日加入1 ml双氧水,置于电热板上90℃加热1 h,再调至130℃加热至溶液变为清亮无色,冷却后移至50 ml容量瓶中,定容至刻度后用原子荧光光度计(AFS-230E)进行检测。
1.5 统计分析
用SPSS 13.0统计软件对所测定的数据进行方差分析,然后通过Duncan's法进行多重比较。
2 结果与分析
2.1 硒元素从母体到后代的转移(见表2)
由表2可知,母羊初乳和常乳及血液的硒含量随着母羊日粮硒含量的增加而逐渐增加,且各组之间差异极显著(P<0.01)。在各处理组中,母羊血液中的硒含量极显著高于其常乳中的硒含量(P<0.01);在对照组中,母羊血液中的硒含量显著高于羔羊血液的硒含量(P<0.05),但与初乳中的硒含量差异不显著(P>0.05),在各硒处理组中,母羊血液的硒含量显著高于其初乳中的硒含量(P<0.05),极显著高于羔羊血液中的硒含量(P<0.01)。
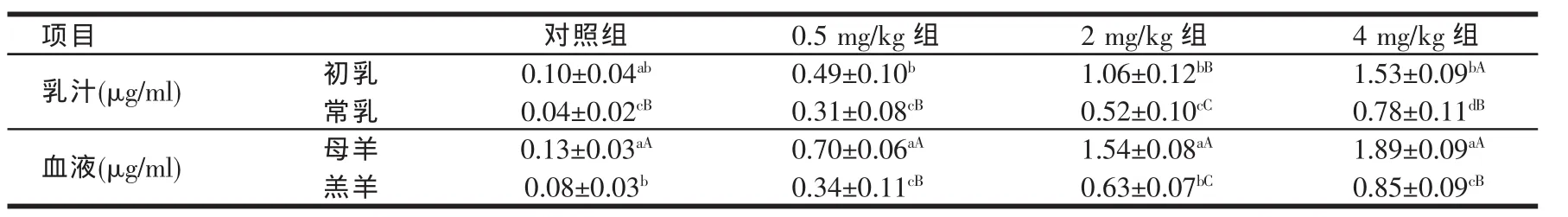
表2 初乳、常乳和血液中的硒含量
2.2 不同母源硒水平对后代睾丸抗氧化能力和硒含量的影响(见表3)

表3 各处理组羔羊睾丸的抗氧化酶活性及硒含量
表3可见,对照组羔羊睾丸组织中的GSH-Px活性均极显著低于各硒处理组(P<0.01),0.5 mg/kg、2 mg/kg和4 mg/kg组睾丸组织中的GSH-Px活性分别是对照组的1.57、2.06和2.09倍;在硒各处理组中,随着母羊日粮中硒含量的增加,羔羊睾丸组织中的GSH-Px活性也在逐渐升高;0.5 mg/kg组的GSH-Px活性极显著低于2 mg/kg和4 mg/kg组(P<0.01),分别是0.5 mg/kg组的1.31和1.34倍,而这两组之间差异不显著(P>0.05)。对照组睾丸组织的SOD活性均极显著低于各硒处理组(P<0.01),0.5 mg/kg组显著高于2 mg/kg和 4 mg/kg组(P<0.05),而这两个组之间差异不显著(P>0.05)。
对照组羔羊睾丸组织中的MDA含量最高,极显著高于0.5 mg/kg和2 mg/kg组(P<0.01),显著高于4 mg/kg组(P<0.05);三个硒处理组中,随着母羊日粮中硒含量的增加,羔羊睾丸中的MDA含量也在逐渐增加,4 mg/kg组睾丸组织中的MDA含量极显著高于0.5 mg/kg 组(P<0.01),显著高于 2 mg/kg 组(P<0.05)。各处理组羔羊中的硒含量随着母羊日粮硒含量的增加而逐渐升高,且各处理组之间差异显著(P<0.05)。
3 讨论
3.1 关于母体与胚胎之间硒的转移
母体中的营养物质包括微量元素主要通过胎盘和母乳传递给后代,动物血液、组织和乳汁中的硒含量会受到日粮中硒含量的影响,研究发现妊娠母牛血液中的硒含量与其所产小牛的硒含量存在正相关[6-8];妊娠母羊日粮中添加硒,能提高其初乳中的硒含量,在添加后一月,其乳汁中的硒含量也比较高[9]。本试验也得到类似的结果,随着母羊日粮硒含量的增加,其初乳与乳汁中的硒含量也显著升高,哺乳期母羊血液中的硒含量也呈现出逐渐增加的变化规律,所生羔羊血液中的硒含量与母羊血液中的硒含量变化规律相同。可以肯定新生后代机体中的硒元素与母体的硒状况有着十分密切的关系,母体的硒元素也可以通过乳汁的传递影响到后代机体组织的硒含量。
3.2 硒与睾丸抗氧化能力
机体组织中抗氧化酶的作用主要是清除体内的活性氧自由基,也就是说,正常情况下,自由基为抗氧化系统所中和,一旦自由基的生成超过抗氧化系统的中和能力,脂质过氧化反应就会伤害到细胞膜的不饱和脂肪酸、蛋白质的氨基酸和脱氧核糖核酸中的核苷酸,造成细胞完整性被破坏,MDA就是机体发生脂质过氧化反应的终产物之一,因此对抗氧化酶水平的检测在于衡量机体清除氧自由基的能力,对MDA含量的检测在于衡量机体受到自由基攻击时受损伤的严重程度。
从试验结果来看,随着硒含量的增加,睾丸组织的GSH-Px和SOD的活性在逐渐升高,说明睾丸组织的抗氧化能力也在逐渐提高。此外,睾丸组织中MDA的含量也在逐渐升高,说明在硒含量较高的组织中,脂质过氧化反应也比较剧烈,从而造成了MDA的产生也比较多。分析其原因,可能是由于过量的硒导致自由基的产生,引起了脂质过氧化反应,从而使机体的抗氧化系统激活,产生抗氧化酶来抑制脂质过氧化。这种机制可能是机体对外界刺激的一种适应性调节。值得指出的是,对照组的MDA含量显著高于4 mg/kg组,这说明硒缺乏更容易导致活性氧(ROS)的产生,使组织发生脂质过氧化反应。许多研究也得到了与本试验类似的结论[10-12]。因此,母体中的硒元素可以通过胎盘与乳汁转移给后代,适量的硒元素可以提高组织的抗氧化能力,过量的硒元素又会增加脂质过氧化反应,造成MDA含量升高,从而对组织细胞造成不良影响。新生羔羊的消化和排泄功能还不太健全,对高硒的耐受力较差,如果直接补硒缺乏相应的标准且剂量不易控制,对于羔羊的补硒可以从母体来考虑,但应该特别注意母羊日粮中的添加量。
[1]Lu J X,Kaeck M,Jiang C,et al.Selenite induction of DNA strand breaks and apoptosis in mouse leukemic L1210 cells[J].Biochem.Pharmacol.,1994,47:1531-1535.
[2]Zeng H,Combs G F Jr.Selenium as an anticancer nutrient:roll in cellproliferation and tumercellinvasion[J].J.Nutr.Biochem.,2008,19:1-7.
[3]黄志坚,林藩平,邱承亮,等.富硒酵母对奶牛抗氧化能力和免疫功能的影响[J].营养学报,2004,26(1):27-30.
[4]夏枚生,胡彩虹,王旭辉,等.纳米硒对仔猪生长和抗氧化的影响[J].中国畜牧杂志,2006,42(3):28-30.
[5]郭云霞,郝庆红,黄仁录,等.日粮中添加酵母硒对柴鸡抗氧化能力的影响[J].畜牧与兽医,2007,39(11):46-49.
[6]Kincaid R L,Hodgson A S.Relationship of selenium concentrations in blood of calves to blood selenium of the dam and supplemental selenium[J].Journal of Dairy Science,1989,72:259-266.
[7]Enjalbert F,Lebreton P,Salat O,et al.,Effects of pre-or postpartum selenium supplementation on selenium status in beef cows and their calves[J].Journal of Animal Science,1999,77:223-229.
[8]Pehrson B,Ortman K,Madjid N,et al.The influence of dietary selenium as selenium yeast or sodium selenite on the concentration of selenium in the milk of suckler cows and on the selenium status of their calves[J].Journal of Animal Science,1999,77:3371-3376.
[9]Cuesta P A,McDowell L R,Kunkle W E,et al.,Effects of high-dose prepartum injections of Se and vitamin E on milk and serum concentrations in ewes[J].Small Ruminant Research,1995,18:99-103.
[10]郭云霞,郝庆红,黄仁录,等.日粮中添加酵母硒对柴鸡抗氧化能力的影响[J].畜牧与兽医,2009,39(11):46-49.
[11]许宗运,张丽娟,韩俊文,等.不同水平酵母硒对奶牛血液抗氧化能力的影响[J].动物营养学报,2007,19(6):753-757.
[12]张乙山,边连全,游思亲.三种硒源对生长育肥猪组织硒沉积及抗氧化能力的影响[J].饲料工业,2008,29(1):18-20.

