高频超声对结节性甲状腺肿合并甲状腺微小癌的诊断价值
林学英 LIN Xueying
林礼务 LIN Liwu
薛恩生 XUE Ensheng
何以敉 HE Yimi
林晓东 LIN Xiaodong
俞丽云 YU Liyun
作者单位
福建医科大学附属协和医院超声科,福建省超声医学研究所 福建福州 350001
论著 Original Research
高频超声对结节性甲状腺肿合并甲状腺微小癌的诊断价值
林学英 LIN Xueying
林礼务 LIN Liwu
薛恩生 XUE Ensheng
何以敉 HE Yimi
林晓东 LIN Xiaodong
俞丽云 YU Liyun
作者单位
福建医科大学附属协和医院超声科,福建省超声医学研究所 福建福州 350001
中国医学影像学杂志
2012年 第20卷 第8期:618-621
Chinese Journal of Medical Imaging 2012 Volume 20(8): 618-621
目的 分析结节性甲状腺肿(NG)合并甲状腺微小癌(TMC)的超声声像图特点,以提高TMC的术前超声检出率。资料与方法 回顾性分析经手术病理证实的64例NG合并TMC的超声声像图表现,并以同病例邻近癌灶且直径≤1cm的NG结节作为对照。结果 TMC与NG结节在形态、边界、回声强度、声晕、微小钙化、囊性变与血流分布等方面差异有统计学意义(P<0.01),回声均匀程度差异无统计学意义(P>0.05)。颈部淋巴结肿大超声检出率为89.47%(17/19)。结论 TMC具有与NG结节不同的声像图特点,TMC的灰阶超声特点为低回声、无声晕、有微小钙化、无囊性变等,彩色多普勒超声显示病灶内部血流信号丰富或无血流,周边少或无血流信号。在NG检查中重点观察≤1cm的低回声结节,以及早发现TMC。
甲状腺肿,结节性;甲状腺肿瘤;超声检查,多普勒,彩色
甲状腺微小癌(thyroid microcarcinoma, TMC)指直径≤1cm的甲状腺癌[1],因其缺乏特异性表现,多数在行甲状腺检查时偶然发现。既往认为TMC无典型超声声像图表现,尤其是合并结节性甲状腺肿(nodular goiter, NG)时,微小癌病灶常常被NG结节声像掩盖或混淆而漏诊[2],从而贻误诊治。本文回顾性分析64例NG合并TMC的声像图表现,以提高TMC的术前超声检出率。
1 资料与方法
1.1 研究对象 2004-01~2010-08福建医科大学附属协和医院64例NG合并TMC住院患者,男6例,女58例;年龄24~72岁,平均(50.8±11.6)岁。48例健康体检时偶然发现,16例因甲状腺肿大或颈部肿块就诊。64例均行术前超声检查,并经手术病理确诊。同时选择同病例邻近癌灶且直径≤1cm的NG结节作为对照组。
1.2 仪器与方法 使用Aloka5500、α10,Sequoia 512彩色多普勒超声诊断仪,探头频率7.5~10.0MHz。受检者取仰卧位,充分暴露检查区,行甲状腺超声检查,记录病灶数目、大小、形态、内部回声及有无包膜、声晕等。回声强度:回声低于颈前肌群视为低回声,反之为等或高回声。以彩色多普勒超声检测病灶周围及内部血流情况,并将血流分为3型[3]:Ⅰ型,无血流;Ⅱ型,病灶周边可探及较丰富的血流信号,内部无或少许血流信号;Ⅲ型,病灶内部血流信号丰富,周边少或无血流信号。扫查双侧颈部及锁骨上区,观察并记录颈部有无肿大淋巴结。
1.3 统计学方法 使用SPSS 13.0软件,应用χ2检验对TMC与NG结节在形态、边界、回声强度、有无声晕、有无微小钙化、囊性变、回声均匀程度和血流分布差异进行比较,P<0.05表示差异有统计学意义。
2 结果
2.1 超声诊断与病理结果比较 64例NG均为多结节型,入选的NG结节最大直径0.29~1.0cm。TMC均为单发病灶,最大直径0.26~1.0cm。病理结果:64例TMC中,乳头状癌59例,滤泡状腺癌3例,髓样癌2例。超声诊断TMC 57例,NG结节误诊为TMC 4例,超声诊断准确率为91.41%(117/128)。
2.2 TMC与NG结节灰阶超声征象比较 表1显示TMC与NG结节在形态、边界、回声强度、有无声晕、有无微小钙化、囊性变方面差异有统计学意义(P<0.01),回声均匀程度差异无统计学意义(P>0.05)(图1、2)。病理检出19例(29.69%)伴颈部淋巴结转移,超声检出17例(89.47%),其中15例表现为肿大淋巴结呈低回声,纵横比增大,内见囊性变或微小砂粒样钙化,另2例仅表现为淋巴结体积增大,形态无明显改变,呈低回声(图3A)。
表1 TMC与NG结节灰阶超声征象比较[n(%)]
2.3 TMC与NG结节血流情况比较 表2显示TMC与NG结节血流情况差异有统计学意义(χ2=61.431, P<0.01)。TMC有26.56%表现为无血流信号,70.31%的病灶内部血流信号丰富,周边少或无血流信号(图3B)。NG结节50.0%表现为无血流信号。43.75%病灶周边可探及较丰富的血流信号,内部无或少许血流信号(图2)。
表2 TMC与NG结节血流情况比较[n(%)]
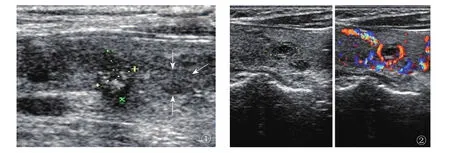
图1 右侧结节性甲状腺肿伴微小癌,右侧甲状腺中上份微小癌,0.74cm×0.57cm,低回声,形态不规则,边界不清,内见许多点状强回声;其下方一NG结节,0.69mm×0.45mm,与腺体等回声,界限清,周边见声晕,内回声均匀(箭)。图2 NG结节,右侧甲状腺下极囊实性结节,界限清,见低回声晕,周边见丰富的环状血流信号
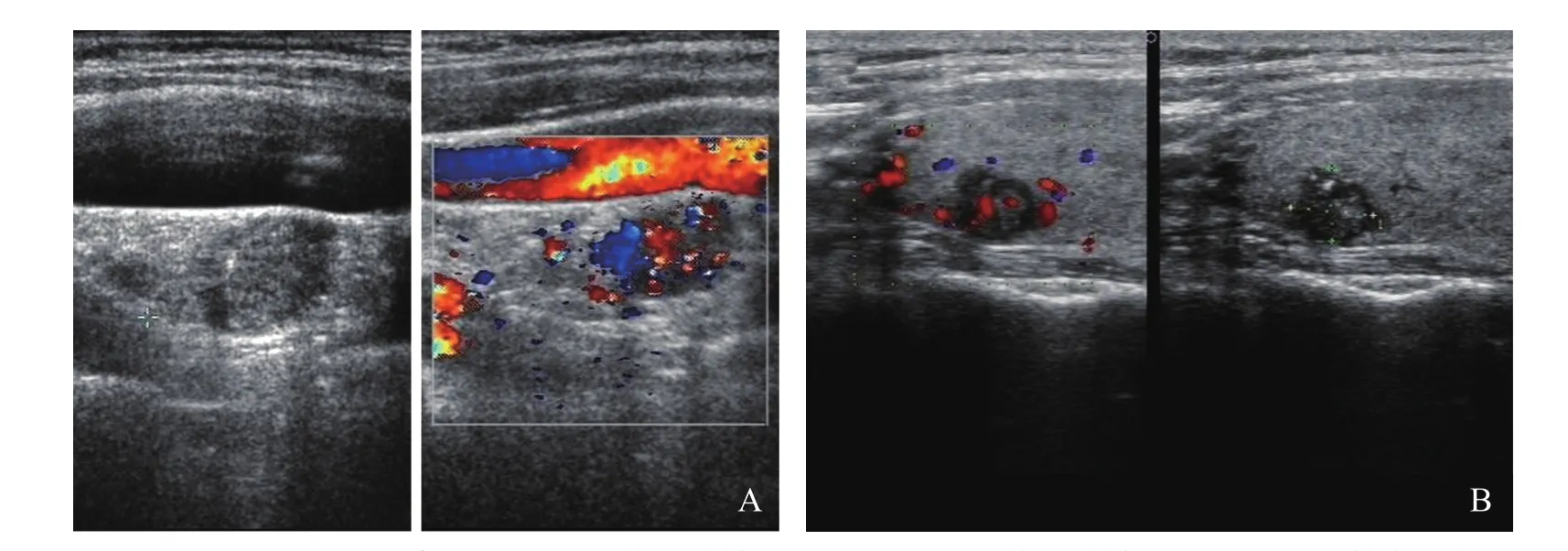
图3 右侧甲状腺微小癌伴右侧颈部淋巴结转移。A.右侧颈部淋巴结转移,右颈部血管旁见低回声结节,形态欠规则,内回声不均,可见丰富的血流信号,分布不规则;B.右侧甲状腺微小癌,右侧甲状腺上极低回声结节,0.72cm×0.64cm,形态不规则,边界不清,内见许多点状强回声,内见丰富血流信号
3 讨论
目前,采取患侧甲状腺并峡部切除治疗TMC,必要时行颈部淋巴结清扫,已为多数临床医师接受[4]。NG为良性病变,有严格的手术指征[5]。两者的处理方案不同,早期明确诊断有重要意义。本文回顾性分析了64例NG合并TMC的声像图表现,超声诊断准确率高达91.41%,TMC与NG结节在形态、边界、回声强度、声晕、微小钙化、囊性变和血流分布等方面差异有统计学意义(P<0.01),回声均匀程度差异无统计学意义(P>0.05),低回声、微小钙化对诊断TMC有很高的敏感性,而低回声、无声晕和无囊性变有很高的特异性。结合疾病特征分析如下:
3.1 低回声及微小钙化诊断TMC 低回声对诊断TMC有很高的敏感性和特异性,微小钙化对诊断TMC有很高的敏感性。本研究结果显示,95.31%(61/64)的TMC呈低回声(回声低于颈前肌群),且3例呈低回声的NG结节表现为边界清晰的低回声结节伴中央点状高回声,呈胶样增生结节表现。因此,声像图显示病灶回声低于颈前肌群、无中央点状高回声高度提示TMC可能。
近年来,越来越多的学者认为微小钙化为甲状腺乳头状癌的特异性表现,在微小癌中同样显示该特点[6],本研究中有54.69%的TMC出现微小钙化,其发生机制可能为乳头尖端发生局限性、进行性梗死,引起钙盐沉积于死亡细胞或血管壁的小钙化。由于营养障碍、钙化-草酸钙结晶形成、纤维化区萎缩的滤泡等原因[7],NG结节亦可出现大片组织的广泛钙化,也可出现小片区域的钙盐沉积,甚至微小钙化,本研究即有3.12%的NG结节出现微小钙化。因此,微小钙化在诊断TMC中有很高的敏感性,但仍有一定的假阳性率,需结合其他征象综合作出诊断。
3.2 无声晕和无囊性变诊断TMC 无声晕和无囊性变对诊断TMC有很高的特异性。NG结节随着病程的发展,部分结节由增生较厚的纤维组织形成完整包膜,少数周边会有声晕形成,本组17.19%的NG结节周边见完整声晕,而TMC呈侵袭性生长,极少在周边形成完整声晕,本组64例TMC均无声晕,因此,有声晕首先考虑为良性结节。82.81%的NG结节无声晕,因此,无声晕并不能单独作为诊断TMC的特异性征象。
与1cm以上的甲状腺乳头状癌会有10%~30%发生囊性变[8]的结论不同,本文分析的为≤1cm的TMC,结果显示无一例出现囊性变;而NG结节有59.38%出现囊性变,因此,对于1cm以下的甲状腺结节出现囊性变,应首先考虑为良性病变。
3.3 TMC与NG彩色多普勒超声血流特征 TMC以Ⅰ型或Ⅲ型血流为主,又多表现为结节内部血流信号丰富、分布紊乱,周边少或无血流信号,这与TMC是实体瘤,其生长是血管依赖性的,由于高代谢和肿瘤组织快速生长的原因导致内部血管形成较多,而新生血管缺乏平滑肌组织,管壁薄,分布不规则、走行扭曲的病理基础一致[9]。NG结节是一种非肿瘤性结节,小叶或一群集聚的充满胶质的滤泡周围有纤维组织包绕而形成结节,纤维组织包绕使间质血管受压,造成结节供血不足[7],多表现为无血流或周边可探及较丰富的血流信号,内部无或少许血流信号,本组结果显示,NG结节以Ⅰ型或Ⅱ型血流为主。但TMC与NG结节两者均有较多病例表现为无血流信号,因此,并非无血流即提示良性病变[10]。
3.4 形态、边界与回声均匀程度 Ito等[8]报道形态不规则、边界不清预示着生物学行为会有侵袭性的特点。但在良性病灶中,由于炎症和淋巴细胞向周围组织浸润亦会出现形态不规则、边界不清的情况,本文NG结节中有10.94%形态不规则,12.5%边界不清。35.94%的TMC形态规则、34.37%边界清晰,说明形态规则、边界清晰在TMC的声像图中极为常见。
回声均匀与否取决于病灶内是否存在明显的声阻抗差异,TMC和NG结节均可表现为内部回声不均,但NG结节常常因为囊性变、纤维化、大片钙化等致回声不均匀,而TMC内为实质性低回声不均匀,有时伴有微小钙化,因此虽然两者回声不均匀的发生率无明显差异,但声像图上还是有各自的特点。
3.5 淋巴结转移情况 有学者报道TMC颈部淋巴结转移的发生率为33.3%~60.9%,颈部淋巴结转移可能是TMC最早出现的症状[11],本组结果显示,29.69%的TMC发生颈部淋巴结转移,其超声检出率高达89.47%。因此,对甲状腺病变应详细检查双侧颈部淋巴结,尤其是容易遗漏的部位,如气管食管沟和上纵隔[12]。
综上所述,TMC的灰阶超声特点为低回声、无声晕、有微小钙化、无囊性变等,彩色多普勒超声特点为病灶内部血流信号丰富,周边少或无血流信号。因此,在NG病例检查中注意分辨不同的结节,对≤1cm的低回声结节重点观察,并检查双侧颈部淋巴结,以尽早检出TMC,为临床选择治疗方案提供有力的影像学依据。
[1] Baudin E, Travagli JP, Ropers J, et al. Microcarcinoma of the thyroid gland. Cancer, 1998, 83(3): 553-559.
[2] 褚洁, 杨丽春. 甲状腺微小乳头状癌的超声诊断及进展.中国医学影像技术, 2010, 26(10): 1996-1998.
[3] Rago T, Vitti P, Chovato L, et al. Role of conventional ultrasonography and color flow Doppler sonography in predicting malignancy in "cold" thyroid nodules. Eur J Endocrinol,1998, 138(1): 41-46.
[4] 孙传政, 陈福进, 曾宗渊, 等. 小于45岁的分化型甲状腺癌患者预后因素分析. 中华普通外科杂志, 2006, 21(1): 29-31.
[5] 李强, 韩晓婷. 结节性甲状腺肿合并甲状腺微小癌的诊断与治疗. 现代肿瘤医学, 2008, 16(9): 1472-1473.
[6] 龙丽娟, 胡蓉, 邵波, 等. 超声探测钙化灶在甲状腺结节诊断中的临床价值. 中国医学影像学杂志, 2009, 17(4): 286-288.
[7] 何涛, 王柏林, 黄道中. 结节性甲状腺肿的超声表现及病理学基础. 放射学实践, 2007, 22(6): 647-649.
[8] Ito Y, Kobayashi K, Tomoda C, et al. Ⅲ-defned edge on ultrasonographic examination can be a marker of aggressive characteristic of papillary thyroid microcarcinoma. World J Surg, 2005, 29(8): 1007-1011.
[9] 曾慧茹, 毛丽, 郭猛.甲状腺微小癌超声误诊原因分析.中国误诊学杂志, 2001, 1(11): 1684-1685.
[10] Senchenkov A, Staren ED. Ultrasound in head and neck surgery: thyroid, parathyroid, and cervical lymph nodes. Surg Clin North Am, 2004, 84(4): 973-1000.
[11] 杨帆, 郭美金, 吴斌, 等. 甲状腺微小癌的超声表现及其诊断. 中国医学影像学杂志, 2009, 17(4): 310-312.
[12] 石岚, 黄韬. 甲状腺乳头状癌淋巴结转移规律的研究.中华普通外科杂志, 2007, 22(7): 524-526.
(责任编辑 张春辉)
Value of High-frequency Ultrasound in Diagnosing Nodular Goiter Combined with Thyroid Microcarcinoma
Purpose To analyze the sonographic appearance of nodular goiter (NG) combined with thyroid microcarcinoma (TMC), and to increase the preoperative detection rate of TMC.Materials and Methods Sonographic fndings of 64 cases of NG combined with TMC proved by pathology were retrospectively analyzed. The NG nodules≤1cm in diameter neighbouring TMC in the same case were included as controls.Results There was statistical difference in shape, boundary, echo intensity, acoustic halo, microcalcifcation, cystic degeneration and blood distribution between TMC and NG (P<0.01). There was no signifcant difference in echoic uniformity coefficient between MC and NG (P>0.05). Detection rate of lymphadenopathy of ultrasound in the neck was 89.47% (17/19).Conclusion TMC has different sonographic features from NG nodules. TMC shows low-echo, small calcifcation, no halo or cystic degeneration on gray-scale ultrasound images and internal plentiful or no blood fow, as well as periphery little or no blood fow on color Doppler fow images. Observing the low level echo nodule which is≤1cm in diameter will be helpful to detect TMC early.
Goiter, nodular; Thyroid neoplasms; Ultrasonography, Doppler, color
林学英
2011-10-09
10.3969/j.issn.1005-5185.2012.08.017
2012-04-11
Department of Ultrasound, Union Hospital of Fujian Medical University, Fujian Provincial Ultrasonic Medicine Institute, Fuzhou 350001, China
Address Correspondence to: LIN Xueying E-mail: lxyycb@sina.com
中国图书资料分类法分类号R736.1;R730.41

