低水多变环境下玉米叶片的光合与反射光谱特征
孙 莉,苏根强,刘艳梅,赵闫闫,史刚荣1,
(1.黄土高原土壤侵蚀与旱地农业国家重点实验室,陕西杨凌 712100;2.淮北师范大学生命科学学院,安徽淮北 235000)
1 前言
干旱是制约植物生长和生产力的重要环境因子之一。严重干旱几乎影响植物的所有代谢过程,导致植物死亡[1]。玉米是我国重要的粮食作物,其生育期耗水较多且对水分胁迫比较敏感,干旱对其生长发育影响较大[2]。我国每年玉米种植面积约为3 000万hm2,2/3的面积分布于依靠自然降雨的丘陵或平原上。由于降雨量不足或分布不均,导致玉米生产受到干旱的极大制约[3,4]。因此,干旱胁迫对玉米生长发育的影响一直是国内外学者研究的热点。
干旱与短期湿润交替,即“多变低水”是我国北方,也是所有半干旱区作物生长的实际田间环境[5]。在无灌溉条件的雨养农业地区,自然状态下的作物生长,不时处在干湿变化的水分环境中,并且具有一定的普遍性。在具备补充灌水能力的半干旱、半湿润地区,干湿交替供水作为一种新的灌水模式,已被人们广泛采用。因此,研究植物对多变低水环境的响应机制较之单纯研究抗旱机制将更具现实意义。
光合作用作为植物初生代谢的关键生理过程,在植物抵御干旱胁迫的过程中起着重要作用[6,7]。当水分亏缺时,植物叶片光合速率下降,其同化产物将主要向根系分配,从而增加根冠比,以适应干旱环境。水分亏缺既可通过影响叶肉组织和气孔运动限制CO2扩散,从而降低胞间 CO2浓度和同化速率[8],又可通过降低光合色素含量[1],抑制光合作用的关键酶的活性[9],导致叶片光合速率下降。此外,干旱还可诱发氧胁迫,通过活性氧破坏光合机构[10],间接导致光合速率下降。
关于干旱胁迫对植物光合生理特性的影响已有大量文献报道[6,8~10],但对于多变低水条件下植物光合作用的变化及其生理生态意义的研究相对较少,且主要局限于单个干旱-复水周期的研究[11,12],关于植物光合作用在干旱-复水周期中的变化规律尚不清楚。另外,光谱反射技术能够反映植物叶片光合色素的变化,由于其实时、快速、无损、精确等特点,近年来在胁迫研究中得到广泛应用[13~15]。因此,通过研究多变低水条件下叶片的光合特性和反射光谱特征的变化规律,为玉米抗旱节水栽培提供理论依据。
2 材料与方法
2.1 试验设计
供试玉米品种为苏玉19(cv.Suyu 19,购自江苏省农业科学院)。盆栽试验于2011年3—5月在塑料大棚中进行(不补充光照)。土壤取自淮北农田土壤(田间最大持水量为25.2%)。每盆(内径18 cm、深16 cm)装入2.2 kg的风干土。通过插到底部的硬质塑料管浇水(以避免堵塞和土壤板结)。每天称量补水并记录。实验分为对照(田间持水量的75% ~80%)、持续干旱(田间持水量的35% ~40%)和干湿交替(干旱胁迫2周,复水处理1周,再干旱胁迫2周,复水处理1周)3个处理,每个处理24盆。三叶期定苗,每盆留大小相同的幼苗2株。在每次复水后第七天分别测定气体交换、叶绿素荧光参数以及反射光谱等指标。
2.2 测定项目与方法
2.2.1 植株生物量
轻轻从土壤中挖出植株后,将根系和地上部分分开,根系用自来水冲洗干净,连同地上部分一起置于105°C杀青30 min,再在70°C下烘至恒重,称重并计算根冠比。
2.2.2 叶绿素荧光
在收获前,用Mini PAM(Walz,德国)测定叶绿素荧光参数。植株叶片暗适应30 min后,测定最小荧光(Fo)、最大荧光(Fm)和Fv/Fm(可变荧光和最大荧光之比)。在光强为 500 μmol·m-2·s-1光化光下测定瞬时荧光 Fs,在光强为5 000 μmol·m-2·s-1的饱和脉冲下测定最大荧光(Fm'),按下式计算光系统II有效量子产额(ΦPS II):ΦPS II=(Fm'- Fs)/Fm'。
2.2.3 气体交换
采用美国LI-6400便携式光合作用测定仪(Li-Cor,Lincoln,美国)测定倒2叶的净光合速率(Pn)、气孔导度(Gs)、胞间CO2浓度(Ci)和蒸腾速率(E),光量子通量密度(PFD)为1 000 μmol·m-2·s-1。
2.2.4 反射光谱的测量
采用 UNI-spec反射光谱分析系统(PPSystems,美国)测定310-1138 nm波长范围的叶片反射光谱,并计算:mSR705=(R705-R445)/(R750+R445);SIPI=(R800-R445)/(R800-R680);chlNDI=(R750-R705)/(R750+R705);REP=700+40×[(Rre– R700)/(R740– R700)],其中,Rre=(R670+R780)/2,R表示光谱反射率。
2.3 数据分析
原始数据用SPSS for windows 17.0进行统计分析,用one way ANOVA揭示不同处理对各项指标比较影响。用Duncan检验进行比较,确定相应指标在不同处理间的差异是否显著(P<0.05)。
3 结果与分析
3.1 旱后复水对玉米生物量及根冠比的影响
生物量是植物的基本外部特征,地下生物量反映了植物根系的生长状况。根冠比是衡量生物量分配比例受水分胁迫影响程度的重要指标。由图1可见,第一次复水后,玉米幼苗的根系生物量在不同处理之间无显著差异(P<0.05),但多变低水和持续干旱处理幼苗的地上部分生物量显著低于对照,从而导致根冠比显著大于对照(P<0.05)。地上部分生物量和根冠比在多变低水和持续干旱之间差异不显著(P>0.05)。第二次复水后,多变低水和持续干旱处理的根系和地上部分生物量均显著低于对照(P<0.05)。根冠比在对照与多变低水处理之间没有差异,且二者均显著小于持续干旱(P>0.05)。
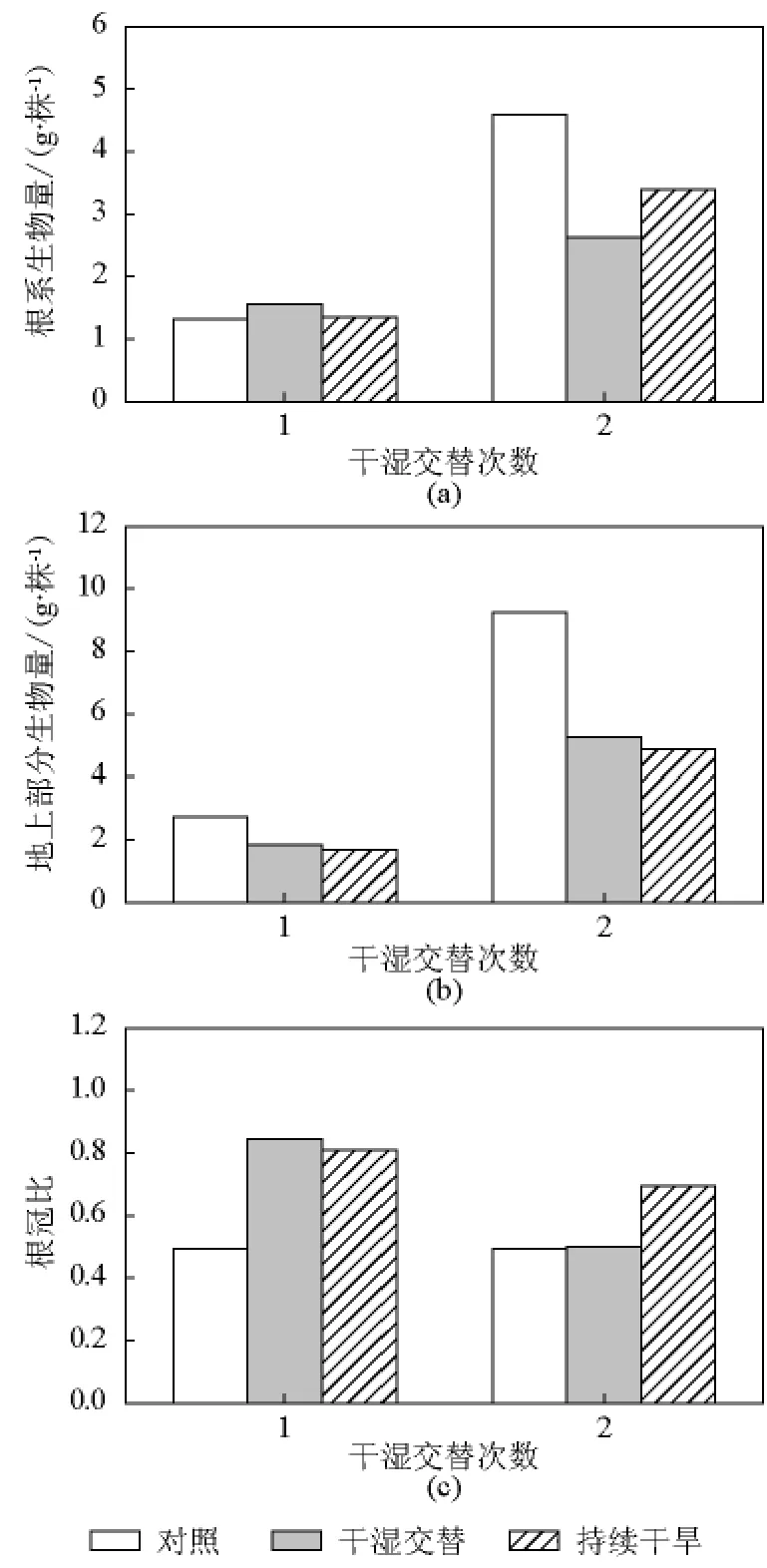
图1 旱后复水对玉米生物量及根冠比的影响Fig.1 Effects of rewetting after drought onbiomass and root to shoot ratio of maize
3.2 旱后复水对气体交换的影响
由图2可见,第一次复水后,持续干旱处理的幼苗叶片净光合速率(Pn)显著小于对照,多变低水处理介于对照和持续干旱处理之间。气孔导度(Gs)、胞间CO2浓度和蒸腾速率(E)在不同处理之间没有显著差异(P>0.05)。第二次复水后,持续干旱处理植株的Pn和Gs显著低于对照和多变低水处理(P<0.05),而在对照和多变低水处理之间的差异不显著(P>0.05)。胞间CO2浓度在不同处理之间没有显著差异(P>0.05)。与对照相比,多变低水处理显著增大叶片的蒸腾速率,而持续干旱则显著降低蒸腾速率(P<0.05)。

图2 旱后复水对玉米叶片气体交换的影响Fig.2 Effects of rewetting after drought on gas exchange in leaves of maize
3.3 旱后复水对叶绿素荧光参数的影响
由图3可见,第一次复水后,不同处理植株的Fv/Fm和ΦPS II没有显著差异(P>0.05)。第二次复水后,持续干旱处理植株的Fv/Fm显著低于对照和多变低水处理,处理组植株的Fv/Fm显著高于持续干旱处理(P<0.05),但Fv/Fm在对照和多变低水处理之间的差异不显著(P>0.05);ΦPS II在三个处理之间无显著差异(P>0.05)。
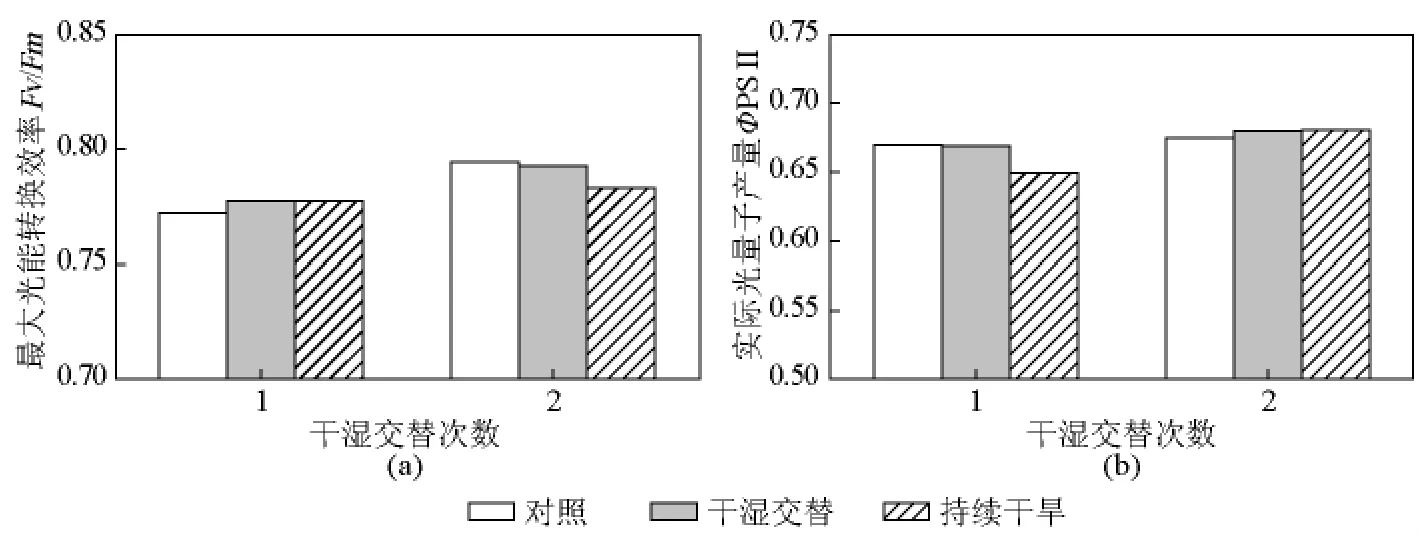
图3 旱后复水对玉米叶片叶绿素荧光的影响Fig.3 Effects of rewetting after drought on chlorophyll fluorescence in leaves of maize
3.4 旱后复水对叶片反射光谱特征参数的影响
由图4可知,第一次复水后,持续干旱处理植株的叶片反射光谱特征参数(mSR705、chlNDI和REP)显著低于对照(P<0.05),多变低水处理界于二者之间,且无显著差异(P>0.05),SIPI在三个处理之间的差异不显著(P>0.05)。第二次复水后,持续干旱处理叶片mSR705、chlNDI和REP显著低于对照(P<0.05),而上述指标在多变低水处理中则略高于对照,但差异不显著。多变低水处理下,叶片SIPI显著低于对照和持续干旱处理植株,后二者之间的差异不显著(P>0.05)。
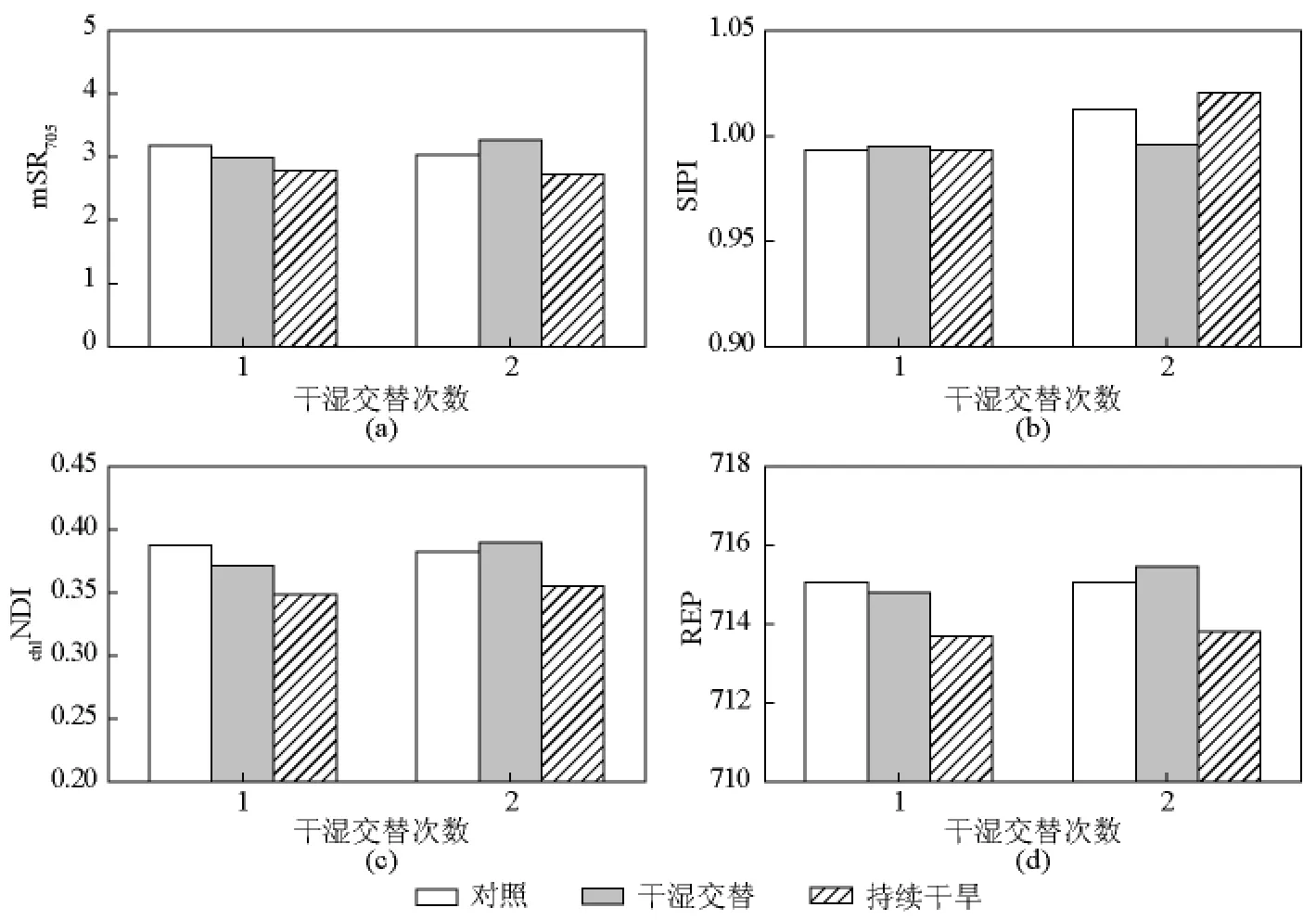
图4 旱后复水对玉米叶片叶绿素荧光的影响Fig.4 Effects of rewetting after drought on chlorophyll fluorescence in leaves of maize
4 结语
植物在受到资源限制时,通常会调节生物量分配以适应环境变化。在干旱胁迫下,地上与地下生物量的合理分配有利于增加植物的水分利用效率及干旱适应能力。一般地,在干旱胁迫下植物通过增大地下部分比例来提高水分及养分的利用效率[16]。研究结果表明,干旱胁迫明显抑制了玉米植株根系和地上部分的生物量积累,但根冠比显著增大。干旱诱导根冠比的增大在发育早期更为显著。说明在水分亏缺时,玉米通过增加地下生物量分配,将生长中心向根系转移,试图从土壤中吸收更多的水分。结果与前人的报道相一致[16,17]。
已有研究证明,水分胁迫并不是完全对作物生长不利,在某生育阶段经过适度水分胁迫后复水可以使作物产生生理、生长和产量的补偿效应,提高其水分利用效率[18,19]。研究结果表明,在低水多变处理下,玉米幼苗的根系和地上部分生物量均显著小于正常供水。根冠比在第一次复水后显著大于正常供水,但在第二次复水后与正常供水没有差异。可见,在低水多变环境下,玉米通过调节生物量分配适应水分的时间异质性。
光合作用是植物重要的生命活动,是植物生长的生理基础。许多研究表明,光合作用对叶片水分亏缺非常敏感,轻度的干旱胁迫就会使植物的光合速率下降,生长受到明显抑制[6,8,9]。因此,植物在干旱胁迫条件下的光合生产力常被认为是鉴定植物耐旱能力的重要指标之一。在该研究中,持续干旱导致玉米光合速率显著下降,且下降幅度随干旱时间的延长而增大。然而,在低水多变条件下,玉米叶片的Pn、Gs和Ci与正常供水没有显著差异。可见,多变低水环境下,玉米幼苗光合作用能够维持在较高水平。
植物叶片净光合速率在受到环境胁迫时下降分为气孔限制和非气孔限制两类。Farquhar和Sharkey[20]认为只有 Pn、Gs和 Ci变化规律相同时,Pn 的变化是由Gs引起的,反之,如果Pn、Gs和Ci的变化不一致,则Pn的变化是由叶肉细胞活性决定的即非气孔限制。在第一次复水后,持续干旱引起玉米Pn的下降并不伴随Gs和Ci的下降,因此可以认为是由非气孔限制因素所致。然而,在第二次复水后,Pn和Gs同时下降,但Ci保持不变,说明既有气孔限制因素,又有非气孔限制因素。
叶绿素荧光参数是快速、灵敏、无损伤的研究和探测干旱逆境对植物光合作用影响的理想方法[21],干旱胁迫主要伤害植物光合机构PS II[22],PS II主动调节电子传递速率和光化学效率,以响应CO2同化能力降低,通过热耗散形式避免或减轻过剩光能对其系统的损伤[23]。ФPS II表示的是PS II的实际光能转化效率,它反映PS II反应中心在有部分关闭情况下的实际原初光能捕获效率[24]。该研究中,第一次复水后,玉米的Fv/Fm和ФPS II在不同处理之间无显著差异,表明早期幼苗PS II对干旱胁迫不敏感。然而,在第二次复水后,持续干旱处理幼苗的Fv/Fm较对照显著降低,说明干旱导致植物叶片系统受到损害,光合机构及光合酶系统被破坏[25]。低水多变处理的玉米Fv/Fm和ФPS II与正常供水没有显著差异。
光合色素是植物进行光合作用的必要条件,其含量的高低直接影响光合能力。由于反射光谱特征与植物叶片的色素含量密切相关,所以可以有效地反映植物受胁迫的情况[26]。mSR705、REP与叶绿素的含量密切相关,chlNDI表示的是叶绿素 a的大小[27]。在该试验中,持续干旱处理幼苗的mSR705、chlNDI和REP均显著小于对照,说明干旱胁迫导致叶片叶绿素含量降低。SIPI反映类胡萝卜素/叶绿素a比值的变化[28]。在该实验中,SIPI不受持续干旱影响。但在第二次复水后,多变低水处理幼苗的SIPI显著小于对照。表明多变低水条件下玉米叶片类胡萝卜素/叶绿素a比值下降。Pn的变化趋势与mSR705、chlNDI和REP相一致,说明水分亏缺导致的叶绿素含量下降是光合速率下降的重要原因。
综上所述,持续干旱处理抑制植株生长,增加根冠比,并通过气孔限制和非气孔限制因素抑制光合作用。在多变低水环境下,玉米生物量分配、光合作用和光谱特征均维持在正常供水植株水平,这种表型维持现象随干湿交替次数的增加更趋明显,这可能是玉米适应多变低水环境的重要生理机制。
[1]Jaleel C A,Manivannan P,Wahid A,et al.Drought stress in plants:A review on morphological characteristics and pigments composition [J].International Journal of Agriculture and Biology,2009,11:100–105.
[2]何海军,寇思荣,王晓娟.干旱胁迫对不同株型玉米光合特性及产量性状的影响[J].干旱地区农业研究,2011,29:63-66.
[3]施关正,赵 致,袁玉清.干旱胁迫下玉米杂交组合抗旱性及水分利用的研究[J].玉米科学,2008,16:103-107.
[4]王晓琴,袁继超.玉米抗旱性研究的现状及展望[J].玉米科学,2002,10:57-60.
[5]山 仑,邓西平,苏 佩,等.挖掘作物抗旱节水潜力——作物对多变低水环境的适应与调节[J].中国农业科技导报,2000,2:66-70.
[6]Pinheiro C,Chaves MM.Photosynthesis and drought:can we make metabolic connections from available data?[J]Journal of Experimental Botany,2011,62:869-882.
[7]Lawlor D W,Tezara W.Causes of decreased photosynthetic rate and metabolic capacity in water- deficient leaf cells:a critical evaluation of mechanisms and integration of processes[J].Annals of Botany,2009,103:561-579.
[8]Flexas J,Diaz- Espejo A,Galmés J,et al.Rapid variations of mesophyll conductance in response to changes in CO2concentration around leaves[J].Plant,Cell & Environment,2007,30:1284-1298.
[9]Lawlor D W,Cornic G.Photosynthetic carbon assimilation and associated metabolism in relation to water deficits in higher plants[J].Plant,Cell& Environment,2002,25:275 -294.
[10]Chaves M M,Flexas J,Pinheiro C.Photosynthesis under drought and salt stress:regulation mechanisms from whole plant to cell[J].Annals of Botany,2009,103:551 -560.
[11]张林春,郝 扬,张仁和,等.干旱及复水对不同抗旱性玉米光合特性的影响[J].西北农业学报,2010,19:76-80.
[12]王 磊,张 彤,丁圣彦.干旱和复水对大豆光合生理生态特性的影响[J].生态学报,2006,26:2073-2078.
[13]Carter G A,Knapp A K.Leaf optical properties in higher plants:linking spectral characteristics to stress and chlorophyll concentration[J].American Journal of Botany,2001,88:677 -684.
[14]Poulos H M,Goodale U M,Berlyn G P.Drought response of two Mexican oak species,Quercus laceyi and Q.sideroxyla(Fagaceae),in relation to elevational position[J].American Journal of Botany,2007,94:809-818.
[15]Thorhaug A,Richardson A D,Berlyn G P.Spectral reflectance of Thalassia testudinum(Hydrocharitaceae)seagrass:low salinity effects[J].American Journal of Botany,2006,93:110 -117.
[16]李芳兰,包维楷,吴 宁.白刺花幼苗对不同强度干旱胁迫的形态与生理响应[J].生态学报,2009,29:5406-5416.
[17]Guo W,Li B,Zhang X,et al.Architectural plasticity and growth responses of Hippophae rhamnoides and Caragana intermedia seedlings to simulated water stress[J].Journal of Arid Environments,2007,69:385-399.
[18]Du T,Kang S,Sun J,et al.An improved water use efficiency of cereals under temporal and spatial deficit irrigation in north China[J].Agricultural Water Management,2010,97:66 -74.
[19]Farre I,Faci J M.Deficit irrigation in maize for reducing agricultural water use in a Mediterranean environment[J].Agricultural Water Management,2009,96:383 -394.
[20]Farquhar G D,Sharkey T D.Stomatal conductance and photosynthesis[J].Annual Review of Plant Physiology,1982,33:317-345.
[21]李潮海,赵亚丽,杨国航,等.遮光对不同基因型玉米光合特性的影响性[J].应用生态学报,2007,18:1259-1264.
[22]White A J,Critchley C.Rapid light curves:a new fluorescence method to assess the state of the photosynthetic apparatus[J].Photosynthesis Research,1999,59:63-72.
[23]卜令铎,张仁和,常 宇,等.苗期玉米叶片光合特性对水分胁迫的响应[J].生态学报,2010,30:1184-1191.
[24]Bilger W,Bjorkman O.Role of the xanthophyll cycle in photoprotection elucidated by measurements of light- induced absorbance changes,fluorescence and photosynthesis in leaves of Hedera canariensis[J].Photosynthesis Research,1990,25:173 -185.
[25]郭春芳,云 孙,云 张,等.茶树叶片抗氧化系统对土壤水分胁迫的响应[J].福建农林大学学报:自然科学版,2008,37:580-586.
[26]Madeira A C,Mendonca A,Ferreira M F,et al.Relationship between spectroradiometric and chloropuyll measurements in green beans communication [J].Soil Science and Plant Analysis,2000,31:631-643.
[27]Sims D A,Gamon J A.Relationships between leaf pigment content and spectral reflectance across a wide range of species,leaf structures and developmental stages[J].Remote Sensing of Environment,2002,81:337 -354.
[28]Pe uelas J,Baret F,Filella I.Semi- empirical indices to assess carotenoids/chlorophyll a ratio from leaf spectral reflectance[J].Photosynthetica,1995,31:221-230.

